Современные достижения в области микробиологии изменили устоявшуюся парадигму, касающуюся стерильности компартментов органов репродуктивной системы [1]. На сегодняшний день мировому научному сообществу предстоит решить, какие собственно микроорганизмы, контаминирующие эндометрий, претендуют на роль инфекционных агентов, вызывающих субклиническое воспаление, классифицируемое в МКБ-10, как хроническая воспалительная болезнь матки [2, 3].
В рутинной практике акушера-гинеколога далеко не всегда удается выявить причину бесплодия, в результате чего пациентка с диагнозом идиопатического бесплодия вступает в протоколы вспомогательных репродуктивных технологий (ВРТ). Однако недиагностированный хронический эндометрит (ХЭ) может быть причиной повторных неудач имплантации и самопроизвольных выкидышей, даже несмотря на перенос в полость матки эуплоидного эмбриона [4, 5].
Целью нашего исследования явилась оценка состава микроорганизмов полости матки у женщин с ХЭ и идиопатическим бесплодием и разработка схем терапии.
Материалы и методы
Общий дизайн исследования
С апреля 2015 г. по январь 2019 г. обследованы 145 пациенток репродуктивного возраста, которые были направлены на консультацию к репродуктологу в ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта» по поводу идиопатического бесплодия. Всем пациенткам выполняли гистероскопию с получением клинического материала для патоморфологического и иммуногистохимического (ИГХ) исследования на маркеры ХЭ, а также для микробиологического исследования. Все пациентки подписали информированное согласие на участие в исследовании.
Критерии включения в исследование: возраст от 25 до 40 лет включительно на момент включения в исследование; диагноз идиопатического первичного бесплодия до момента включения в исследование; наличие постоянного полового партнера; возраст постоянного полового партнера в момент включения в исследование до 50 лет; наличие полностью выполненного объема обследования бесплодной пары согласно Приказу Министерства здравоохранения РФ от 30 августа 2012 г. № 107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» (ред. от 11.06.2015 г. и от 01.02.2018 г.); отсутствие бесплодия или нарушения фертильности любого другого генеза.
Критерии невключения в исследование: возраст пациентки младше 25 лет, старше 40 лет; возраст супруга старше 50 лет; 2 и более постоянных половых партнеров; наличие бесплодия или нарушения фертильности другой этиологии, включая трубно-перитонеальное бесплодие, ановуляторное бесплодие, мужское бесплодие, в том числе при субфертильных результатах спермограммы; любые невоспалительные гинекологические заболевания, требующие хирургического лечения и/или назначения лекарственной терапии; сахарный диабет и другие нарушения углеводного обмена, некомпенсированное нарушение функции щитовидной железы и других желез внутренней секреции (гипофиз, надпочечники, паращитовидные железы, яичники), в том числе требующее назначения заместительной гормональной терапии; психиатрические заболевания, алкоголизм, наркомания, злокачественные новообразования, включая интраэпителиальные дисплазии любой локализации, и/или лимфопролиферативные заболевания в анамнезе или выявленные в период проведения исследования; индекс массы тела по Кетле более 29,9 кг/м2 или менее 18,5 кг/м2; ВИЧ-позитивные пациентки или пациенты с высоким риском инфицирования, профилактически получающие антиретровирусную терапию, пациентки с вирусным гепатитом В, C, в том числе в анамнезе; любые другие заболевания, которые, по мнению исследователей, влияют или способны оказывать влияние на результаты исследования; нежелание пациентки участвовать в исследовании и/или низкая комплаентность.
Клиническая и социальная характеристика пациенток с идиопатическим бесплодием
Всего в исследование было включено 145 женщин, соответствующих критериям включения и не имеющих критериев невключения.
Как видно из данных, приведенных в таблице 1, большинство обследованных женщин были в возрасте 35 [31;38] лет, имели высшее образование, индекс массы тела в большинстве случаев принадлежал интервалу 25–29,9 кг/м2, курящих и некурящих женщин было поровну.

Методы обследования пациенток
В качестве скринингового обследования перед гистероскопией получали венозную кровь из кубитальной вены с исследованием на наличие антител к ВИЧ-1, -2, маркеров вирусных гепатитов В и С, на сифилис, а также проводили клинический анализ крови, общий анализ мочи, биохимическое исследование и исследование коагулограммы.
У всех пациенток во время выполнения гистероскопии получали эндометрий с последующим гистологическим и ИГХ-исследованием. Гистероскопия выполнялась в 38 случаях на 7–9 день цикла, у 107 пациенток – на 19–22 день менструального цикла [6]. Гистологическое и ИГХ-исследование проводили по стандартной методике. Для диагностики ХЭ и степени выраженности использовали комбинацию антител СD8+ [клон СD8/144B], СD20+ [клон L26], СD4+ [клон 4В12], СD138+ [клон М115], в стандартном разведении 1:50; CD34+ [клон QBEnd-10] в стандартном разведении 1 : 25 производства Dako Cytomation (Дания), поскольку количество провоспалительных клеток не зависит от фазы менструального цикла. Степень выраженности ХЭ определяли по классификации Толибовой Г.Х. и соавт. (2015) [6].
Перед гистероскопией выполняли биопсию эндометрия с последующим микробиологическим исследованием полученного материала на наличие условно-патогенных микроорганизмов, а также патогенных микроорганизмов (хламидий, гонококков, Mycoplasma genitalium) и вирусов (вирус простого герпеса 1 и 2 типов, цитомегаловируса) методом полимеразной цепной реакции (ПЦР) в режиме реального времени (тесты Фемофлор 16 и Фемофлор Скрин, «ДНК-технология», Москва).
Противомикробная терапия ХЭ
В зависимости от состава микроорганизмов и наличия ХЭ пациентки получали системную антибактериальную терапию.
После проведения противомикробной терапии за пациентками наблюдали в виде периодического телефонного анкетирования, при этом на июль 2019 г. медиана наблюдения за пациентками составила 18,6 месяца (от 8 месяцев до 40,4 месяца).
Статистический анализ результатов исследования
Настоящее исследование являлось описательным, а не сравнительным (за исключением внутригруппового анализа полученных данных), поэтому никакие статистические гипотезы предварительно не определялись. Статистический учет собранного материала проводили с помощью электронной таблицы Microsoft Office Excel. Обработку результатов осуществляли с применением статистической программы для персонального компьютера PAST3. Проверка гипотезы о виде распределения проводилась с применением критерия Шапиро–Уилка. Изучаемые в работе количественные признаки (возраст) имели распределение, отличающееся от нормального, поэтому описательные статистики представлены в виде медианы (Ме) и межквартильного интервала [25–75 квартиль]. Качественные показатели представлены как в абсолютных (числа), так и относительных (удельный вес, %) величинах. Анализ качественных переменных (частота выявления микробного агента в каждой подгруппе) выполняли путем построения таблиц сопряженности с применением критерия согласия хи-квадрат (χ2) К. Пирсона и, учитывая относительно небольшое число наблюдений, точного критерия Р. Фишера (сравниваемые подгруппы выделены и отмечены в таблицах). Взаимосвязь между персистенцией микроорганизма и наличием или отсутствием заболевания (ХЭ, выраженный ХЭ) определяли путем определения отношения шансов (ОШ), при этом рассчитывался 95% доверительный интервал (95% ДИ). Во всех случаях критический уровень значимости принимался при р<0,05.
Этические правила и нормы
Исследование выполнено в соответствии с принципами Хельсинкской декларации Всемирной ассоциации «Этические принципы научных и медицинских исследований с участием человека», Действующими Порядками и Стандартами оказания медицинской помощи и другими применимыми регуляторными требованиями к проведению клинических исследований и наблюдательных программ в Российской Федерации. Протокол наблюдения за пациентами и программа обследования были одобрены локальным этическим комитетом.
Результаты
При выполнении диагностической гистероскопии полипы эндометрия выявлены у 18 (12,4%) пациенток, синехии полости матки ‒ у 1 (0,7%) пациентки.
По данным патоморфологического исследования, простая гиперплазия эндометрия без атипии выявлена у 18 (12,4%) пациенток, при этом в 3 (2,1%) случаях гиперплазия эндометрия сочеталась с наличием полипа эндометрия. Диагноз аденомиоза был установлен в 2 (1,4%) случаях. По данным ИГХ-исследования, ХЭ выявлен у 113 (77,9%) пациенток, при этом в данной когорте слабовыраженный ХЭ установлен у 11 (9,7%) женщин, умеренно выраженный ХЭ ‒ у 42 (37,2%) пациенток, выраженный ХЭ ‒ у 60 (53,1%) женщин.
При молекулярно-биологическом исследовании биоптатов эндометрия методом ПЦР в реальном времени с использованием теста Фемофлор 16 самыми частыми микроорганизмами, выявляемыми в полости матки, были лактобациллы (66,21%), а также стафилококки (44,83%), микроорганизмы семейства Enterobacteriaceae (22,1%), Streptococcus spp. (15,2%) (табл. 2). Следующими по частоте были микроорганизмы, ассоциированные с бактериальным вагинозом: Ureaplasma spр. (19,3%), Mycoplasma hominis (9,65%), Gardnerella vaginalis (11,03%), Atopobium vaginae (10,34%). Дрожжеподобные грибы рода Candida были обнаружены у 6 (4,14%) пациенток. Остальные микроорганизмы выявлялись существенно реже. Следует отметить, что все клинические материалы были исследованы на вирусы простого герпеса и цитомегалии. Эти вирусы выявлены лишь у двух женщин (0,7%). Ни у одной пациентки не были обнаружены хламидии, гонококки, Mycoplasma genitalium.
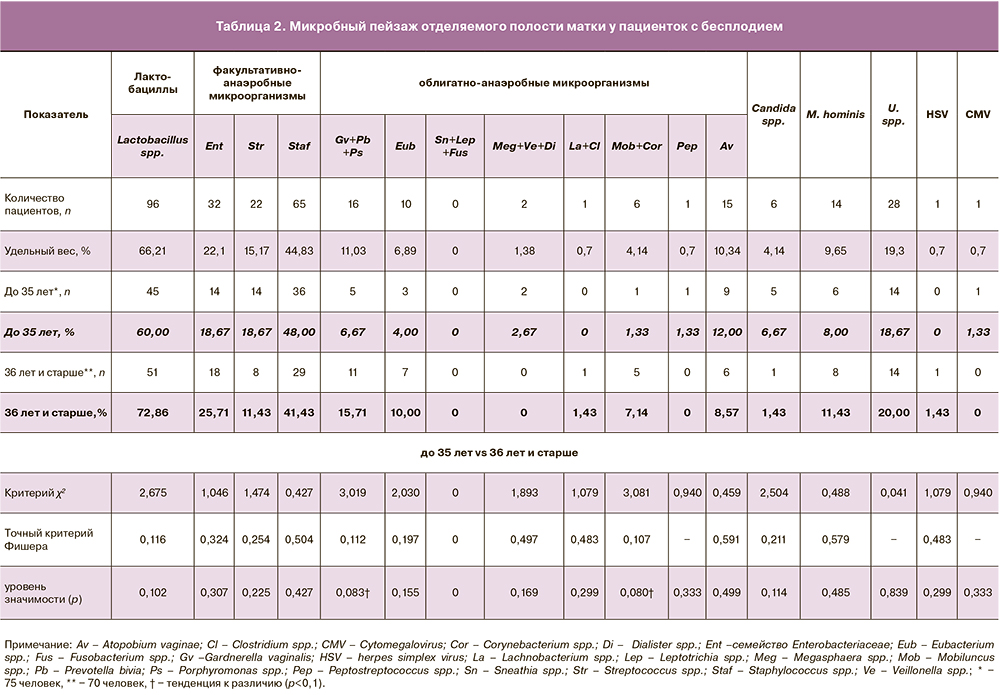
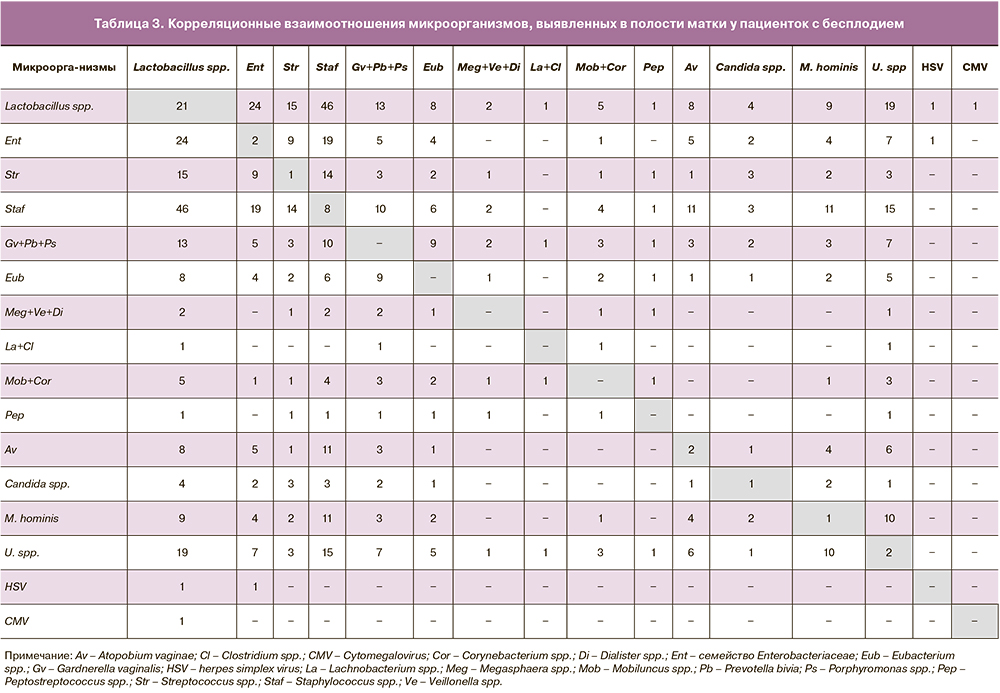
При анализе микробной составляющей полости матки следует подчеркнуть, что лишь в 11 (7,6%) образцах эндометрия не было выявлено никаких микроорганизмов. Только лактобациллы были обнаружены в 21 пробе, в остальных случаях было выявлено от одного (24,1%) до 9 (1,4%) микробных агентов. Наиболее часто (31,1%) одновременно выявлялись 2 рода микроорганизмов, реже – 3 (14,5%), 4 (12,4%), 5 (4,1%) и 6 (2,8%). В таблице 3 представлены сочетания микроорганизмов друг с другом. Наиболее часто выявляемые в эндометрии стафилококки сочетались с бактериями семейства Enterobacteriaceae и со стрептококками. Ureaplasma spр. наиболее часто сочеталась со Staphylococcus spp. (53,6%), Mycoplasma hominis (35,7%) и Gardnerella vaginalis (25,0%). Mycoplasma hominis также наиболее часто сочеталась со стафилококками (78,6%). Gardnerella vaginalis наиболее часто сочеталась со Staphylococcus spp. (62,5%) и Eubacterium spp. (56,3%).
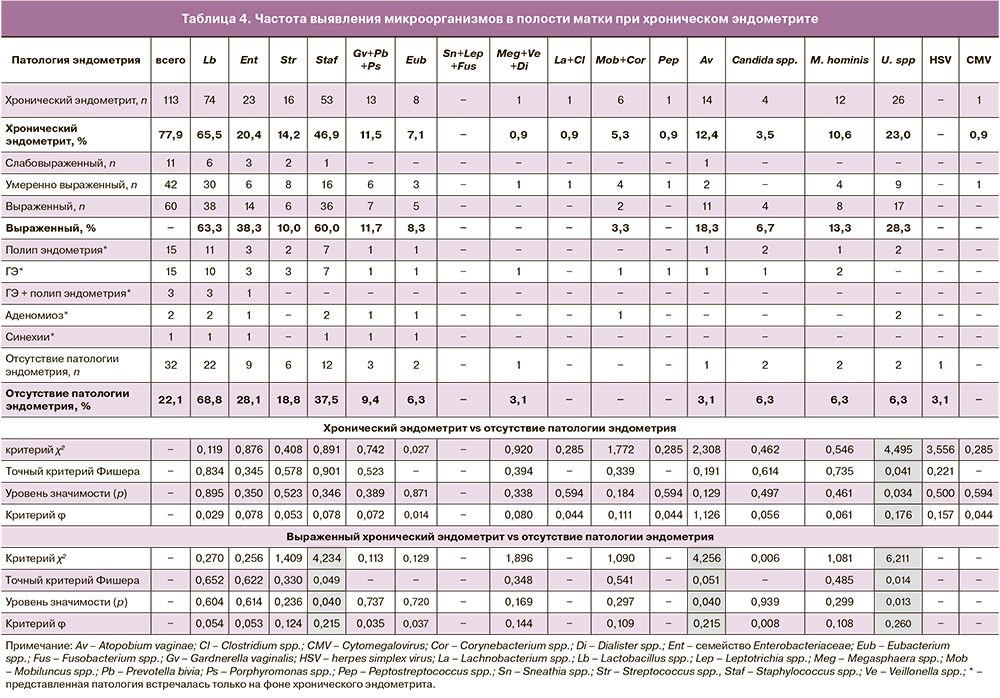
В таблице 4 представлена частота выявления микроорганизмов в полости матки у женщин с ХЭ. Частота идентификации Ureaplasma spр. у пациенток с ХЭ (26 положительных из 113 проб) была статистически значимо выше (92,9%; χ2=4,495; р=0,034) в сравнении с пациентками без диагностированного ХЭ при ИГХ-исследовании биоптатов эндометрия (2 положительные из 32 проб). При этом при наличии выраженного ХЭ уреаплазмы выявлены в 17 случаях (60,7%; χ2= 4,495; р=0,034). При выраженном ХЭ также существенно чаще были обнаружены Atopobium vaginae (93,3%) и Staphylococcus spp. (81,5%), р=0,04. Таким образом, наличие уреаплазм в полости матки существенно увеличивает риск развития ХЭ (ОШ=4,483; 95% ДИ 1,003‒20,029), при этом риск развития выраженного ХЭ увеличивается почти в 6 раз (ОШ=5,93; 95% ДИ 1,274‒27,595). Наличие Atopobium vaginae и Staphylococcus spp. также увеличивает риск развития выраженного ХЭ в 7 раз (ОШ=6,959; 95% ДИ 0,856‒56,602) и в 2,5 раза (ОШ=2,5; 95% ДИ 1,034‒6,043) соответственно.
Всем пациенткам с ХЭ проведено лечение. При выявлении в полости матки условно-патогенных микроорганизмов, таких как стафилококки, гарднереллы, Atopobium vaginae, оправдано назначение амоксициллина с клавулановой кислотой, а при выявлении генитальных микоплазм и/или уреаплазм – джозамицина, т.к. риск развития ХЭ при обнаружении этих микроорганизмов увеличивается многократно (в 2,5–7 раз).
В течение периода наблюдения за пациентками зарегистрировано 16 (11,0%) спонтанных беременностей в течение 4‒10 месяцев после курса антибактериальной терапии. Еще 29 беременностей было диагностировано после проведения ВРТ из 41 (28,3%) вступивших в протокол участниц исследования. Выполнение микробиологического контроля после проведения противомикробной терапии не было предусмотрено условиями выполняемого протокола, как необоснованное микроинвазивное исследование.
Обсуждение результатов
На последнем конгрессе ESHRE в Вене (2019) причины и стратегии при идиопатическом бесплодии рассматривались как важные и пока плохо изученные проблемы. Однако роль инфекционного фактора как ведущего и/или придающего модальность другим факторам обсуждается, поскольку это одна из наиболее вероятных причин необъяснимого бесплодия [7].
В исследовании Bouet P.E. et al. (2016) было установлено, что у женщин с повторными неудачами имплантации в 14–27% диагностирован ХЭ, ассоциированный с персистенцией бактериальных агентов и, как правило, не имеющий клинических признаков инфекции [8]. Kushnir V.A. et al. (2016) установили, что распространенность ХЭ среди бесплодных пациентов с повторными неудачами имплантации составила 45%. [9]. Cicinelli E. et al. (2015) провели ретроспективное исследование среди женщин в возрасте до 40 лет с тремя или более самопроизвольными выкидышами в анамнезе без установленных этиологических факторов. В данной выборке 57,8% пациентов имели гистероскопические признаки ХЭ, из которых в 91,3% случаев диагноз был подтвержден гистологически. В выполненном нами исследовании распространенность ХЭ составила 77,9%, что является следствием соблюдения условий (критерии включения и исключения) формирования выборки. У пациенток с ХЭ в 68% случаев из полости матки были выделены условно-патогенные микроорганизмы, такие как Streptococcus agalactiae (серологической группы B), E. coli, Enterococcus faecalis и/или микоплазмы [10].
По данным других исследований, ХЭ чаще всего был ассоциирован с Enterococcus faecalis, Enterobacteriaceae, Streptococcus spp., Staphylococcus spp., Gardnerella vaginalis и Mycoplasma spp. а также Ureaplasma urealyticum, Chlamydia trachomatis и Neisseria gonorrhoeae [11, 12].
В нашем исследовании отсутствие микроорганизмов или выявление только лактобацилл было обнаружено в 22,1% случаев, при этом в остальных случаях определялись условно-патогенные микроорганизмы, наиболее частыми из которых были бактерии семейства Enterobacteriaceae (31,7%), Staphylococcus spp. (16,6%) и Ureaplasma spр. (13,1%). Обращает на себя внимание, что в нашем исследовании монокультура лактобацилл была обнаружена в 21 (14,5%) образце. В настоящее время нет консолидированного понимания о том, является ли присутствие Lactobacillus spp. в полости матки «физиологическим явлением» или высокий удельный вес данных микроорганизмов при ХЭ обусловлен нарушением защитных физиологических барьеров и/или функциональной неполноценностью компонентов клеточного иммунитета [5].
Изучение состава микробиоты репродуктивного тракта с помощью технологии cеквенирования нового поколения продемонстрировало, что у пациенток с бесплодием микрофлора эндометрия значительно отличается от микрофлоры влагалища, т.е. микробиота эндометрия не повторяет микробиоту влагалища. Иными словами, речь не идет о контаминации полости матки бактериями влагалища. Поэтому исследование микрофлоры полости матки имеет большое значение, особенно у бесплодных пациенток, поскольку данная среда обеспечивает имплантацию эмбриона [13]. По данным Moreno I. et al. (2018), методы амплификации нуклеиновых кислот в выявлении микробиоты полости матки продемонстрировали высокий уровень конкордантности (76,92%) с гистологическим и культуральным исследованием. Таким образом, чувствительность данного теста составила 75% и специфичность − 100% по сравнению с согласованными результатами других тестов [14].
Многие авторы постулируют, что гистологический диагноз не является специфическим, является крайне субъективным, время- и ресурсозатратным и, самое главное, не прогнозирует репродуктивные исходы [15, 16]. Учитывая эти ограничения, исследование микробиома эндометрия является тем вариантом обследования, которое определяет дальнейшую терапевтическую тактику, заключающуюся в назначении соответствующей противомикробной терапии [10, 11, 17]. Это позволяет обнаруживать культивируемые и некультивируемые бактерии, колонизирующие эндометрий, даже без гистологических признаков инфекции. Молекулярный тест демонстрирует перспективность, как более быстрый и надежный инструмент для упрощенной диагностики ХЭ [10].
Заключение
Распространенность ХЭ у пациенток с идиопатическим бесплодием составила 77,9%. При выявлении в биоптатах эндометрия при ХЭ условно-патогенных микроорганизмов, таких как стафилококки, гарднереллы, Atopobium vaginae, генитальные микоплазмы и/или уреаплазмы, оправдано назначение противомикробных препаратов, так как риск развития ХЭ при обнаружении этих микроорганизмов увеличивается многократно (в 2,5–7 раз). Применение антибактериальных препаратов продемонстрировало высокую клиническую эффективность, т.к. у 11% женщин наступила спонтанная беременность, а у 28,3% – после проведения процедуры ВРТ.



