Задержка роста плода (ЗРП) остается одной из ведущих проблем современного акушерства [1]. Анализ эпидемиологических данных показывает, что, помимо высокой заболеваемости и смертности в перинатальном периоде, дети с ЗРП входят в группу риска по развитию сердечно-сосудистых и метаболических заболеваний при достижении ими зрелого возраста [2–4]. Несмотря на постоянное совершенствование протоколов диагностики и ведения ЗРП, доля маловесных к сроку гестации детей составила 22% в 2012 г., согласно данным Исследовательской группы по эпидемиологии детского здоровья [5]. В связи с чем поиск высокочувствительных и специфичных диагностических тестов не теряет актуальности. Изучение механизмов развития ЗРП является основополагающим фактором разработки эффективных методов профилактики и лечения данного осложнения.
В настоящий момент большой интерес представляют уточнение механизмов развития ЗРП, связанных с состоянием матери, и изучение метаболических изменений плода, которые носят компенсаторный характер и возникают в ответ на неблагоприятные внутриутробные факторы. Метаболомика как наука, включающая в себя количественное определение и идентификацию низкомолекулярных метаболитов, позволяет оценить состояние организма и выявить взаимосвязь между процессами, лежащими в основе формирования метаболических нарушений. Полученные знания в будущем могут помочь в разработке методов, направленных на коррекцию этих нарушений.
Целью исследования являлся поиск биомаркеров ЗРП на основании изучения метаболомного профиля беременных.
Материалы и методы
В исследование были включены 38 беременных, которые поступили и были родоразрешены в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России: 1-ю группу (основную) составили 17 пациенток c подтвержденным диагнозом ЗРП; 2-ю группу (контрольную) – 21 соматически здоровая женщина с беременностью без осложнений. Диагноз ЗРП был подтвержден постнатально, согласно центильным таблицам ВОЗ для доношенных и таблицам Фентона (2013 г.) для недоношенных детей. Все пациентки подписали информированное согласие на участие в исследовании. Исследование было одобрено локальным этическим комитетом ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Критериями включения в исследование послужили: возраст беременных от 18 до 45 лет, одноплодная беременность на сроке от 22 до 40 недель. Критерии исключения: отсутствие резус- и AB0-изоиммунизации, хромосомных аномалий, генетических мутаций и врожденных пороков развития у плода, наличие у матери тяжелой экстрагенитальной патологии, миомы матки больших размеров, острых инфекционных заболеваний.
В работе использованы стандартный набор и масс-спектрометрический протокол компании JASEM (Турция) для пробоподготовки образцов плазмы и последующего анализа 43 аминокислот. Набор содержит две различные калибровочные смеси лиофилизированных аминокислот, смесь внутренних стандартов, лиофилизированную смесь для контроля качества анализа, подвижные фазы A и B, так называемый Реагент-1 (кат. № JSM-CL-503), используемый при пробоподготовке образцов плазмы, а также колонку для высокоэффективной жидкостной хроматографии аминокислот JASEM (кат. № JSM-CL-575).
Для приготовления образцов плазмы к исследованию к 50 мкл плазмы добавляли 50 мкл раствора смеси внутренних стандартов, перемешивали на вортексе в течение 5 с, добавляли 700 мкл Реагента-1, перемешивали повторно 15 с, центрифугировали 3 минуты со скоростью 3000 об./мин, после чего переносили надосадочную жидкость в виалу. Подготовку и хранение анализируемых образцов и вспомогательных растворов производили в соответствии с руководством JASEM.
Анализ образцов осуществляли с помощью высокоэффективной жидкостной хроматографии (Agilent 1290 Infinity II) с масс-спектрометрическим детектированием(Agilent 6470 А). Транзитные переходы между родительскими ионами и дочерними фрагментами для мониторируемых аминокислот, соответствующие им хроматографические времена удержания, концентрации внутренних стандартов, а также сведения о чувствительности и воспроизводимости анализа приведены в руководстве JASEM.
Статистическую обработку полученных экспериментальных данных проводили с помощью скриптов, написанных на языке R (R Core Team (2018), Австрия) в RStudio (RStudio Team (2016), США) и программного обеспечения IBM SPSS Statistics 21. Для проверки гипотезы о нормальном распределении использовался критерий Шапиро–Уилка, для проверки равенства дисперсий – критерий Левина. При несоблюдении условий нормального распределения статистический анализ проводили с помощью непараметрических критериев Манна–Уитни и коэффициента ранговой корреляции по Спирмену. Сравнение групп по качественным признакам проводили с помощью точного критерия Фишера. Количественные данные представлены в виде медианы, верхней и нижней квартили – Me (Q1;Q3). Для оценки диагностической эффективности исследуемого метода использовали ROC-анализ. Данные ROC-анализа представлены в виде площади под кривой с 95% доверительным интервалом (ДИ). Для всех видов анализа статистически значимыми считали значения p<0,05.
Результаты и обсуждение
Пациентки, включенные в исследование, не имели значимых различий по возрасту, соматической и гинекологической заболеваемости (p>0,05). Гестационный срок при родоразрешении в группе с ЗРП составил 35,4 (33,7;37,5) недели, что было обусловлено наличием показаний для экстренного досрочного родоразрешения путем операции кесарева сечения (КС). Клинико-анамнестические данные представлены в табл. 1.
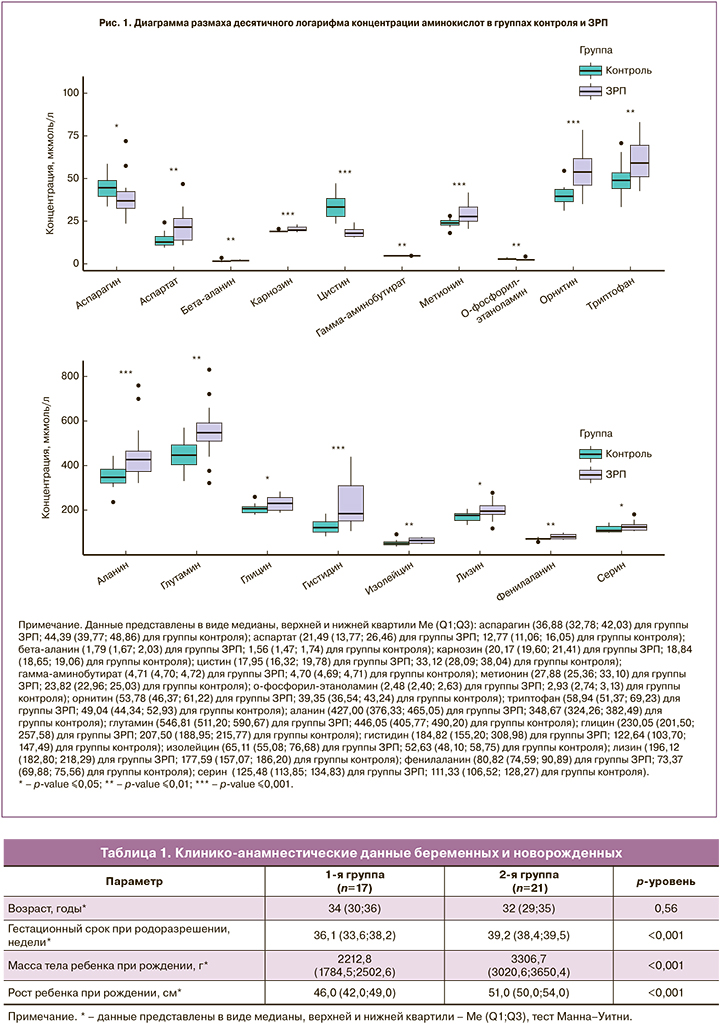
На следующем этапе работы был проведен количественный хромато-масс-спектрометрический анализ 43 аминокислот. Регистрировали хроматограммы ионного тока образцов сыворотки крови беременных двух групп исследования. Исходя из площадей соответствующих хроматографических пиков, был произведен расчет концентраций аминокислот. С помощью дальнейшего статистического анализа полученных данных было выявлено 18 метаболитов со статистически значимо различающимися значениями (рис. 1). К этим различающимся метаболитам относились аланин, аспарагин, аспартат, бета-аланин, карнозин, цистин, гамма-аминобутират, глутамин, глицин, гистидин, изолейцин, лизин, метионин, о-фосфорил-этаноламин, орнитин, фенилаланин, серин, триптофан. Концентрации аминокислот в группах исследования приведены в табл. 2.
На следующем этапе был проведен корреляционный анализ с выявлением зависимости между определяемыми метаболитами и клинико-анамнестическими данными. Умеренная корреляционная связь ЗРП была выявлена с 3 аминокислотами – бета-аланином (rs=0,413; р=0,003), цистином (rs=0,588;р<0,001) и орнитином (rs=0,427; р=0,002). Анализ данных метаболитов и показателей лабораторных и инструментальных методов исследования показал умеренную корреляционную связь цистина и орнитина с показателями маточно-плацентарного кровотока (rs=0,688; p<0,001 и rs=0,504; p<0,001 соответственно), высокую корреляционную связь цистина с показателями плодово-плацентарного кровотока (rs=0,688; p<0,001 для пупочной артерии и rs=0,779; p<0,001 для средней мозговой артерии) и умеренную корреляционную связь орнитина с показателями плодово-плацентарного кровотока (rs=0,512; p<0,001 для пупочной артерии и rs=0,479; p<0,001 для средней мозговой артерии).
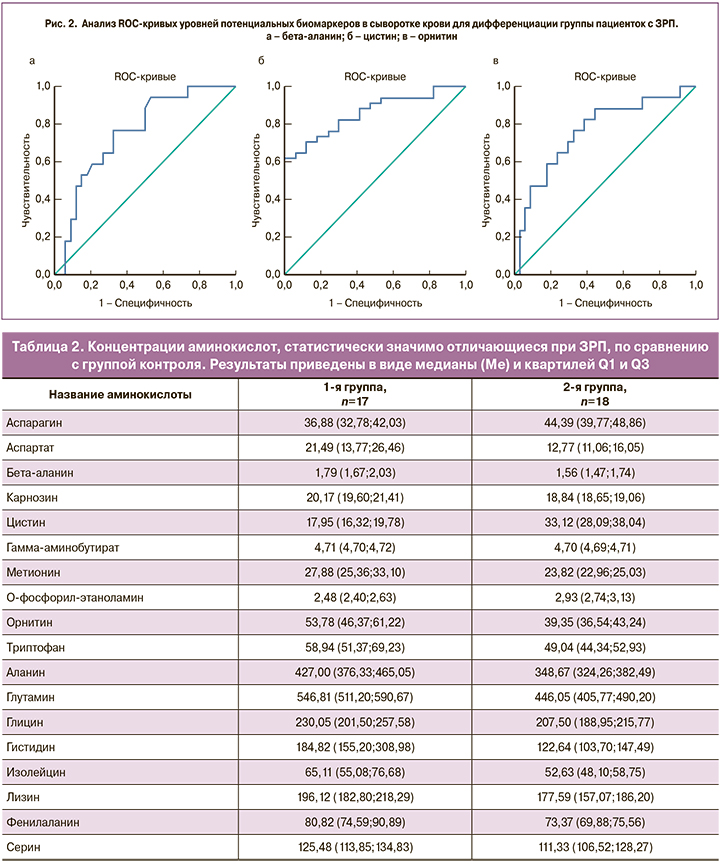
Для определения значимости данных аминокислот в качестве диагностического теста при ЗРП был проведен ROC-анализ, который охарактеризовал полученную модель как хорошую и обосновал перспективность использования бета-аланина с AUC=0,75 (95% ДИ 0,62–0,89), чувствительностью 77%, специфичностью 68%; цистина с AUC=0,86 (95% ДИ 0,76–0,96), чувствительностью 62%, специфичностью 100% и орнитина с AUC=0,76 (95% ДИ 0,62–0,90), чувствительностью 77%, специфичностью 68% для выявления групп беременных с ЗРП (рис. 2).
Поскольку ЗРП сопровождается нарушением процессов обмена веществ как у матери, так и у плода, изучение метаболомного профиля беременных при данной патологии представляет большой интерес в связи с перспективностью выявления потенциальных прогностических маркеров. В последних работах исследователи подчеркивают неоспоримую роль аминокислот, липидов и других метаболитов в патогенезе ЗРП. Так, Dessi и соавт. сравнили метаболомные профили мочи здоровых детей и детей с ЗРП и получили данные о повышении уровня мио-инозитола, саркозина, креатина и креатинина в группе ЗРП [6, 7]. Barberini и соавт. исследовали показатели метаболитов мочи у детей с малыми и крупными размерами к сроку гестации по сравнению с нормовесными детьми и также установили повышение уровня мио-инозитола в группе маловесных и крупновесных детей [8]. Известно, что мио-инозитол участвует в поддержании клеточного роста, развитии периферических нервов и метаболизме [9, 10]. Кроме того, он играет важную роль в повышении чувствительности к инсулину и регуляции жирового обмена [11, 12]. L. Maitre и соавт. [13] при анализе метаболомного профиля мочи беременных с целью поиска новых прогностических маркеров ЗРП обнаружили снижение уровня тирозина, ацетата, триметиламина и формиата в группе ЗРП. При этом данные метаболиты находились в обратной корреляции с уровнем инсулина в крови беременных, что, возможно, связано с их ролью в углеводном и жировом обмене. В то же время в других исследованиях была показана значимость триптофана, глутамата и фенилаланина как наиболее высокочувствительных и специфичных метаболитов в диагностике ЗРП [14]. Однако, согласно исследованию Sanz-Cortés M. и соавт., в котором проводился анализ аминокислотного состава пуповинной крови новорожденных с ЗРП, статически значимые результаты метаболитов были получены только в группе с поздней формой ЗРП [15]. Так, было отмечено снижение холина и значительное повышение уровня ненасыщенных жирных кислот, глютамина и креатина в группе с ЗРП. Интересные данные были получены позднее у J. Liu и соавт., которые показали снижение уровня гомоцистеина, метионина, тирозина, аланина, орнитина и серина в крови новорожденных с ЗРП [16]. S. Visentin [17] и соавт. были обнаружены более низкие уровни каприновой и лауриновой кислот как у новорожденных с подтвержденным диагнозом ЗРП, так и у их матерей. Известно, что при физиологически протекающей беременности данные кислоты используются плодом в качестве дополнительного источника энергии посредством кетогенеза [18], что позволяет предположить, что при ЗРП возникают усиленный перенос и утилизация данных кислот в связи с развитием метаболических нарушений у плода [19].
Таким образом, анализ литературы указывает на трудности выделения определенного метаболита, связанного с ЗРП, который можно было бы предложить в качестве потенциального маркера, в связи с чем все большее значение отводится определению метаболомного профиля. В проведенной работе удалось из метаболомного профиля выделить три метаболита, которые были ассоциированы с ЗРП, что обосновывает перспективность их определения для прогнозирования и диагностики данного осложнения беременности.
Заключение
Выявленные корреляционные связи данных метаболитов с показателями допплерометрии определяют возможность их комплексного применения в сочетании с тестами функциональной диагностики в клинической практике на антенатальном этапе для повышения их прогностической значимости.



