Демографическая ситуация в мире на сегодняшний день характеризуется увеличением в популяции общей численности и доли лиц старшего возраста. Эта тенденция обусловлена переходом от общества с высокой рождаемостью и высокой смертностью к обществу с низкой рождаемостью и высокой продолжительностью жизни. В России эти тенденции сохраняются. Кроме того, в последние десятилетия заметно улучшилась выживаемость женщин репродуктивного возраста, перенесших хирургические операции на половых органах, в результате чего клиницистам все чаще приходится сталкиваться с проблемами преждевременной менопаузы. Вместе с тем, некоторые современные вспомогательные технологии позволяют сохранить качество жизни этой категории населения. Такие методы реабилитации – стандарты в большинстве высокоразвитых стран, постепенно входят в клиническую практику и в России. Основные препятствия для их активного внедрения — низкая информированность врачей и пациентов о современных возможностях, а также недоступность информации о безопасности и эффективности такого лечения при онкологических заболеваниях. Одним из наиболее эффективных методов реабилитации является менопаузальная гормональная терапия, которая позволяет частично восполнить дефицит половых гормонов, используя такие минимально-оптимальные дозы гормональных препаратов, которые способны реально улучшить общее состояние женщины, обеспечить профилактику поздних обменных нарушений и не сопровождаются побочными эффектами [1].
В России возрастная группа женщин в пре- и постменопаузе составляет более 21 млн. При этом частота климактерических симптомов у этого контингента составляет 40–60% [1]. Своевременное назначение МГТ с учетом возраста женщины, продолжительности менопаузы, данных личного и семейного анамнеза позволяет снизить частоту менопаузальных симптомов, улучшить качество жизни. МГТ оказывает профилактическое влияние на такие болезни пожилых людей как остеопороз, переломы костей, сердечно-сосудистые заболевания, деменция, диабет и другие метаболические состояния [1].
Показания к назначению МГТ:
- Вазомоторные симптомы с изменением настроения, нарушением сна;
- Симптомы урогенитальной атрофии, сексуальной дисфункции;
- Профилактика и лечение остеопороза;
- Низкое качество жизни, связанное с климактерием, включая артралгии, мышечные боли, снижение памяти;
- Преждевременная и ранняя менопауза;
- Овариоэктомия.
Режимы назначения МГТ [1]
Выбор МГТ индивидуален для каждой пациентки. Индивидуализация МГТ – это дифференцированный ее подбор с учетом состояния здоровья женщины и сопутствующих заболеваний, а также режима МГТ (типа, дозы, пути введения и побочных эффектов).
Индивидуализация МГТ включает следующие основные факторы:
- возраст женщины и продолжительность постменопаузы: после 60-летнего возраста либо после 9–10 лет постменопаузы начинать МГТ нецелесообразно;
- особенности менструального цикла в репродуктивном периоде (олиго-, аменорея, аномальные маточные кровотечения; периоды длительной аменореи) могут способствовать остеопении и изменению липидного спектра крови;
- при преждевременной менопаузе (до 40 лет) можно обсудить вопрос о целесообразности применения КОК.
Монотерапия эстрогенами или прогестагенами. Монотерапия эстрогенами назначается женщинам с удаленной маткой. Монотерапия прогестагенами назначается в фазе менопаузального перехода или в перименопаузе для регуляции цикла и лечения гиперпластических процессов эндометрия.
Комбинированная терапия (эстрогены с прогестагенами) в циклическом режиме назначается при интактной матке в фазе менопаузального перехода и в перименопаузе.
Монофазная комбинированная терапия (эстрогены с прогестагенами) в непрерывном режиме назначается в постменопаузе.
Согласно рекомендациям Международной ассоциации по менопаузе (пресс-релиз от 5 июля 2012 г.), при назначении МГТ рекомендуется придерживаться так называемой временной гипотезы: следует начинать МГТ в возрасте моложе 60 лет при длительности менопаузы менее 10 лет [2]. При этом назначение МГТ женщинам в ранней постменопаузе и/или в возрасте моложе 60 лет, как в виде монотерапии эстрогенами, так и в комбинированном режиме, снижает общую смертность на 30–52% [2, 3].
В России имеется практически весь арсенал современных гормональных высокоэффективных препаратов для МГТ, а также для альтернативной терапии.
Более того, в России 27 января 2015 г. был зарегистрирован первый ультранизкодозированный препарат для МГТ анжелик микро. Это препарат нового поколения. Препарат анжелик микро содержит 17ß-эстрадиол (микронизированный), химически и биологически идентичный эндогенному человеческому эстрадиолу, и синтетический прогестаген дроспиренон (микронизированный). 17ß-эстрадиол обеспечивает замещение гормонов во время и после менопаузы. Монотерапия эстрогенами обладает дозозависимым стимулирующим действием на митозы и пролиферацию эндометрия и, следовательно, повышает частоту возникновения гиперплазии и рака эндометрия, но добавление дроспиренона позволяет избежать этих последствий. Дроспиренон оказывает очень сходные с естественным прогестероном фармакодинамические воздействия. Таким образом, доступность комбинации E2/ДРСП (0,5 мг/0,25 мг) с более низкой дозой E2 по сравнению с традиционным гормональными препаратами предоставляет новые возможности для врачей и позволяет лучше адаптировать лечение менопаузальных симптомов к потребностям и индивидуальному профилю риска пациенток. Однако частота назначения МГТ в нашей стране остается крайне низкой. Немаловажную роль в этом играет необоснованный страх перед самим словом «гормон».
Обратимся к истории вопроса. В течение длительного периода времени (начиная с 1941 г.) в основном доминировали наблюдательные исследования, в ходе которых отмечалось положительное влияние МГТ. Однако крупное рандомизированное плацебо-контролируемое американское исследование WHI (Women’s Health Initiative, 2002) сыграло драматическую роль в судьбе МГТ и способствовало резкому снижению приема МГТ в большинстве стран мира, появлению страхов и сомнений в отношении пользы и рисков, связанных с применением МГТ [4].
По данным пресс-релиза Международной ассоциации по менопаузе от 5 июля 2012 г., отказ от МГТ после публикации результатов WHI привел к [2, 5]:
- увеличению числа случаев острых сердечно-сосудистых заболеваний, являющихся ведущей причиной смертности у женщин;
- возникновению дополнительных 43 000 переломов в год на территории США и даже большее;
- отрицательному влиянию на качество жизни женщин, даже за счет возобновления приливов и нарушения сна.
В течение последующих 10–12 лет проводилась переоценка результатов исследования WHI с учетом возраста, исходного состояния здоровья и длительности постменопаузы включенных женщин, типа и доз препаратов. Анализ показал, что основные недочеты WHI вызваны тем, что средний возраст женщин-участниц исследования составил 63 года, то есть возраст, на который приходится самый пик заболеваемости раком молочной железы (РМЖ) в популяции; кроме того, в исследовании использовались конъюгированные высокодозные (0,625 мг) эстрогены и специфический гестаген медроксипрогестерона ацетат (МПА), обладающий слабым андрогенным и глюкокортикоидным эффектом, стимулирующим пролиферацию эпителия молочных желез [1].
Более поздние (после WHI) крупные исследования подтвердили, что раннее начало МГТ (в пре- и постменопаузе) не оказывает отрицательных побочных эффектов на здоровье женщин. Так, датское рандомизированное контролируемое исследование (Danish Osteoporosis Prevention Study (DORS), которое продолжалось в течение 16 лет, показало, что МГТ, начатая в пре- и ранней постменопаузе (n=1006), снижает частоту сердечно-сосудистых заболеваний почти на 50%. При этом не наблюдалось повышение частоты выявления каких-либо форм рака, в том числе и РМЖ [3].
Другое исследование, Kronos Early Estrogen Prevention Study (KEEPS), длившееся 4 года, включавшее 727 здоровых женщин в возрасте 42–58 (средний возраст 52,7 года, сроки постменопаузы ≤3 лет), принимавших эстроген + прогестин, трансдермальный эстроген (климара) и плацебо, не выявило статистически значимых различий по частоте встречаемости РМЖ, рака эндометрия, инфаркта миокарда, транзиторных ишемических атак, инсульта или венозной тромбоэмболической болезни между тремя группами [6, 7].
Огромный интерес представляют результаты крупномасштабного когортного исследования EURAS-HRT, проведенного в 7 европейских странах с участием более 30 000 женщин в постменопаузе (>100 000 женщин-лет наблюдения), что делает результаты данного исследования по мощности сопоставимыми с WHI, несмотря на разный дизайн [8]. На фоне комбинации дроспиренон/эстрадиол выявлена отчетливая тенденция к снижению частоты РМЖ железы (скорректированный ОР=0,7; 95% ДИ 0,5–1,2).
Биологическим объяснением этих результатов может служить не только возможная роль МР (минералокортикоидных рецепторов), но также благоприятное влияние ДРСП на метаболические процессы в организме женщины. Нельзя забывать, что среди модифицируемых факторов риска ожирение у женщин в постменопаузе, особенно висцеральное, и инсулинорезистентность являются наиболее важными. При этом если в пременопаузе избыточный вес (гиноидное ожирение) относится к числу нейтральных факторов, то в постменопаузе выявлена четкая корреляция РМЖ с абдоминальным/висцеральным ожирением. Необходимы дальнейшие клинические исследования для подтверждения уникальных благоприятных эффектов ДРСП на молочную железу. Биологическим объяснением этих результатов может служить не только возможная роль МР, но также благоприятное влияние ДРСП на метаболические процессы в организме женщины.
Таким образом, женщины в ранней постменопаузе, получавшие МГТ более 10 лет, отличались значимым снижением риска общей смертности (на 52%), сердечной недостаточности или инфаркта миокарда без повышения риска возникновения РМЖ, венозной тромбоэмболии и инсульта. Этот эффект сохранялся в течение 16 лет наблюдения [2, 3].
 В России разработаны и, надеемся, будут утверждены Минздравом в ближайшее время Клинические рекомендации «Менопаузальная гормонотерапия и сохранение здоровья женщин зрелого возраста», которые позволят шире использовать МГТ в клинической практике [1]. Однако является ли менопаузальная гормональная терапия инициирующим фактором развития злокачественных новообразований – это тот вопрос, на который еще предстоит ответить.
В России разработаны и, надеемся, будут утверждены Минздравом в ближайшее время Клинические рекомендации «Менопаузальная гормонотерапия и сохранение здоровья женщин зрелого возраста», которые позволят шире использовать МГТ в клинической практике [1]. Однако является ли менопаузальная гормональная терапия инициирующим фактором развития злокачественных новообразований – это тот вопрос, на который еще предстоит ответить.
Рак шейки матки и МГТ. Долгосрочные когортные исследования, в том числе и WHI, показали отсутствие повышения риска возникновения рака шейки матки (РШМ) при применении МГТ. Эстроген-терапия не увеличивает риск развития РШМ и даже может его снижать. Защитное действие эстрогенов выражено максимально в возрасте до 60 лет. При этом наличие HPV-инфекции не является противопоказанием для назначения МГТ. Тем не менее, цитологический контроль на фоне МГТ следует проводить регулярно [1].
Рак вульвы и МГТ. Системные и местные эстрогены могут быть использованы женщинами после лечения рака вульвы. В настоящее время нет данных о негативном влиянии МГТ на рецидив этого заболевания [1].
Рак яичников и МГТ. Данные о возможном влиянии МГТ на риск возникновения рака яичников противоречивы. Несколько исследований случай-контроль свидетельствуют об увеличении риска при использовании монотерапии эстрогенами, в то время как при использовании комбинированной терапии риски практически отсутствовали. Пожалуй, WHI – это единственное рандомизированное плацебо-контролируемое исследование, которое позволило заключить, что риск возникновения рака яичников не повышался на фоне МГТ [1].
Рак эндометрия и МГТ. Монотерапия эстрогенами у женщин с интактной маткой повышает риск возникновения рака эндометрия в 3–5 раз. С другой стороны, исследования WHI показало, что в отличие от моно-эстрогенной терапии комбинированная МГТ практически не повышает риск развития рака эндометрия. Длительное применение в постменопаузе комбинированной МГТ в циклическом режиме (более 5 лет) может незначительно повысить риск возникновения рака этой локализации. Непрерывная комбинированная МГТ достоверно снижает риск развития рака эндометрия по сравнению с популяцией. Показано также, что ультранизкодозированные препараты МГТ последнего поколения не оказывает стимулирующего влияния на эндометрий [1].
Колоректальный рак и МГТ. Исследование WHI показало значительное снижение риска развития колоректального рака (КРР) на фоне приема комбинированной МГТ. Монотерапия эстрогенами не влияет на риск возникновения КРР (WHI). Снижение риска развития КРР при МГТ представлено еще в 3 метаанализах. Позитивный эффект сохранялся в течение 4 лет после прекращения терапии. Неизвестна продолжительность защитного влияния и влияние на смертность от КРР. Однако необходимо подчеркнуть, что МГТ не следует применять с единственной целью профилактики КРР [1].
Рак желудка и пищевода и МГТ. Когортное исследование (случай-контроль) показало снижение риска возникновения рака желудка при применении МГТ (ОР 0,48; 95% ДИ 0,29–0,79) и отсутствие влияния на рак пищевода [1].
Рак молочной железы и МГТ. Вопрос о влиянии экзогенных половых гормонов на риск возникновения РМЖ остается сложным и противоречивым. После 5-летнего приема комбинированной МГТ (WHI) относительный риск (ОР) возрос и составил 1,24 (95% ДИ 1,09–1,54). Однако в исследовании WHI у женщин, принимавших монотерапию эстрогенами, в течение 7 лет отмечено снижение риска возникновения РМЖ на 23% (ОР 0,77; 95% ДИ 0,59–1,01) [1]. На сегодняшний день существует неоднозначная, хотя и принятая гипотеза снижения частоты возникновения РМЖ при монотерапии эстрогенами: «объясняется апоптотическим эффектом эстрогенов на раковые клетки в низкой эстрогеновой среде». Что же касается риска возникновения РМЖ на фоне комбинированной МГТ, то полагают, что этот эффект может быть результатом стимулирования уже существующего рака малых размеров, не диагностируемого рентгенологически, который может развиваться в течение 10–15 лет и более. Это подтверждается результатами аутопсий: к моменту менопаузы около 40% женщин уже имеют «спящие» новообразования [9]. Таким образом, повышение РМЖ на фоне МГТ, вероятно, связано с пролиферативным влиянием экзогенных эстрогенов и прогестерона на уже существующие опухоли, а не их канцерогенным эффектом, то есть не инициируют их возникновение. Необходимо отметить, что согласно Глобальному консенсусному заключению по вопросам менопаузальной гормональной терапии, риск возникновения РМЖ у женщин старше 50 лет, связанный с МГТ, является пока нерешенным вопросом [10]. В первую очередь, повышение риска связано с типом применяемого прогестагена и длительностью приема. При этом риск возникновения РМЖ, обусловленный МГТ, невелик и исчезает после прекращения терапии. Текущие данные по безопасности не поддерживают использование МГT у больных РМЖ после лечения [10].
Подводя итог вышесказанному, хочется еще раз подчеркнуть, что:
Частота рака молочной железы может повышаться в случае применения стандартных доз эстрогенов в комбинации с определенными прогестагенами; монотерапия эстрогенами снижает риск возникновения РМЖ, либо повышает его в малой степени только в течение очень длительного их применения (10–15 лет) [1].
Риск возникновения рака эндометрия снижается при применении комбинированной МГТ [1].
Риск возникновения рака яичников снижается при применении комбинированной МГТ и несколько повышается при монотерапии эстрогенами [1].
МГТ в группах риска по возникновению злокачественных новообразований органов репродуктивной системы
Другой дискуссионный вопрос, который хотелось бы затронуть в этой статье – это вопрос о возможности применения МГТ у носительниц мутаций в генах BRCA1/2. Напомним, что начиная со второй половины XX века все большую актуальность и значимость приобретают вопросы, связанные с оценкой относительного вклада наследственности в развитие онкологических заболеваний [11]. Уже тогда исследователи обратили внимание на тот факт, что не всегда контакт с опухолеиндуцирующими веществами приводит к возникновению онкологического заболевания. Кроме того, в семьях онкологических больных частота встречаемости опухолей значительно выше, чем в общей популяции. Тогда и появился термин «раковые семьи» [11].
В зависимости от того, на каком клеточном уровне произошла мутация (в гамете или соматической клетке), опухоли любой локализации могут быть наследственными и ненаследственными, то есть спорадическими [11]. Для лиц, унаследовавших гены предрасположенности к раку органов репродуктивной системы, вероятность развития этих опухолей к 40–55 годам жизни достигает почти 75% [11]. В то же время общепопуляционный риск развития рака органов женской репродуктивной системы, накопленный к 90-му году жизни, достигает всего 6% [11].
В настоящее время идентифицировано по крайней мере 8 моногенных синдромов, проявляющихся семейной предрасположенностью к возникновению рака органов репродуктивной системы [11]. Три из них – органоспецифические. При этом в одной семье накапливаются опухоли, как правило, одной анатомической локализации [11]. Это:
- семейный рак яичников,
- семейный рак эндометрия,
- семейный рак молочной железы.
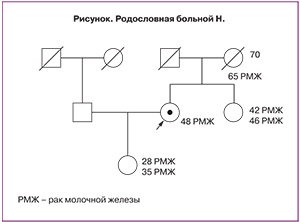
На рисунке представлена родословная больной Н., где наглядно отображено накопление в семье рака молочной железы. Причем следует обратить внимание, что с каждым последующим поколением заболевание проявляется в более молодом возрасте, при этом отмечается появление первично-множественных злокачественных новообразований, что также свидетельствует в пользу наследственного синдрома.
Пять синдромов являются вариантами семейного ракового синдрома и проявляются системной предрасположенностью к возникновению рака яичников, молочной железы, эндометрия и некоторых других локализаций [11]. Это:
- синдром семейного рака молочной железы/яичников;
- синдром семейного рака молочной железы/яичников/эндометрия;
- синдром семейного рака молочной железы/эндометрия/яичников/толстой кишки (синдром Линч-2);
- синдром семейного рака молочной железы/эндометрия/органов желудочно-кишечного тракта/легкого;
- синдром семейного рака эндометрия/органов желудочно-кишечного тракта.
И все же самой частой разновидностью семейных опухолевых заболеваний у женщин является наследственный РМЖ [11]. Его вклад в общую встречаемость РМЖ составляет 5–10%, а по некоторым данным и чаще. «Классические» разновидности РМЖ ассоциированы также с высоким риском развития РЯ, поэтому используется термин «синдром РМЖ/РЯ» (breast-ovarian cancer syndrome) [11–13]. Наиболее объективную информацию для формирования групп повышенного риска развития злокачественных новообразований дает ДНК-диагностика. Одним из значительных достижений молекулярно-генетических исследований явилось открытие генов BRCA1 и BRCA2, выявление мутаций которых на сегодняшний день стало уже рутинным. У женщин с герминальными мутациями одного из аллелей генов BRCA1/2 риск развития в течение жизни рака молочной железы составляет около 85% (этот риск несколько варьирует в зависимости от местоположения и/или типа мутаций) [13]. Для опухолей яичника такой риск несколько меньше и у носителей мутаций гена BRCA1 составляет 36–63%, а гена BRCA2 – 10–27% [13]. Частота встречаемости мутаций в генах BRCA1/2 у больных РЯ достигает 15–20%, а по данным ФГБУ РОНЦ им. Н.Н. Блохина Минздрава России эти мутации были выявлены у 22,8% больных РЯ (n=302) [12].
К настоящему времени возможности улучшить результаты лечения рака яичников практически исчерпаны. По данным ВОЗ, общая выживаемость больных раком яичников I–IV стадий за последние 40 лет изменилась лишь только на 13%. И если в 1975 г. она составила 37%, то в 1984 г. – 39%, в 2005 г. – 46%, а в 2010 г. – менее 50% [14].
Поэтому идет широкомасштабное изучение возможностей профилактики этого заболевания. Мировой опыт наглядно показывает, что своевременная идентификация генетических нарушений и проведение профилактических мероприятий у практически здоровых носительниц мутаций в генах BRCA1/2 позволяет значительно снизить заболеваемость раком яичников, которая в этих группах не превышает 3% [15].
На сегодняшний день самым эффективным методом профилактики рака органов репродуктивной системы у носительниц мутаций в генах BRCA1/2 признана профилактическая аднексэктомия. Эта операция у носителей мутаций в генах BRCA1/2 снижает заболеваемость РЯ на 97% (3% приходится на рак брюшины), а РМЖ – на 39% при наличии мутации в генах BRCA1 и на 72% при наличии мутации в генах BRCA2 [16]. У женщин без отягощенного семейного анамнеза овариоэктомия/аднексэтомия снижает риск возникновения РМЖ на 50% в течение 10 лет [16]. У радикально оперированных больных с BRCA1/2 синдромом в 32% наблюдений при тщательном исследовании также обнаруживаются предопухолевые и ранние формы рака эндометрия [16].
Но естественно возникает вопрос, когда же целесообразно производить профилактическую аднексэктомию. По данным National Cancer Institute США (NCI), средний возраст заболевания спорадическим раком яичников составляет 63 года [15]. При наличии мутаций генов BRCA1 РЯ может проявляться значительно раньше: в 17% наблюдений – до 40 лет и в 33% наблюдений – до 50 лет [15]. При этом средний возраст заболевших наследственным РЯ составляет 54 года (NCI) [15]. Аднексэктомию рекомендуется производить сразу же после выполнения женщиной детородной функции, предпочтительно до 40 лет (NCI) [15].
В США в 2011 г. выполнено около 600 000 экстирпаций матки и около 300 000 из них с аднексэктомиями (популяция 330 млн). В Великобритании (популяция 65 млн) с профилактической целью было произведено 80 000 экстирпаций матки, а только за 2007 г. – 19 000 профилактических аднексэктомий [17].
К сожалению, на сегодняшний день в России нет четкой программы или рекомендаций по оказанию медицинской помощи этой когорте молодых женщин, подвергшихся хирургической кастрации. Очевидно, что у этих женщин начнется преждевременная менопауза и они будут более восприимчивы к болезням сердца, метаболическому синдрому и остеопорозу на пятнадцать лет раньше, чем женщины в естественной менопаузе. Интересно, что даже после профилактической аднексэктомии у носительниц мутаций в генах BRCA1/2 сохраняется определенный риск возникновения рака. В частности, риск развития перитонеального рака составляет 3–4%, а риск развития рака молочной железы – 35–40%, что требует постоянного послеоперационного наблюдения. Поэтому вопросы о возможности применения МГТ у таких больных остаются предметом обсуждений и дискуссий. Между тем, мировой опыт наглядно показывает, что кратковременное использование МГТ после профилактических операций не увеличивает риск развития злокачественных опухолей, в том числе и рака молочной железы.
Так в США с помощью Cancer Risk Program (CRP) обеспечивается генетическое консультирование и тестирование семей с высоким риском развития наследственных онкологических заболеваний [18]. В частности, разработаны рекомендации, согласно которым женщинам-носительницам мутаций в генах BRCA1/2 с целью снижения риска возникновения рака рекомендуют выполнять профилактические аднексэктомии до 40 лет или после рождения ребенка. Кроме того, на сегодняшний день утвержден 20-летний протокол исследования качества жизни этих женщин (IRB).
Department of Medicine and Abramson Cancer Center University of Pennsylvania USA в 2009 г. было проведено исследование, которое показало, что профилактическая аднексэктомия у носителей мутаций в генах BRCA1/2 снижает риск развития рака яичников на 85–96%, а рака молочной железы – на 50% [4]. При этом использование МГТ поможет облегчить симптомы хирургической менопаузы и особенно не влияет на сниженный риск развития рака молочной железы, обусловленный профилактической кастрацией.
Другое проведенное в 2006 г. American Society of Clinical Oncology в США исследование включало 450 женщин, относящихся к группе высокого риска по возникновению рака молочной железы и яичников. Все они также подверглись профилактической аднексэктомии в возрасте до 40 лет. При этом 47% из них получали МГТ и предъявляли значительно меньше жалоб, связанных с менопаузой, чем женщины из этой же группы, но без МГТ (Р<0,05). Вместе с тем, по сравнению с женщинами в естественной менопаузе, у молодых, несмотря на проводимую МГТ после овариэктомии, вазомоторные симптомы были выражены более ярко (P<0,01) [15].
Согласно данным исследования, проведенного в 2011 году Department of Gynecology Oncology, University Health Network, University of Toronto в Канаде (n=963), профилактическая аднексэктомия стала по существу стандартом лечения по снижению онкологического риска у носительниц мутаций в генах BRCA1/2 [15, 19]. При этом, как и по рекомендациям NCI, они советуют выделять две категории носительниц этих мутаций: с преобладанием в семьях риска возникновения РМЖ или РЯ. Если все же в семье преобладает накопление РМЖ, то от назначения МГТ следует воздержаться. Остальным женщинам из группы риска МГТ позволит значительно повысить их качество жизни [15, 19].
Таким образом, по прогнозам ВОЗ, рак остается одной из главных причин смертности населения. Если не принять решительных мер, то в ближайшие 10 лет рак унесет жизни 84 млн людей, а к 2030 году число больных раком возрастет в три раза, и пока нет надежды найти эффективное лекарство [14]. Поэтому профилактическая аднексэктомия на сегодняшний день является самым эффективным, хотя и агрессивным методом профилактики рака в группе высокого риска (носительницы мутаций в генах BRCA1/2). Удаление придатков матки, особенно до естественной менопаузы, может повлиять на качество жизни и здоровья этих женщин. Кратковременное применение МГТ поможет смягчить некоторые, но не все посткастрационные симптомы. Исследования долгосрочного качества жизни и здоровья после удаления придатков матки еще не завершены. В частности, остается неясным вопрос будет ли длительное применение МГТ после аднексэктомии у носительниц мутаций в генах BRCA1/2 снижать последствия кастрационного синдрома и не приведет ли это к возрастанию риска развития рака молочной железы по сравнению с общей популяцией. Если в ближайшее время мы получим ответы на эти вопросы, то, возможно, наступит новая эра в лечении онкологических заболеваний.



