Полноценное становление фетоплацентарной системы уже на ранних этапах беременности является фактором, определяющим физиологическое течение беременности. В последние годы вопросам исследования ее формирования посвящено большое количество работ. Накоплено много материалов, посвященных изучению процессов имплантации и гестационных изменений в эндометрии [1, 2]. Многочисленные гормональные, иммунологические, генетические факторы участвуют в регуляции этих процессов [3–5]. Негативное влияние на формирование фетоплацентарной системы оказывают алиментарный фактор, окружающая среда, хронические интоксикации, прием лекарственных препаратов, наличие генитальных и соматических заболеваний [6–10]. Влияние различных повреждающих факторов, нарушающих процессы имплантации и плацентации, приводит к таким осложнениям гестационного периода, как неразвивающаяся беременность, самопроизвольный выкидыш, гипертензивные расстройства, преждевременная отслойка нормально расположенной плаценты, задержка внутриутробного роста плода, перинатальные потери [11–13]. Общеизвестно, что чувствительность внутриутробно развивающегося организма к повреждающим факторам тем выше, чем меньше срок гестации. Выделяют следующие критические периоды беременности: имплантация, плацентация, фетализация [14].
На третьей неделе беременности (20–24-й день) происходят аппозиция (соприкосновение), адгезия и нидация бластоцисты в толщу эндометрия, проникновение инвазивного сосудистого трофобласта в спиральные артерии с их последующей трансформацией. Большую роль в нидации бластоцисты играют протеолитические ферменты, которые находятся под контролем матриксных металлопротеиназ, и интегрины, обеспечивающие инвазию цитотрофобласта в эндометрий [15, 16].
В настоящее время недостаточно изучены механизмы неполноценной инвазии сосудистого трофобласта. Так, под контролем сосудисто-эндотелиального фактора роста (VEGF) происходит инвазия сосудистого трофобласта, а также этот процесс опосредован оксидом азота. Инвазия стромального трофобласта зависит от костного морфогенетического белка-2, а внутрисосудистое распределение трофобласта регулируется CD31. Фиброз и склероз в эндометрии, спиральных артериях как результат хронического воспаления замедляют полноценную инвазию интерстициального вневорсинчатого цитотрофобласта, эндоваскулярного трофобласта и спирализацию [17].
Изучено, что клиническими проявлениями недостаточности первой волны инвазии цитотрофобласта являются ранние потери беременности, в частности анэмбрионии, ранние спонтанные выкидыши, неразвивающаяся беременность.
При морфологическом исследовании эндометрия при анэмбрионии выявляются минимальная и поверхностная инвазия интерстициального цитотрофобласта, отсутствие трофобластических клеточных колонн у основания якорных ворсин, окружающих хориальный мешок. Хромосомные нарушения в трофобластической оболочке бластоцисты, которая является источником экстраэмбриональных провизорных органов, обусловливают данные морфологические нарушения. Кроме того, значительную роль может играть неадекватное клеточное окружение в эндометрии.
Изучение материала, полученного путем выскабливания полости матки при ранних самопроизвольных выкидышах, установило выраженную гипоплазию трофобласта у основания якорных ворсин [17, 18].
Рядом особенностей характеризуется трофобластическая инвазия при неразвивающейся беременности. При недостаточности прогестерона недостаточная трофобластическая инвазия связана с ретардацией железистого аппарата и уменьшением темпов децидуализации стромы эндометрия, в то время как при антифосфолипидном синдроме циркулирующие материнские антитела негативно влияют на вневорсинчатый сосудистый трофобласт, снижая его пролиферативный потенциал, ограничивая внутрисосудистую инвазию [14].
Гистологическая оценка соскобов эндометрия при различных формах ранних гестационных потерь позволяет оценить состояние эндометрия при невынашивании беременности и более обоснованно подойти к вопросам предгравидарной подготовки женщин с репродуктивными нарушениями в анамнезе.
Цель исследования – выявить медико-социальные факторы риска и оценить состояние эндометрия у женщин с ранней потерей настоящей беременности с привычным невынашиванием беременности (ПНБ) ранних сроков в анамнезе.
Материалы и методы
За период с 2013 по 2019 гг. в условиях клиники ФГБУ «НИИ МиД им. В.Н. Городкова» Минздрава России, женских консультаций г. Иваново проведено изучение особенностей течения беременности и перинатальных исходов у 184 женщин. 75 женщин с угрозой прерывания и ПНБ в анамнезе составили основную группу; при этом настоящая беременность у них прервалась до 12 недель. Группу сравнения составили 73 пациентки с угрозой прерывания и ПНБ в анамнезе, данная беременность у которых прогрессировала до 22 недель. 36 женщин с физиологическим течением беременности и неотягощенным репродуктивным анамнезом составили группу контроля. Критерии включения: женщины с одноплодной беременностью, угрозой прерывания ранних сроков и ПНБ в анамнезе. Критерии исключения: беременность, наступившая в результате применения вспомогательных репродуктивных технологий, соматическая патология в стадии декомпенсации. Изучение медицинских и социальных факторов проводили методом анкетирования с использованием специальной карты, включающей социальные, медицинские, профессиональные данные, сведения, характеризующие материально-бытовые условия, акушерско-гинекологический анамнез, экстрагенитальные заболевания. Относительное (процентное) количество CD178+ моноцитов, внутриклеточный синтез цитокинов (интерлейкина-10 (IL-10), фактора некроза опухоли альфа (TNF-α)) моноцитами в сыворотке крови определяли с помощью моноклональных антител методом двухцветной проточной цитофлуориметрии на приборе FACScanto (Becton Dickinson, USA). Биологический материал, полученный при выскабливании полости матки, подвергался последовательной обработке в соответствии с методикой Д.С. Саркисова, Ю.Л. Перова (1996 г.). Анализ структурных изменений на тканевом и клеточном уровнях осуществлялся после окрашивания гематоксилином и эозином готовых срезов гравидарного эндометрия и ворсинчатого хориона толщиной 4–5 мкм. При анализе патоморфологического исследования оценивали следующие параметры: дифференцировку ворсин, аваскуляризацию стромы как признак хромосомной патологии, ремоделирование эндометриальных сегментов спиральных артерий, воспалительную инфильтрацию стромы эндометрия с отеком, нарушениями децидуализации и кровотока, вирусной трансформацией клеток и фокальными некрозами. Дополнительно оценивали признаки хронического эндометрита: поствоспалительный фиброз и периартериальный склероз стромы в эндометрии, лимфоплазмоцитарную инфильтрацию и отставание в дифференцировке клеток стромы.
Статистический анализ
Проводилась проверка распределения на нормальность посредством равенства дисперсий, определенного по критерию Левина, а также критерия Шапиро–Уилка. Если количественное описание величин соответствовало нормальному распределению, данные представляли в виде среднего арифметического (М) и стандартного отклонения (SD). В данном случае статистическая значимость различий определялась с помощью t-критерия Стьюдента. Если распределение не соответствовало нормальному, данные представляли в виде медианы (Ме), верхней и нижней квартили (Q1; Q3). В данном случае статистическую значимость различий определяли с помощью непараметрических критериев Вальда–Вольфовица, Колмогорова–Смирнова, Манна–Уитни. Данные, характеризующие качественные признаки, представляли в виде абсолютного числа и относительной величины (в процентах). Статистическая значимость различий качественного признака проводилась посредством двустороннего точечного критерия Фишера, а также критерия χ2 Пирсона. Сравнение трех независимых групп по одному количественному признаку осуществляли с помощью дисперсионного анализа (ANOVA) в случае нормального распределения признаков и равенства дисперсий. Если имелись статистически значимые различия, проводилось попарное сравнение с помощью t-критерия Стьюдента и поправки Бонферрони. При проверке гипотез критический уровень значимости (р) принимали равным 0,05. Рассчитывали относительный риск (ОР) с доверительным интервалом 95% (95% ДИ). Статистическая обработка проводилась с использованием Statistica for Windows 10.0, Microsoft Excel 2018, MedCalс и OpenEpi.
Результаты и обсуждение
В основной группе возраст женщин составил 34 (30; 38) года, тогда как в группе сравнения он был меньше – 30 (27; 34) лет. Возраст отца будущего ребенка составил 34 (30,3; 40) и 33 (29; 35) года по группам соответственно. Нами выявлена связь ранней потери беременности у женщин с угрозой прерывания и ПНБ в анамнезе с отсутствием постоянной работы (ОР 1,62; 95% ДИ 1,17–2,22). Женщины основной группы отмечали более ранний промежуток времени между началом половой жизни и наступлением первой беременности (2,5 (2,5); 4,2 (3,1) лет), а также наступление ее в более раннем возрасте (20,3 (2,6); 22,1 (3,4) лет), раньше вставали на учет по беременности в женскую консультацию (6,6 (0,7); 7,3 (2,1) недель) относительно группы сравнения. Полученные результаты представлены в таблице 1.
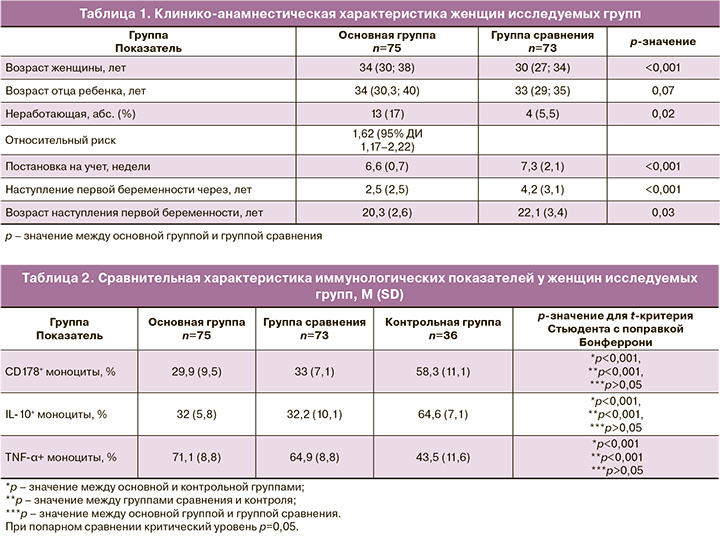
Также проанализированы результаты иммунологического исследования. У пациенток основной группы и группы сравнения выявлено снижение относительного количества CD178+ моноцитов и уровня IL-10+ моноцитов на фоне повышения содержания TNF-α+ моноцитов по сравнению с контрольной группой. Полученные результаты представлены в таблице 2.
Ретроспективно женщины, у которых беременность прервалась в I триместре, были разделены на 2 подгруппы: 1-я подгруппа – пациентки с неразвивающейся беременностью ранних сроков; 2-я подгруппа – женщины с самопроизвольным выкидышем ранних сроков.
Анализ результатов гистологического исследования биологического материала при неразвивающейся беременности выявил увеличение частоты нарушений дифференцировки ворсин (42,4% и 10%, р=0,025), хромосомной патологии в виде аваскуляризации ворсин хориона (74,3% и 0%, р<0,001), лимфо-лейкоцитарно-макрофагального воспаления (22,7% и 0%, р<0,001), отека стромы эндометрия (48,5% и 0%, р<0,001), зон некроза (22,7% и 0%, р=0,005). В биопсийном материале при самопроизвольном выкидыше диагностированы: очаговый склероз и фиброз стромы (10,7% и 60%, р<0,001), отставание дифференцировки фибробластоподобных клеток в предецидуальные (15,3% и 50%, р=0,027), очаговая периваскулярная и перитубулярная лимфо-плазмо-гистиоцитарная инфильтрация стромы (7,7% и 40%, р=0,016), склероз стенок спиральных артерий (12,3% и 50%, р=0,013).
Таким образом, в гравидарном эндометрии I триместра гестации у женщин с неразвивающейся беременностью наблюдается нарушение дифференцировки ворсин хориона с нарушением их васкуляризации – признаков, являющихся морфологическим подтверждением возможной хромосомной патологии, которые явились причиной изменения адекватных обменных процессов между матерью и плодом, необходимых для дальнейшего развития эмбриона. Причиной ранних репродуктивных потерь в виде самопроизвольного выкидыша явилось хроническое воспаление в эндометрии.
Исследования последних лет характеризуются неиссякаемым интересом к вопросам изучения иммунных взаимодействий между матерью и плодом при ПНБ и их связью с состоянием эндометрия при данной патологии. Поскольку ранние потери беременности и последующее выскабливание полости матки подразумевают развитие хронического эндометрита, детальный анализ процессов, наблюдающихся в эндометрии при воспалении, подразумевает наличие нескольких факторов, оказывающих влияние на его состояние при реализации репродуктивной функции. Например, определение в эндометрии патогенных возбудителей, увеличение числа макрофагов и гранулоцитов, морфологических маркеров воспаления, присутствие плазматических клеток, увеличение соотношения про- и противовоспалительных цитокинов, нарушение пролиферации, апоптоза фибробластоподобных клеток, нарушение ангиоархитектоники с повышением экспрессии VEGF, склерозирование эндометрия, увеличение выработки коллагена [15, 18, 19] неблагоприятно сказываются на процессах имплантации и пролонгирования беременности.
Микроорганизмы, связываясь с толл-подобными рецепторами (TLRs), активируют клетки макрофагально-моноцитарного ряда, что приводит к продукции ими провоспалительных цитокинов (интерфероны (IFN) α/β, TNF-α, IL-1, IL-6, IL-8) и к развитию воспаления с целью ликвидации возбудителя [15, 16]. Установлено, что при хроническом эндометрите повышается содержание TNF-α, IL-1β, IL-6, IL-8, IL-10, IL-12α, трансформирующего фактора роста (TGF)-β1, TLR9, VEGF-A, фактора, ингибирующего лейкемию (LIF). При этом при хроническом эндометрите, сочетающемся со склерозированием сосудистой стенки, фиброзом стромы эндометрия, определяется существенное повышение целого ряда цитокинов: TLR9, IL-6, IL-8, TNF-α, TGF-β1, IL-1β, IL-10 [16].
Провоспалительные цитокины выполняют важную роль не только при эндометрите, но и регулируют многие физиологические процессы: пролиферацию, имплантацию, эмбриогенез, но их избыточная продукция вызывает нарушение микроциркуляции, экссудацию и фиброз в эндометрии за счет пролиферации фибробластов, усиленного синтеза коллагена и компонентов экстрацеллюлярного матрикса [20–24]. Склероз сосудов и фиброз стромы эндометрия считаются одними из важнейших маркеров хронического эндометрита, что ведет к «цитокиновому всплеску» [17]. Дисфункция эндометрия, обусловленная воспалением, также сопровождается нарушением репаративных механизмов в полости матки.
Известно, что такие осложнения беременности, как преждевременные роды, гипертензивные расстройства, связаны с увеличением содержания провоспалительных цитокинов (IFN-γ, TNF-α), в то время как спонтанные аборты в ранние сроки беременности характеризуются снижением уровня противовоспалительных цитокинов (IL-4, IL-10) [3, 5]. TNF-α, приводящий к миграции лейкоцитов в очаг воспаления, вызывающий их дегрануляцию и развитие тканевых повреждений, принимает участие в регенерации тканей, стимулирует образование сосудов и пролиферацию фибробластов, что, в свою очередь, ведет к депозиции коллагена и фиброзу в плаценте.
IL-10 является одним из главных противовоспалительных цитокинов. Снижение его экспрессии ворсинами трофобласта у беременных с гипертензивными расстройствами при одновременном повышении продукции TNF-α установлено в различных исследованиях [25].
При хроническом эндометрите нарушается дифференцировка фибробластоподобных клеток эндометрия, возрастает их апоптоз, в механизмах которого при хроническом эндометрите большую роль играет TNF-α, продуцируемый макрофагами. При взаимодействии с одним из рецепторов TNF-α – р55 происходит активация внутриклеточных протеинов (TRADDs – «домены смерти») и последующее связывание их с CD95/Fas, индуцируя апоптоз. Известно, что повышенная экспрессия CD178/FasL на макрофагах CD68+ и CD86+ в децидуальной оболочке наблюдалась в группах самопроизвольного аборта и ПНБ; было продемонстрировано, что FasL опосредует индукцию апоптоза трофобласта макрофагами в совместной культуре [26]. Эти результаты указывают на то, что макрофаг-индуцированный FasL-опосредованный апоптоз может представлять одну из причин ПНБ.
Система CD95/Fas-СD178/FasL является одним из наиболее важных индукторов апоптоза, и изменения продукции одного из этих факторов достаточно, чтобы неблагоприятно повлиять на механизмы апоптоза в трофобласте, нарушить процесс имплантации и помешать пролонгированию беременности [27]. Установлено, что апоптоз стромальных клеток эндометрия благоприятно влияет на имплантацию плодного яйца за счет взаимодействия CD95, экспрессируемого клетками трофобласта, и CD178 на моноцитах и лимфоцитах [26]. Также мононуклеарные клетки, экспрессирующие CD178, стимулируют апоптоз гладкомышечных и эндотелиальных клеток спиральных артерий, экспрессирующих Fas, обеспечивая инвазию вневорсинчатого трофобласта в их мышечный слой с последующим расширением этих сосудов и формированием полноценного кровотока в плаценте, независимого от влияния вазоконстрикторов [28, 29].
Поэтому патофизиология эндометриальной дисфункции при невынашивании беременности на фоне хронического эндометрита, даже при элиминации инфекционного агента, подразумевает наличие дисбаланса про- и противовоспалительных цитокинов, приводящего к нарушению становления системы мать-плацента-плод, феномену эмбриотоксичности, апоптозу инвазивного цитотрофобласта.
Заключение
Изучение иммунологических показателей преимущественно на локальном уровне у женщин с прервавшейся беременностью и ПНБ в анамнезе систематизирует полученные в ходе исследования данные, устранит ряд имеющихся противоречий и позволит в достаточной мере сформировать представление о роли различных факторов, выполняющих ключевую роль в формировании различных компонентов фетоплацентарной системы на этапе ее становления. Полученные данные необходимо учитывать при определении индивидуальной программы предгравидарной подготовки.



