Миома матки в настоящее время – одна из наиболее актуальных и распространенных проблем в гинекологической практике. Согласно мировым исследованиям встречается у 20% женщин старше 30 лет и более чем у 40% женщин старше 40 лет [1]. По данным SOGC Clinical practice guideline (2015), миома матки является наиболее частой гинекологической опухолью с частотой от 70 до 80% у женщин, достигших возраста 50 лет [2].
Альтернативой хирургическому лечению в настоящее время является эмболизация маточных артерий (ЭМА) – современный высокоэффективный органосохраняющий метод, широко используемый в лечении миомы матки [3–6]. В более чем 50% случаев в ближайшем послеоперационном периоде после ЭМА развивается клиническая картина постэмболизационного синдрома, являющегося частью иммуноопосредованного ответа на эмболизацию солидного органа [7, 8]. Как на любую на хирургическую травму, в ответ на ЭМА развивается системная реакция организма, складывающаяся из эндокринного и системного воспалительного (иммунного) стресс-ответа [9]. Для адекватного обеспечения защиты организма необходимо контролировать стрессовые, гемодинамические, эндокринные и метаболические реакции, предотвратить и /или уменьшить болевой синдром и сопутствующие ему эмоциональные реакции [9–12]. Изучение маркеров стресса, контроль проявлений системных реакций при малоинвазивных хирургических вмешательствах, к которым относится ЭМА, купирование постэмболизационного синдрома и оптимизация методов обезболивания являются актуальной научной проблемой.
Цель исследования: провести комплексную оценку течения послеоперационного периода при ЭМА на основе анализа динамики клинических и иммуно-биохимических показателей стресс-реакции и ультразвуковго контроля редукции маточного кровотока. Оценить связь выраженности иммунно-биохимического ответа с выраженностью болевого синдрома и редукцией артериального кровотока в миоматозных узлах по данным допплерометрического контроля. Выявить особенности системной воспалительной реакции при ЭМА.
Материал и методы исследования
Пилотное исследование проведено у 60 больных с диагнозом симптомная множественная миома тела матки, находившихся в гинекологическом отделении клиники НИИКЭЛ и подвергшихся в качестве лечения ЭМА. Критериями включения были: верифицированный диагноз интерстициальная или интерстициально-субсерозная множественная миома тела матки, анестезиологический риск I-II по ASA (American society of anesthesiologists), отсутствие болевого синдрома, вызванного сопутствующей патологией.
Всем больным до проведения ЭМА был выполнен общеклинический лабораторный скрининг; проведена гистероскопия и раздельное диагностическое выскабливание слизистой матки с последующим гистологическим исследованием соскобов; проведено ультразвуковое исследование (УЗИ) органов малого таза. Протокол УЗИ включал трансабдоминальную и трансвагинальную эхографию по общепринятой методике, трансабдоминальную и трансвагинальную цветную допплерографию и цветное допплеровское картирование (ЦДК). Допплерометрию проводили в артериях по периферии, внутри миоматозных узлов, а также в маточных артериях. Изучали максимально возможное количество визуализируемых цветовых локусов, в которых определяли характер кровотока (артериальный или венозный), оценивали скоростные показатели систолического и диастолического кровотока, индекс резистентности (ИР) – отношение разницы между максимальной систолической и конечной диастолической скоростью к максимальной систолической скорости кровотока.
Ангиохирургическое вмешательство проводили в условиях рентгеноперационной. Доступ к маточным артериям осуществляли посредством пункции правой бедренной артерии по стандартной методике Сельдингера с использованием местной анестезии раствором лидокаина. В качестве эмболизата использовали микроэмболы Contour PVA 710-1000 microns и микроэмболы MeriMedical 500-700. В качестве рентгенконтраста использовали йопамидол 370 мг/мл. Средняя продолжительность операции составила 43±0,9 мин. Ангиографическими критериями эффективности ЭМА считали: 1) остановку кровотока в маточной артерии (стаз контрастного вещества в стволе маточной артерии); 2) выраженную опалесценцию в проекции миоматозного узла; 3) ретроградный выброс контрастного вещества из маточной артерии; 4) появление раннего артерио-венозного сброса.
Обезболивание проводили с использованием ненаркотических и наркотических анальгетиков по стандартным показаниям для обеспечения адекватной анальгезии. В качестве ненаркотического анальгетика использовали нефопам – центральный анальгетик без опиатной активности.
Внутривенное введение 20 мг нефопама начинали с момента поступления пациентки в операционную, на момент эмболизации проводили внутривенную инъекцию 20 мг промедола. Послеоперационное обезболивание во всех группах проводили ненаркотическими анальгетиками (нефопам 20 мг 6–8 часов ± кетопрофен 50 мг каждые 6–8 часов) и наркотическими анальгетиками по показаниям.
Эффективность оценивали на основе мониторинга гемодинамических показателей, динамической оценки маркеров стресс-реакции. В послеоперационном периоде пациентки заполняли дневник болевых ощущений, где им предлагалось дать характеристику болевому синдрому, в том числе с использованием визуально-аналоговой шкалы (ВАШ); оценить в динамике наличие, степень выраженности боли. При указании на наличие болевого синдрома предлагалось оценить интенсивность боли и ее влияние на повседневную деятельность, влияние на сон и качество жизни.
Оценивали иммуно-биохимический профиль стресс-реакции, в том числе оценивали уровень в сыворотке крови провоспалительных (интерлейкин (IL)-1, IL-6, фактор некроза опухоли (TNF)α) и противовоспалительных (IL-4, IL-10) цитокинов, С-реактивного протеина; гормональный фон (гормоны стресса): адренокортикотропный гормон (АКТГ), кортизол; уровень гликемии и лактата.
Исследование цитокинов проводили иммуноферментным методом с использованием тест-систем: Human IL-1beta Platinum ELISA Bender MedSystems GmbH, Австрия BMS224HS; IL-10 Platinum ELISA, BMS215/2 BMS215HS, Bender MedSystems GmbH, Австрия; Human TNF-alpha Platinum ELISA, BMS223/4 BMS223HS Bender MedSystems GmbH, Австрия; CRP, HS (C-Reactive Protein) EIA3954 DRG International Inc., США. Количественное определение АКТГ проводили в плазме, обработанной ЭДТА, на анализаторе IMMULITE 2000, Siemens (Германия), количественное определение кортизола в сыворотке крови – на анализаторе IMMULITE 2000, Siemens (Германия). На анализаторе Beckman Coulter AU480(Япония) проводили определение уровня гликемии гексокиназным методом, количественное определение С-реактивного протеина – иммунотурбидиметрическим методом, количественное определение лактата ферментативным тестом.
Гемодинамический профиль включал оценку ЭКГ, частоты сердечных сокращений, неинвазивное измерение артериального давления (АДсист., АДдиаст., АДср.), мониторинг насыщения гемоглобина кислородом. Исследование проводили с использованием монитора Nihon Kohden (Япония).
Контроль вышеуказанных параметров проводили на следующих этапах:
- 1 – при поступлении пациентки в операционную (исходный уровень);
- 2 – через 2 часа после окклюзии маточных артерий;
- 3 – через 24 часа после операции;
- 4 – через 48 часов после операции.
УЗИ органов малого таза выполняли на аппарате «Voluson-E8 Expert BT-12» с использованием мультичастотных датчиков: трансабдоминального частотой 2,5–5 МГц и трансвагиального 3,6–8 МГц. УЗИ проводили до оперативного вмешательства и на третьи сутки после ЭМА.
Исследование было одобрено локальным этическим комитетом. Все лица, участвовавшие в исследовании, дали информированное согласие на участие.
Статистическую обработку результатов проводили на персональном компьютере с помощью пакета Statistica Version 7.0. Проверку нормальности распределения количественных показателей проводили с применением критерия Шапиро–Уилка. Для нормально распределенных выборок вычисляли следующие характеристики: среднюю арифметическую величину (М), стандартную ошибку средней арифметической (m). Данные в этом случае представлены в виде среднего значения и стандартной ошибки средней (М±m). Для выборок, распределение которых отличалось от нормального, рассчитывали медиану (Мe), первый (Q1) и третий (Q3) квартили, данные при этом представлены в виде медианы и межквартильного размаха (Ме (Q1; Q3). Для качественных признаков были рассчитаны абсолютная частота проявления признака (в виде количества обследуемых) и относительная частота проявления признака (в %). Для определения статистической значимости различий в показателях, полученных в разные моменты времени, использовали критерий Фридмана. Для сравнения с исходным уровнем при соответствии нормальному закону распределения использовали парный критерий Стьюдента, в случае отсутствия согласия с нормальным законом – критерий Вилкоксона. Различие двух сравниваемых величин считали статистически значимым при уровне значимости p<0,05. Оценка взаимосвязи показателей проводилась посредством рангового коэффициента корреляции (r) по Спирмену. Корреляционная связь оценивалась как сильная (r>0,75), умеренная (0,25<r<0,75) и слабая (r<0,25). Корреляционною связь считали статистической значимой при p<0,05.
Результаты и обсуждение
Средний возраст пациенток составил 43,3±1,19 года (от 31 до 56 лет); индекс массы тела 26,58±1,06 (здесь и далее среднее значение и стандартная ошибка средней, М±m). Все пациентки соответствовали I–II группе анестезиологического риска по классификации ASA, с преобладанием пациенток со статусом по шкале ASA II (76,6%). Сопутствующая патология характеризовалась стадией компенсации или ремиссии.
Размеры миоматозных узлов не превышали 76,7 мм в диаметре, в среднем 39,5±1,68 мм. У всех пациенток, включенных в исследование, миома носила множественный характер от 2 до 8, в среднем 4,75±1,87 узлов. Узлы имели различную локализацию (исключение и противопоказание для ЭМА – субсерозные узлы на тонком основании).
Окклюзия маточных сосудов и снижение кровоснабжения в узлах миомы приводят к запуску стресса-ответа, проявляющегося как клинической симптоматикой – развитием постэмболизационного синдрома, так и метаболическими, эндокринными и иммунными сдвигами.
Клинически в ближайшем послеоперационном периоде значимых изменений гемодинамики не зарегистрировано. Уровень АДср. не превышал 80,9±1,86 мм рт. ст, без значимого прироста от исходных величин на всех этапах наблюдения. В 1–3-и сутки у 21 пациентки (35%) наблюдали гипертермию до субфебрильных цифр, максимально до 37,7 у двух пациенток. В это же время отмечали увеличение лейкоцитоза до 12,44±1,87 тыс/мкл.
Сенсорным и эмоциональным отражением альтерации является развитие боли. Болевой синдром разной степени интенсивности отмечался у 100% пациенток. При анализе динамики болевых ощущений выявлено нарастание болевого синдрома через 4–8 часов после ЭМА, с сохранением максимальных показателей в первые-вторые сутки послеоперационного периода (табл. 1). Болевые ощущения сопровождаются психологическим дискомфортом, нарушениями сна. 18 (30% из 60) пациенток испытывали довольно сильные болевые ощущения с оценкой 7–10 баллов по ВАШ, которые они не хотели бы испытать повторно.
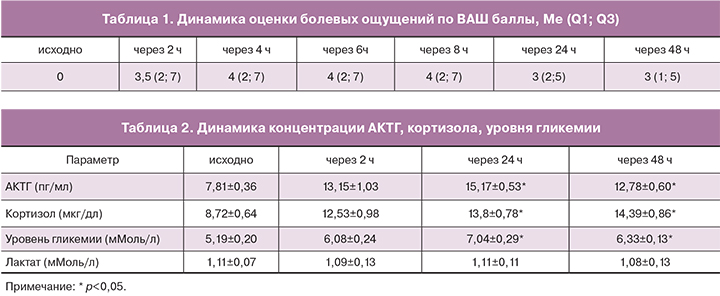
В последние годы установлена значительная взаимозависимость нейроэндокринной и медиаторной цитокиновой систем. Увеличение концентрации провоспалительных цитокинов усиливает секрецию АКТГ, кортикостероидов и катехоламинов, белков острой фазы воспаления, то есть увеличивает интенсивность эндокринного стресс-ответа. В свою очередь, активация гормонального стресс-ответа оказывает стимулирующее влияние на продукцию цитокинов [10, 12]. Безусловно, прирост исследуемых иммуно-биохимических показателей не так выражен, как при обширных оперативных вмешательствах. Тем не менее, увеличение концентраций АКТГ, кортизола, уровня гликемии в нашем исследовании достигает статистически значимых величин от исходного уровня, так же как и прирост сывороточных концентраций маркеров воспалительной реакции. Зарегистрированные нами изменения гуморального и иммунного статуса носят однонаправленный характер. Через 2 часа с момента оперативного вмешательства уровень и цитокинов, и стресс-гормонов начинает увеличиваться, достигая максимума через 24–48 часов.
При оценке эндокринно-метаболического компонента стресс-реакции колебания уровня АКТГ и кортизола происходили в пределах референсных значений этих показателей. Тем не менее, в динамике отмечался статистически значимый прирост концентраций мониторируемых гормонов от исходного уровня с максимальными значениями через 24–48 ч после ЭМА (p<0,05). Максимальные значения АКТГ регистрировались через 24 часа и составили 15,17±0,53 пг/мл (194% исходного уровня 7,81± 0,36 пг/мл), р<0,05. В то же время зарегистрирован прирост сывороточной концентрации кортизола, достигающий 13,8±0,78мкг/дл (158% исходного уровня 8,72±0,64 мкг/дл), р<0,05.
В ответ на хирургическую агрессию увеличивается продукция глюкозы за счет гликогенолиза в печени, индуцируемого симпатической адренергической стимуляцией. Повышение концентрации глюкозы в крови пропорционально интенсивности хирургической травмы. Уже через два часа после ЭМА уровень гликемии статистически значимо превышал исходные значения.
Показатели концентрации лактата не выходили за пределы референсных значений, статистически значимых изменений данного показателя на этапах исследования не прослеживалось. Полные данные динамики эндокринно-метаболических показателей приведены в табл. 2.
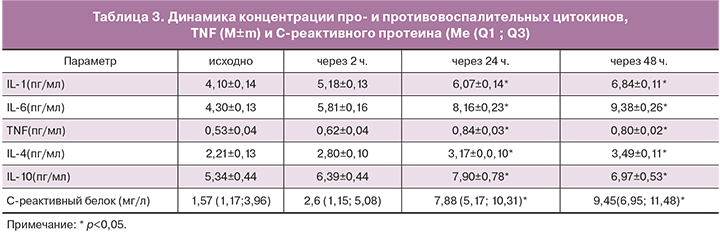
Продукция цитокинов повышается пропорционально тяжести хирургической агрессии и отражает травматичность хирургического вмешательства [10, 13]. После ЭМА прирост концентрации как провоспалительных (IL-1, IL-6, TNFα), так и противовоспалительных цитокинов (IL-4, IL-10) от исходного уровня достигал статистически значимых значений (p<0,05). Максимальный уровень концентраций провоспалительных и противовоспалительных цитокинов совпадал по времени и регистрировался на вторые-третьи сутки после ЭМА. Содержание IL-1 увеличилось по сравнению с исходными данными и составило 6,84±0,11 пг/мл (167% исходного уровня 4,10±0,14 пг/мл), р<0,05. Более значительные изменения концентраций в динамике мы наблюдали при определении содержания IL-6 в послеоперационном периоде. Отмечен рост данного показателя до 9,38±0,26 пг/мл (218% исходного уровня 4,30±0,13 пг/мл), р<0,05. Изучение секреции TNFα в динамике показало прирост показателей до 0,84±0,03 пг/мл (158% исходного уровня 0,53±0,04 пг/мл), р<0,05.
Параллельно с увеличением концентрации провоспалительных цитокинов увеличивалось показатели и противовоспалительных цитокинов. Так, уровень концентрации IL-10 через 48 часов после ЭМА составил 7,90±0,78 пг/мл (147% исходного уровня 5,34±0,44 пг/мл), р<0,05. Аналогичная ситуация прослежена с изменением содержания IL-4, концентрация которого увеличилась до 3,49±0,11 пг/мл (158% исходного уровня 2,21±0,13 пг/мл), р<0,05.
Наблюдалось достоверное повышение уровня С-реактивного белка, являющегося чувствительным индикатором повреждения тканей. В раннем послеоперационном периоде данный показатель увеличился до 9,45 (6,95; 11,48) мг/л (602% исходного уровня 1,57 (1,17; 3,96)), р<0,05.
Полные данные динамики цитокинов и C-рективного белка приведены в табл. 3.
Критериями эффективности эмболизации маточных артерий по данным УЗИ считали полную редукцию артериального кровотока в миоматозных узлах. На 3-и сутки после ЭМА у 56 пациенток (93,3% из 60) внутриузловой кровоток не определялся, у 3 пациенток (5% из 60) сохранялся периферический кровоток по капсуле одного из миоматозных узлов, остальные узлы были аваскулярны. Таким образом, в 98,3% ЭМА оказалась эффективной; лишь у одной пациентки (1,7% из 60) при проведении ЦДК выявлены локусы внутриузловых кровотоков, что было связанно с анатомическими особенностями кровоснабжения матки у данной больной, а именно с сохранением активного кровоснабжения миомы из яичниковой артерии в условиях полной закупорки маточных артерий.
Кроме того, по данным ЦДК на 3-и сутки после ЭМА зафиксировано резкое угнетение кровотока по маточным артериям со снижением максимальной систолической скорости кровотока с 51,9±5,6 см/сек до 15,1±5,1 см/сек (р<0,05) и увеличением ИР с 0,69±0,09 до 0,78±0,04 (р<0,05). В аркуатных артериях вне зон узловой деформации максимальная скорость систолического кровотока уменьшилась с 30,2±0,5 см/сек до 12,7±2,4 см/с (р<0,05), ИР увеличился с 0,64±0,11 до 0,74±0,09 (р<0,05). Полученные данные согласуются с данными литературы [14–16]. По данным УЗИ контроля размер матки и миоматозных узлов на третьи сутки после ЭМА не только не уменьшался, а наоборот, увеличивался. Объем матки составил 207,05±11,8 см3 (р<0,05), при исходных средних показателях 186,66±7,4 см3 средний объем миоматозных узлов – 43,42±2,16 мм3 при исходных 39,5±1,68 мм3 что, по всей видимости, связанно с развитием асептического некроза в узлах, перифокального отека и воспаления стенки матки в постэмболизационном периоде.
Редукция кровотока в узлах, снижение перфузии по маточным артериям являются патофизиологической основой развития постэмболизационного синдрома, что подтверждается выявленной высокой степенью корреляции этих параметров с уровнем прироста стресс-маркеров (IL-1, IL-6, TNFα, IL-4, IL-10, C-реактивного протеина, АКТГ, кортизола, уровня гликемии). Для всех мониторируемых показателей коэффициент корреляции превысил 0,75 (р<0,05). При оценке взаимосвязи уровня болевых ощущений и степени редукции маточного кровотока степень корреляционной связи не превышала умеренной, r=0,68 (р<0,05). При исследовании корреляционных связей между уровнем прироста иммуно-биохимических показателей и субъективным восприятием пациентками болевых ощущений выявлена корреляционная зависимость средней степени выраженности между приростом IL-1, IL-6, r=0,48 (р<0,05) и r=0,56 (р<0,05) соответственно, в остальных случаях коэффициент корреляции на всех этапах исследования не превышал 0,18–0,25 (р<0,05), что соответствует слабой степени корреляции.
Заключение
В постэмболизационном периоде происходит статистически значимое увеличение концентрации в сыворотке крови провоспалительных (IL-1, IL-6, TNFα) и противовоспалительных (IL-4, IL-10) цитокинов, C-реактивного протеина; гормонов стресса – АКТГ, кортизола, уровня гликемии. Степень выраженности стресс-ответа зависит от редукции кровотока в узлах и снижения перфузии по маточным артериям после ЭМА, корреляционная зависимость между данными показателями сильной степени.
Изменения иммуно-биохимического профиля в целом совпадают по направленности и достижению максимальных значений с динамикой выраженности болевого синдрома и косвенными признаками развития асептического некроза узлов и перифокального воспаления стенки матки по данным УЗИ. Корреляционная зависимость между субъективным восприятием болевых ощущений и выраженностью иммуно-биохимических сдвигов не превышает среднюю степень. Также корреляционная зависимость, не превышающая среднюю степень, выявлена между оценкой по ВАШ и снижением перфузии по маточным артериям, что еще раз свидетельствует о многогранности нейрофизиологических процессов формирования болевых ощущений и психоэмоциональных факторов восприятия боли.
Болевой синдром, как одно из основных проявлений постэмболизационного синдрома, регистрируется у 100% пациенток. Около 1/3 пациенток испытывали довольно сильные боли (от 7 до 10 баллов по ВАШ), которые повторно они бы не хотели ощущать. Таким образом, необходима дальнейшая оптимизация методов анальгезии при выполнении ЭМА.



