В настоящее время эмболизация маточных артерий (ЭМА) является современным высокоэффективным малоинвазивным органосохраняющим методом, широко используемым в лечении миомы матки (ММ) [1–5]. В большом количестве публикаций показано, что риск развития серьезных осложнений ЭМА ниже, чем при других вариантах хирургического лечения ММ [6–8].
Но, как и на любую хирургическую травму, в ответ на ЭМА развивается системная реакция организма, складывающаяся из эндокринного стресс-ответа и системного воспалительного (иммунного) ответа [9–11]. В непосредственной функциональной связи с нейроэндокринными и системными воспалительными изменениями находятся изменения в системе гемостаза [12].
Частота развития тромбоэмболии легочной артерии (ТЭЛА) у больных, подвергшихся данной процедуре, по данным литературы, составляет 0,2– 0,4% [13–15] . По данным метаанализа, проведенного Sundeep S. Toor и соавт. [16], частота развития тромбоза глубоких вен у больных после ЭМА составила 0,2%, а ТЭЛА – 0,4% (1 случай на 250 и 500 операций соответственно).
Доброхотова и соавт. [17] указывают на целесообразность включения в известную классификацию степени риска послеоперационных венозных тромбоэмболических осложнений (ВТЭО) Samama C. и Samama M. (в модификации от 1999 г.) [18] дополнительных критериев, повышающих риск ВТЭО в раннем послеоперационном периоде у больных с ММ. К таковым критериям авторы относят: отягощенный семейный тромботический анамнез, неразвивающуюся беременность и осложненное течение беременности в анамнезе, менометроррагии, приводящие к анемии, наличие быстрорастущей миомы, мутация MTHFR (метилентетрагидрофолатредуктазы), мутация Лейдена (точечная мутация V фактора), мутация гена протромбина G 20210A, гипергомоцистеинемия (ГГЦ), положительный волчаночный антикоагулянт (ВА+).
Механизм ЭМА-ассоциированной ТЭЛА не ясен. Hamoda H. и соавт. [14] предполагают теоретическую возможность стаза крови в увеличенных и переполненных венах малого таза при гиперваскуляризированных миомах. Qiu J. и соавт. возможным фактором риска называют длительное давление на место пункции бедренной артерии, ведущее к стазу крови в нижних конечностях [19–21]. В отечественных исследованиях [17, 22, 23] не отмечают выраженных гиперкоагуляционных изменений после ЭМА, за исключением увеличения фибриногена и уменьшения тромбинового времени. В исследовании Рогожкиной и соавт. указывается на прогрессирование активации коагуляционного потенциала у больных с ММ после ЭМА, проявляющееся повышением продуктов паракоагуляции с одновременной активацией процессов фибринолиза.
Таким образом, динамический контроль системы гемостаза в периоперационном периоде и вопрос профилактики тромбоэмболических осложнений при ЭМА у пациенток с ММ крайне актуален.
Рутинные коагуляционные тесты оценивают лишь некоторые отдельные цепочки коагуляционного каскада или уровень отдельных факторов свертывания, но не весь каскад в целом.
Перспективным представляется применение метода тромбоэластографии (ТЭГ), позволяющего провести интегральную оценку состояния системы гемостаза и в течение одного теста оценить все звенья свертывающей системы крови – плазменное, тромбоцитарное и систему фибринолиза [24].
Поэтому цель данного исследования была определена как оценка динамики изменений свертывающей системы крови в периоперационном периоде при ЭМА на основе мониторинга показателей системы гемостаза, включая ТЭГ, и выявление наклонности (или отсутствия) к тромбообразованию.
Материалы и методы
Исследования проведены у 37 пациенток с диагнозом «симптомная множественная миома тела матки», находившихся в гинекологическом отделении клиники НИИКЭЛ. Исследование было одобрено локальным этическим комитетом. Все лица, участвовавшие в исследовании, дали информированное согласие на участие. Критерии включения: верифицированный диагноз интерстициальной или интерстициально-субсерозной множественной миома тела матки, проведение операции ЭМА, анестезиологический риск не выше I–II по ASA (American Society of Anesthesiologists), отсутствие заболеваний, связанных с нарушениями в системе гемостаза, в том числе отрицательные результаты исследования крови на наличие генетических факторов тромбофилии: мутации генов MTHFR, фактора V, протромбина G 20210A; степень риска ВТЭО не выше 1А по классификации C. Samama и M. Samama в модификации от 1999 г. с дополнениями Доброхотовой и соавт. [17, 18].
Всем пациенткам были выполнены общеклинические исследования, коагулограмма с определением протромбинового времени (ПВ), протромбинового индекса (ПТИ), международного нормализованного отношения (МНО), активированного частичного тромбопластинового времени (АЧТВ), концентрации фибриногена, уровня D-димера и растворимых фибрин-мономерных комплексов (РФМК). Отклонения от референсных значений являлись критериями исключения из исследования.
Для оценки венозного кровотока в нижних конечностях и венах малого таза, а также для исключения возможного венозного тромбоза использовали комплексное ультразвуковое исследование (ангиосканирование и допплерографию), которое выполняли на аппарате Voluson-E8 Expert BT-12.
Учитывая низкую степень риска развития венозных тромбоэмболических осложнений, профилактические мероприятия в периоперационном периоде состояли из ранней активации и эластической компрессии нижних конечностей. Медикаментозная профилактика тромбоэмболических осложнений у данных пациенток не применялась.
Ангиохирургическое вмешательство производили в условиях рентгеноперационной. Доступ к маточным артериям осуществлялся посредством пункции правой бедренной артерии по стандартной методике Сельдингера с использованием местной анестезии раствором лидокаина. В качестве эмболизата использовались микроэмболы Contour PVA 700–900 microns и микроэмболы MeriMedical 500–700. В качестве рентгенконтраста использовался йопамидол 370 мг/мл. После проведения ЭМА гемостаз достигался с помощью сшивающей системы ExoSeal. Давящую повязку не применяли. Средняя продолжительность операции составила 21±0,9 мин.
Комплексную оценку функциональной активности системы гемостаза проводили с помощью определения количества тромбоцитов, АЧТВ, ПТИ и МНО, уровня фибриногена, РФМК и D-димера. Всем пациенткам в динамике регистрировали ТЭГ.
При расшифровке тромбоэластограммы учитывали следующие основные параметры.
R (минуты) – время от момента помещения исследуемого образца в анализатор до момента образования первых нитей фибрина, отражает образование тромбопластина и тромбина.
K (минуты) – время от момента начала образования кровяного сгустка до достижения фиксированного уровня прочности сгустка, при которой величина амплитуды (по характеристике прибора) достигает 20 мм, характеризует образование фибрина и отражает кинетику увеличения прочности сгустка.
Угол α (градусы) – угол, построенный по касательной к ТЭГ из точки начала образования сгустка, отображает скорость роста фибриновой сети и увеличение прочности сгустка.
МА (максимальная амплитуда) – наибольшее расстояние, на которое расходятся ветви тромбоэластограммы, отражает максимум динамических свойств соединения фибрина и тромбоцитов посредством GPIIb/IIIa-рецепторов, то есть максимальную прочность сгустка. МА на 80% обусловлена количеством и свойствами (способностью к агрегации) тромбоцитов, на 20%– количеством образовавшегося фибрина.
LY30 – показатель 30-минутного лизиса, опреде- ляемый процентом убывания площади под кривой за 30 минут, характеризует активность системы фибринолиза.
Исследование параметров коагулограммы проводили на автоматическом коагулометре ACL Elit Pro (США). Для определения АЧТВ, ПВ/ ПВ по Квику использовали клотинговые методы, основанные на определении промежутка времени от добавления стартового реактива, запускающего каскад плазмы, до момента образования сгустка (выпадения фибрина). МНО – рассчитывался автоматически как отношение ПВ больного к ПВ контрольной плазмы с учетом международного индекса чувствительности (МИЧ). Фибриноген определяли турбидиметрическим методом. D-димер определяли иммунологическим методом. Панель данных тестов выполняли с реактивами фирмы HemosIL (Instrumentation Laboratory, США). Качественное и количественное определение РФМК проводили с помощью орто-фенантролинового теста с использованием реактивов фирмы «Технология-стандарт», Россия.
Регистрацию ТЭГ проводили с помощью тромбоэластографа TEG 5000 c пробами венозной крови, стабилизированной цитратом натрия, с использованием каолиновых кювет. При проведении тестов пользовали реагенты фирмы HAEMONETICS, США.
Контроль указанных выше параметров производили на следующих этапах:
- при поступлении пациентки в операционную (исходный уровень);
- через 2 ч после окклюзии маточных артерий;
- через 24 ч после операции;
- через 48 ч после операции.
Исследование было одобрено локальным этическим комитетом. Все лица, участвовавшие в исследовании, дали информированное согласие на участие.
Статистическую обработку результатов производили на персональном компьютере с помощью пакета Statistica Version 7.0. Проверку нормальности распределения количественных показателей проводили с применением критерия Шапиро–Уилка. Для нормально распределенных выборок вычисляли следующие характеристики: среднюю арифметическую величину (М), стандартное отклонение (SD). Данные в этом случае представлены в виде среднего значения и стандартного отклонения – М (SD). Для выборок, распределение которых отличалось от нормального, рассчитывали медиану (Мe), первый (Q1) и третий (Q3) квартили, данные при этом представлены в виде медианы и межквартильного размаха – Ме (Q1;Q3). Для сравнения с исходным уровнем при соответствии нормальному закону распределения использовался парный критерий Стьюдента, в случае отсутствия согласия с нормальным законом – критерий Вилкоксона. Различие двух сравниваемых величин считали статистически значимым при уровне значимости р<0,05.
Результаты
Средний возраст пациенток составил 35,8 (3,23) года, индекс массы тела (ИМТ) 26,58 (2,34). Все пациентки соответствовали I–II группе анестезиологического риска по классификации ASA. Сопутствующая патология характеризовалась стадией компенсации или ремиссии.
Размеры миоматозных узлов не превышали 70 мм в диаметре, в среднем 39,5 (13,83) мм. Миома носила множественный характер и узлы имели различную локализацию (исключение для ЭМА – субсерозные узлы на тонком основании).
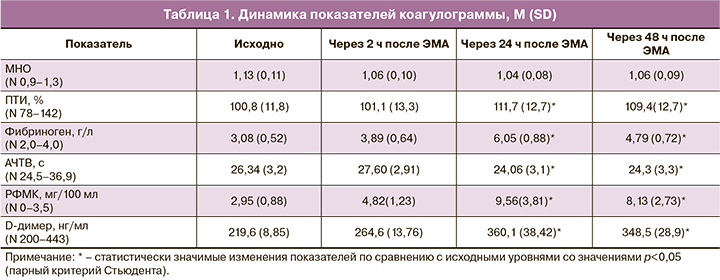
При оценке исходных показателей коагуляционного гемостаза и ТЭГ у пациенток перед ЭМА отклонений от нормативных значений выявлено не было. Так, показатели АЧТВ составили 26,34 (3,2) с, МНО 1,13 (0,11), ПТИ 100,8 (11,8) %. Маркеры тромбинемии и фибринолиза, РФМК и D-димер не превышали нормативных значений и составляли 2,95 (0,88) мг/100 мл и 219,6 (8,85) нг/мл соответственно. Показатели ТЭГ свидетельствовали об исходной нормокоагуляции.
В послеоперационном периоде отмечали статистически значимое укорочение АЧТВ. Минимальные значения данного показателя регистрировали через 24 ч после операции, и они составили 24,06 (3,1) с, что соответствует 91,4% исходных значений (р=0,007). В это же время отмечали статистически значимое увеличение ПТИ до 111,7 (12,7)% , что составило 110,8% от исходных значений (р=0,009). Однако следует подчеркнуть, что прирост данных показателей не выходил за пределы референсных значений в течение всего периода исследования.
Более значимым и динамичным показателем в ходе наблюдения за оперированными пациентами явилась концентрация фибриногена. Максимальных значений она достигала через 24 ч после ЭМА и составила 6,05 (0,88) г/л, 196,4% исходных значений (р<0,001).
В ходе исследования нами зарегистрировано существенное увеличение показателей РФМК и D-димера, изменения которых были наиболее выражены через 24 ч после ЭМА. Так, концентрация D-димера составила 360,1 (38,42) нг/мл, 163,9% исходных значений (р<0,001), РФМК 9,56 (3,81) мг/100 мл, 324% исходных значений (р<0,001), статистически значимо превышая исходные показатели, при этом концентрация РФМК превышала и верхнюю границу референсных значений. Повышение уровня данных показателей свидетельствует об интенсивном внутрисосудистом фибринообразовании и одновременно активации тромболитического процесса. Полные данные динамики показателей коагулограммы приведены в табл. 1.
При динамической оценке показателей ТЭГ оцениваемые показатели не выходили за пределы референсных значений, тем не менее прослеживалась четкая тенденция, указывающая на повышение вязкости крови в динамике и высокую функциональную активность тромбоцитов: так, через 24 ч после ЭМА выявлено статистически значимое укорочение временного интервала R до 5,8 (5;7,1)* мин – 80,5% исходных значений (р=0,009), интервала K до 1,1±(1,08;1,23) мин – 50% исходных значений (р=0,002); увеличение угла α до 71(69,1;73)* градуса – 112,9% исходных значений (р=0,03), повышение величины MA до 70,2 (66,1;70,85) мм – 111,3% исходных значений (р=0,02), что свидетельствует об активации энзиматической части коагуляционного каскада, ускорении образования первых нитей фибрина, увеличении скорости роста фибриновой сети, усилении полимеризации фибрина и увеличении прочности сгустка в сравнении с исходными показателями. Оценка площади под кривой тромбоэластометрии в течение следующих 30 мин после достижения максимальной амплитуды указывает на увеличение фибринолитической активности и развитие компенсаторного вторичного фибринолиза. Показатель лизиса сгустка на 30-й минуте через 24 ч после ЭМА составил 6,03 (4,49;6,84)% – 294,1% исходных значений (р=0,002). Полные данные динамики показателей ТЭГ приведены в табл. 2.

Обсуждение
Полученные результаты свидетельствуют о том, что послеоперационный период после ЭМА сопровождается активизацией системы гемостаза, характеризующейся склонностью к гиперкоагуляции и тромбообразованию. У пациенток после ЭМА в крови повышался уровень маркеров гиперкоагуляции (фибриногена, Д-димера, РФМК), увеличивался ПТИ и уменьшалось АЧТВ. У всех пациентов через 1 сутки после ЭМА имеет место тенденция к гиперкоагуляции по данным ТЭГ (уменьшение показателей времени R, K и увеличение угла α, повышение величины MA) с одновременной активацией фибринолиза (увеличение показателя LY 30), что в целом свидетельствует об увеличении риска ВТЭО в послеоперационном периоде после ЭМА.
Представленные нами данные в целом не противоречат исследованиям, ранее проведенным у пациенток, подвергшихся ЭМА [21–24].
В подавляющем большинстве описанных в литературе случаев ВТЭО, в том числе фатальной и нефатальной ТЭЛА, после ЭМА предрасполагающих факторов в анамнезе, в том числе мутаций, ведущих к тромбофилии, в ходе периоперационного обследования выявлено не было [14, 15, 19, 25, 26].
В первые сутки после ЭМА имеет место значительное снижение максимальной скорости кровотока в маточных артериях [27, 28]. Уменьшение притока артериальной крови к матке в первую очередь приводит к ишемии органа с развитием некробиотических и некротических изменений в тканях лейомиомы и в меньшей степени – в миометрии [29]. Замедление кровотока затрагивает и венозную систему матки, в той или иной степени измененную на фоне наличия миомы. Данные изменения являются патоморфологической основой развития хирургического стресс-ответа, проявляющегося иммуно-биохимическими изменениями и активацией системы гемостаза с развитием гиперкоагуляционных сдвигов. Согласно теории Вирхова, гиперкоагуляция, стаз и повреждение стенки сосуда являются основными причинами развития тромбоза. Тканевой фактор, присутствующий в зоне повреждения, запускает образование активных форм факторов свертывания, которые, в свою очередь, могут диффундировать вглубь кровотока. Появления тромбина в наномолярных количествах в какой-то области кровотока достаточно, чтобы резко активировать факторы XI, IX, VIII. А они продолжают каскад реакций, ведущих опять к тромбину [30]. Процесс тромбообразования может быть запущен как в венах нижних конечностей, так и в венах малого таза, в последнем варианте компрессионные чулки не будут оказывать профилактического действия. Учитывая вышесказанное, следует рассмотреть целесообразность использования прямых антикоагулянтов для тромбопрофилактики при ЭМА.
Таким образом, необходимы дополнительные исследования для разработки эффективных мер профилактики ВТЭО у пациенток при ЭМА.
Заключение
У больных, перенесших ЭМА, при отсутствии медикаментозной профилактики тромботических осложнений на 2-й день послеоперационного периода происходит статистически достоверное повышение фибриногена, повышается уровень маркеров гиперкоагуляции (Д-димер, РФМК), увеличивается ПТИ и уменьшается АЧТВ. У всех пациентов через 24 ч после ЭМА отмечалась тенденция к гиперкоагуляции по данным ТЭГ (уменьшение показателей времени R, K и увеличение угла α, повышение величины MA), что в целом свидетельствует об увеличении риска ВТЭО в послеоперационном периоде после ЭМА.
Выявленные особенности изменения гемостазиологических показателей у больных после ЭМА свидетельствуют о необходимости проведения постоянного мониторинга системы гемостаза и разработке эффективных мер профилактики ВТЭО.



