Интенсивное развитие в последние годы молекулярной медицины во многом расширило понимание процессов репродуктивной биологии и эмбриологии. Прогресс в этой области позволил получить
прецизионные данные относительно механизма роста кровеносных сосудов. Одним из важных этапов в этой области стало использование клеточных культур и определение ауто- и паракринных факторов при исследовании тонких механизмов регуляции ангиогенеза [3].
В настоящее время активно изучается роль ангиогенеза и ангиогенных факторов в репродуктивных
процессах. Известно, что ангиогенез – это развитие новых сосудов из уже существующих, в то
время как васкулогенез – образование кровеносных сосудов у эмбриона и плода de novo. Оба процесса
происходят в организме плода во время формирования сердечно-сосудистой системы. Васкулогенез
не наблюдается во взрослом возрасте. Развитие новых кровеносных сосудов из имеющихся происходит во взрослом возрасте и встречается при репаративных поцессах в ранах. Ангиогенез лежит в основе всех процессов репродуктивного цикла женщины: менструации, овуляции, имплантации. В настоящее время очевидно, что рост, развитие и регрессия кровеносных сосудов – это ключевые механизмы процессов репродукции.
Ангиогенез состоит из процессов пролиферации, миграции эндотелиальных клеток и формирования трубки. В капиллярах ключевые взаимодействия происходят между эндотелиоцитами и внеклеточным матриксом. В настоящее время изучен широкий спектр ростовых факторов, способствующих или тормозящих ангиогенез. Наиболее важные регуляторные соединения входят в семейства эндотелиальных ростовых факторов (ЭФР), факторов роста фибробластов (ФРФ) и трансформирующих факторов. Эти семейства включают множество белков близкой структуры, часто связывающихся с одними и теми же или очень близкими рецепторами. Большинство веществ подавляют ангиогенез, некоторые являются результатом протеолиза более крупных молекул, таких как коллаген VIII, антитромбин III и плазминоген [1, 2, 5, 8, 10, 12].
Активированные эндотелиоциты образуют новые кровеносные сосуды двумя путями. Они либо распространяются вдоль существующих сосудов в новом направлении, либо прорастают внутри существующих сосудов, образуя развилки. Этот процесс требует тонкой клеточной регуляции, т.к. эндотелиоциты, потерявшие между собой контакт или обнаруживающие друг друга в несоответствующих условиях, подвергаются апоптозу, программированной клеточной гибели. Сигнальными механизмами, посредством которых клетки общаются между собой и определяют собс-
твенную судьбу, являются интегрины, молекулы адгезии (кадгерины, сосудистые эндотелиоциты,
рецептор ЭФР) [7].
Существуют взаимодействия между эндотелиоцитами, перицитами и гладкомышечными клетками, осуществляемые частично за счет ростовых факторов, а также за счет семейства ангиопоэтинов. Ангиопоэтин-1 высвобождается перицитами (мезенхимальные клетки, поддерживающие эндотелий) и усиливает ангиогенез. Ангиопоэтин-2 связывается с тем же рецептором, что и ангиопоэтин-1, однако является его антагонистом, и под его влиянием происходит атрофия сосудов, однако в присутствии ЭФР ангиогенез стимулируется [4, 9, 13].
Регуляция ангиогенеза предполагает реализацию этих механизмов через факторы, которые воздействуют на сосудообразование. Они могут активировать и подавлять развитие сосудов, ускорять, интенсифицировать их рост, влиять на формирование стенки сосудов, направление их роста.
Список регуляторов ангиогенеза достаточно широк и включает не только различный спектр веществ, но и ряд определенных состояний организма.
Š
Эндогенные регуляторы ангиогенеза :
‒ цитокины, гормоны и факторы роста;
‒ компоненты экстрацеллюлярного матрикса (ламинин, фибронектин) и их рецепторы (интегрины a-V, a-V);
‒ матричные металлопротеиназы (MMPs) и их тканевые ингибиторы (TIMPs) и регуляторы (MMPs);
‒ протеазы — плазминоген, активаторы урокиназы (иРА) и урокиназы тканевого типа (tPA), фибрин;
‒ воспалительные клетки и перициты;
‒ гипоксия и гипогликемия;
‒ острый стресс и перенапряжение.
Процессы сосудистого роста находятся под контролем индукторов и ингибиторов васкуляризаиии.
В норме секреция тканевых ингибиторов ангиогенеза превалирует над индукторами. В результате во взрослом организме процесс ангиогенеза подавлен, и только 0,01% эндотелиальных клеток способны к делению. Уменьшение синтеза ингибиторов или увеличение секреции индукторов приводит к стимуляции ангиогенеза. За пуск или подавление данного процесса осуществляется сменой местного равновесия между соответствующими регуляторами и ингибиторами .
Индукторы ангиогенеза ‒ огромное число самых разнообразных факторов, инициирующих рост сосудов и поддерживающих структуру вновь образованной сосудистой сети. В качестве стимуляторов могут выступать не только ростовые факторы, но и самые разнообразные воздействия: гипоксия,
воспалительные изменения тканей и т.д. [11].
Среди этих факторов — сосудистый эндотелиальный фактор роста (СЭФР), продуцируемый в основном клетками эндотелия, является медиатором неоангиогенеза, необходимым компонентом репродуктивных процессов, эмбрионального развития, формирования плаценты.
По мнению ряда авторов, в основе патогенеза многих заболеваний лежит дисбаланс между факторами, регулирующими процессы пролиферации клеток и ангиогенеза [6].
Результаты ряда клинических исследований свидетельствуют о том, что изучение роли СЭФР при
различных видах патологии в акушерстве и гинекологии следует считать актуальным и перспективным с клинической и научно-исследовательской точки зрения [4, 6].
Целью настоящего исследования явилось изучение содержания СЭФР в сыворотке крови у женщин, включенных в программу ЭКО, и определение его клинического значения.
Материал и методы исследованияŠ „ ‰
Были обследованы 86 женщин в возрасте от 28 до 43 лет (средний возраст 35,5 ± 7,5 года) с неудачами ЭКО в анамнезе. Эти пациентки составили следующие клинические группы. I группа (n=44)
– пациентки с бесплодием неясного генеза, из них у 34 бесплодие I (у 21 ‒ неудачи ЭКО) и у 10 еспло-
дие II и неудачи ЭКО. II группа (n=27) – беременные после программы ЭКО, 24 из них – с неудачами ЭКО в анамнезе. III группа (n=15) – здоровые небеременные женщины.
Всем пациенткам проведено ультразвуковое исследование органов малого таза, обследование на половые инфекции, определение гормонального статуса, состояния системы гемостаза, молекулярно-генетический анализ факторов риска тромбофилии, иммунологическое, генетическое (определение кариотипа супругов) исследования. В сыворотке крови женщин определяли маркер локального гемостаза СЭФР с 20-го по 24-й день менструального цикла, концентрацию СЭФР иммуноферментным методом с помощью набора коммерческих реактивов фирмы eBioscience Human VEFF-A (Австрия) (пг/мл).
Статистический анализ полученных результатов исследования проводили на персональном компьютере с использованием пакета прикладных программ Statistica по стандартным методикам.
Критериями включения пациенток в исследование были ненарушенный менструальный цикл, по данным гистеросальпингографии проходимые маточные трубы и матка без какой-либо патологии,
нормальные значения половых гормонов и гормонов щитовидной железы, исследование гемостаза,
исследование инфекционного и иммунного статусов.†‹ ‰
ŒРезультаты исследования и обсуждение
Было показано, что у пациенток I и II групп уровень СЭФР в сыворотке крови значительно выше
нормы: в I группе – 180±50 пг/мл, во II ‒ 220±30 пг/мл. В III группе концентрация СЭФР была в пределах нормы (42,6 пг/мл). Результаты проведенных исследований свидетельствуют о том, что при
неудачной имплантации плодного яйца уровень СЭФР в сыворотке крови повышен по сравнению
с физиологической величиной. Изменение нормального течения этих процессов может иметь немаловажное значение в нарушении имплантации и плацентации. Дизрегуляторные процессы усиливаются также в результате повышения продукции СЭФР, стимулирующего пролиферацию клеток, контролирующего развитие и регресс сосудов.
Таким образом, высокий уровень СЭФР может способствовать неудачной имплантации плодного
яйца и являться ранним маркером неудач ЭКО.
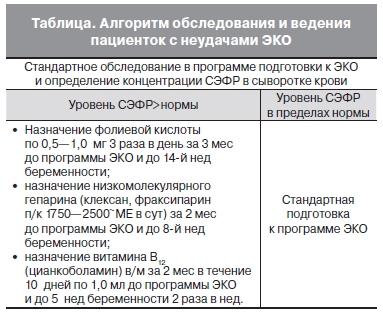
Основываясь на результатах обследования, был составлен алгоритм ведения этих пациенток. Всем
обследованным пациенткам в программе подготовки к ЭКО проводилась корригирующая терапия препаратами витаминов группы В, фолатами и антикоагулянтами (см. таблицу).
На фоне проведенной терапии у 38 женщин (44,1%) с неудачами ЭКО в анамнезе наступила
беременность.
Таким образом, применение данного алгоритма обследования и ведения пациенток с неудачными
попытками ЭКО позволяют не только повысить его эффективность, но и своевременно прогнозировать его неудачи. Но, учитывая малую выборку, необходимо продолжить исследования по изучению роли СЭФР в процессе имплантации.



