Эндометриоз является достаточно часто встречающимся гинекологическим заболеванием; его распространенность достигает 40–60% среди женщин с хронической тазовой болью (ХТБ) и 50% – с бесплодием [1–4]. Несмотря на то что почти 90% женщин с эндометриозом имеют те или иные проявления болевого синдрома, задержка в постановке диагноза в среднем составляет 6–8 лет. По статистике, женщина может посетить примерно 5 врачей, прежде чем будет диагностирован эндометриоз и начато лечение [5–7]. На это, с одной стороны, влияет недостаточная информативность ультразвуковой диагностики (УЗИ), чувствительность и специфичность которой во многом зависит от опыта врача, в особенности – для перитонеального (ПЭ) и глубокого эндометриоза (ГЭ) [8–14]. С другой стороны, это связано с широкой вариабельностью симптомов, нередко при отсутствии акцентирования внимания на основных клинических проявлениях заболевания на приеме у врача. Результаты наблюдательного перекрестного исследования, проведенного во Франции с 2005 по 2021 гг., показали, что женщины с эндометриозом могут предъявлять жалобы, характерные для 41 категории симптомов, в том числе – на жар, тошноту или зуд во влагалище [15]. В свою очередь, Chapron C. et al. в своей работе, включавшей 1685 пациенток, показали, что жалобы на дисменорею предъявляют и 58,3% женщин с лапароскопически исключенным эндометриозом [16].
Хотя данные литературы разноречивы, имеются предпосылки к возможности предположения наличия эндометриоза и его отдельных форм на основании его клинических проявлений [7, 17, 18]. Так, Chen C. et al. продемонстрировали, что наличие интенсивного болевого синдрома в 2 и более локализациях в сочетании с желудочно-кишечными проявлениями повышает вероятность наличия эндометриоза в 15 раз [17]. В другом исследовании Chapron С. et al. показали, что эндометриоз крестцово-маточных связок связан с тяжелой ХТБ и глубокой диспареунией, эндометриоз влагалища – с симптомами нижних мочевыводящих путей, колоректальный эндометриоз (КРЭ) – с выраженной дисменореей и желудочно-кишечными симптомами [18]. Кроме того, было установлено, что для эндометриоидных кист яичников (ЭК) преимущественно нехарактерны выраженные клинические проявления заболевания, а болевой синдром связан с наличием других сопутствующих форм эндометриоза – ПЭ и ГЭ [19, 20].
Другим важным аспектом проблемы является склонность наружного генитального эндометриоза (НГЭ) к прогрессированию и рецидивированию. Ранее лапароскопия с гистологической верификацией считалась золотым стандартом диагностики [9]. К настоящему моменту эта тактика пересмотрена ввиду того, что операция, в отсутствие последующего назначения супрессивной гормонотерапии, не решает проблему, а у каждой 2-й пациентки к 5–7-му году наблюдения может возникать рецидив заболевания, а также могут формироваться более тяжелые формы эндометриоза, в частности – ГЭ [21–23].
Ввиду того, что работы, указывающие на риск послеоперационного прогрессирования эндометриоза, достаточно малочисленны, целью настоящего исследования явилась оценка клинико-анамнестических данных пациенток с разными формами НГЭ с учетом перенесенных оперативных вмешательств.
Материалы и методы
В одномоментное исследование были включены 200 женщин в возрасте от 18 до 49 лет (средний возраст – 32,03 (7,15) года, средний индекс массы тела – 21,35 (3,35) кг/м2) с наличием НГЭ, выявленного по данным экспертного УЗИ и магнитно-резонансной томографии (МРТ) органов малого таза (ОМТ). У 54% пациенток НГЭ был лапароскопически и гистологически верифицирован: у 63/200 (31,5%) – во время предшествующего оперативного вмешательства до момента включения в исследование, у 45/200 (22,5%) – при последующей первой плановой операции.
Исследование проводилось на базе ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России (далее – Центр) в период с 2021 по 2023 гг.
Проводились сбор жалоб и анамнеза, в том числе о предшествующем оперативном лечении и приеме гормонотерапии, а также анкетирование пациенток о наличии различных проявлений болевого синдрома и не гинекологических заболеваний, ассоциированных с ним. Критериями исключения являлись: онкологические заболевания женской репродуктивной системы в настоящий момент или в анамнезе; беременность и лактация; отсутствие признаков НГЭ по данным экспертного МРТ, выполненного или пересмотренного в Центре. С целью уменьшения вероятности систематической ошибки были исключены пациентки с наличием только аденомиоза.
МРТ ОМТ выполнялось с помощью МРТ-аппаратов GE Signa Excite 1.5T и GE Signa Architect 3.0T, использование контрастного усиления проводилось в случаях необходимости дифференциальной диагностики эндометриоидного поражения, а также как вспомогательный инструмент визуализации экстрагенитальных форм эндометриоза (ЭГЭ). При МРТ выполнялась оценка интенсивности сигналов на Т1-(Т1-ВИ) и Т2-взвешенных изображениях (Т2-ВИ), выполненных в сагиттальной, аксиальной и корональной плоскостях, а также на диффузионно-взвешенных изображениях с использованием толщины среза 0,3 см и поля зрения 32–42 см. Визуальная диагностика ЭК, ГЭ и ЭГЭ осуществлялась согласно рекомендациям Европейского общества урогенитальной радиологии [24]. Предполагаемый диагноз ПЭ устанавливался при наличии в области малого таза МР-признаков эндометриоидных гетеротопий размерами менее 0,5 см, с гипоинтенсивным сигналом на Т2-ВИ, с пикулообразными неоднородными контурами по серозному покрову матки, на связочном аппарате, включая крестцово-маточные связки, а также брюшины других локализаций и пузырно-маточной, параметриальной клетчатки [10–14]. В зависимости от предполагаемой формы эндометриоза, выявленной по данным МРТ, пациентки были распределены на 3 группы: с ПЭ, ЭК и ГЭ; при сочетанной патологии включение в ту или иную группу осуществлялось по наиболее тяжелой форме эндометриоза.
При анализе причины обращаемости учитывалась ведущая жалоба, с которой пациентка обратилась на прием. ХТБ определялась как наличие ациклической боли внизу живота на протяжении как минимум 6 месяцев, не связанной с менструацией, овуляцией или половым актом. Диспареуния оценивалась только среди женщин, живущих половой жизнью, бесплодие – у планирующих беременность. Перед проведением расчета полученного материала все данные были полностью обезличены. Исследование одобрено локальным Этическим комитетом ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России.
Статистический анализ
Расчет объема выборки проводился на основании частоты распространенности дисменореи, как наиболее значимого клинического проявления эндометриоза [9], что при уровне значимости в 5% и мощности 90% составляет 51 женщина. Первоначально из общей популяции в исследование была отобрана 261 пациентка с подозрением на наличие ГЭ по данным экспертного УЗИ ОМТ Центра. Впоследствии 48 пациенток не пришли повторно, 9 не выполнили МРТ ОМТ, у 4 не был выявлен НГЭ по МРТ. Итоговый размер выборки составил 200 пациенток, что является репрезентативной выборкой в целом и для каждой из подгрупп в отдельности.
Для количественных показателей были рассчитаны: среднее значение (М), среднеквадратическое отклонение (SD), медиана (Ме), интерквартильный интервал (Q1; Q3). Для качественных и порядковых показателей – частоты (%). Все полученные количественные параметры были проверены на соответствие нормальному распределению с помощью критерия Шапиро–Уилка. Числовые параметры, имеющие нормальное распределение, представлены в формате М (SD). Параметры, имеющие распределение, отличное от нормального, представлены в формате Ме (Q1; Q3). Определение статистической значимости (p) между тремя выборками проводилось по критерию Краскела–Уоллиса (непараметрический критерий для 3 и более независимых выборок). В данной работе использовалась программа IBM SPSS Statistics (v.26). Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты
ПЭ наблюдался у 68/200 женщин (34%), ЭК – у 53/200 (26,5%), ГЭ – у 79/200 (39,5%). Изолированные ЭК и ГЭ наблюдались лишь в 9/200 (4,5%) и 4/200 (2%) случаях соответственно; в большинстве наблюдений была сочетанная патология, о чем свидетельствуют данные, представленные на рисунке 1. Следует отметить, что каждая 4-я пациентка имела сопутствующий КРЭ, каждая 13-я – ЭГЭ других локализаций (мочевого пузыря, рубца, аппендикса), ЭГЭ чаще наблюдался в сочетании с ГЭ. НГЭ сочетался с аденомиозом в 182/200 (91%) случаев. Клиническая характеристика пациенток, разделенных на подгруппы в соответствии с формой НГЭ, представлена в таблице 1.
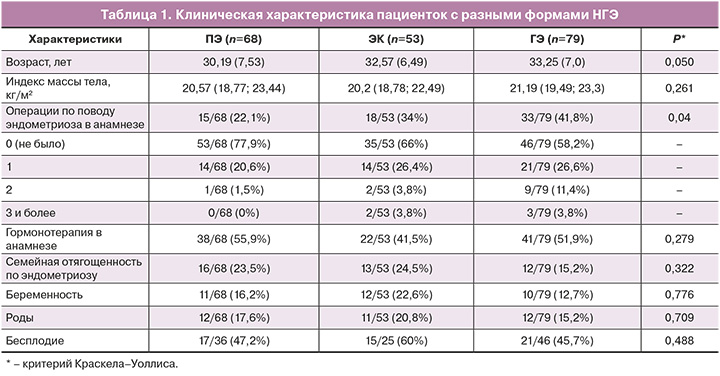
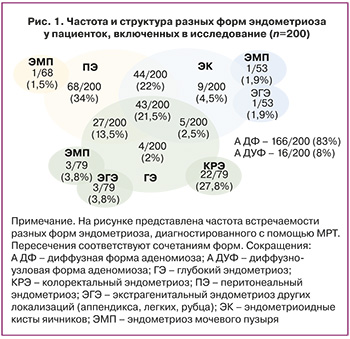
Согласно полученным данным, с возрастом прослеживалась тенденция к формированию более тяжелых форм эндометриоза. Так, среди женщин ≤30 лет ПЭ диагностировался у 38/87 (43,7%), ЭК – у 22/87 (25,3%), ГЭ – у 27/87 (31%), в то время как у пациенток старше 30 лет частота встречаемости этих форм эндометриоза составила 30/113 (26,5%), 31/113 (27,4%) и 52/113 (46,1%) соответственно (табл. 2).
Важно отметить, что в возрасте от 18 до 24 лет в каждом 3-м случае был диагностирован ГЭ, при этом в 90,9% случаев отмечался первичный ГЭ. Данная когорта пациенток характеризовалась дефицитом (5/11, 45,5%) или нормальным индексом массы тела (19,38 (1,46) кг/м2), наличием клинической гиперандрогении (8/11, 72,7%) и дисменореи, преимущественно – первичной (8/11, 72,7%) высокой степени интенсивности (8,27 (1,34) баллов), в более чем 90% случаях сочетающейся с другими проявлениями болевого синдрома – ХТБ, диспареунией, предменструальными и овуляторными болями. В каждом 3-м случае женщины имели апоплексию яичников в анамнезе (4/11, 36,4%), что наблюдалось в 2 раза чаще в сравнении с пациентками той же возрастной группы с ПЭ (3/16, 18,8%).
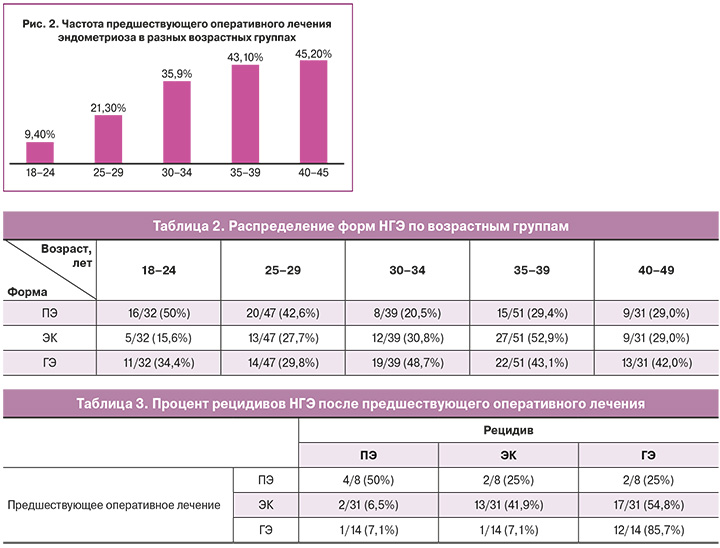
С увеличением возраста пациенток возрастал и процент женщин с произведенными оперативными вмешательствами по поводу эндометриоза в анамнезе. Так, среди 63 пациенток с предшествующим оперативным лечением каждая 10-я женщина уже была оперирована в возрасте 18–24 лет, примерно каждая 5-я – в 25-29 лет, а в возрасте 30 лет и старше – почти каждая 2-я женщина (рис. 2). Ранее имели 1 операцию 47/63 (74,6%) пациенток, 2 операции – 11/63 (17,5%) и 3 и более операции в анамнезе – 5/63 (7,9%).
У 19/39 (48,7%) пациенток, ранее оперированных по поводу ПЭ и ЭК, в последствие был диагностирован ГЭ. Среди пациенток с предшествующей операцией по поводу ЭК у 41,9% произошел рецидив эндометриом, у 54,8% – прогрессия в ГЭ. ГЭ в 85,7% случаев рецидивировал в ту же форму НГЭ и лишь в 14,2% – в ЭК и ПЭ. Среди пациенток, ранее оперированных по поводу КРЭ, у 3/5 (60%) в дальнейшем был выявлен ГЭ, у 2/5 (40%) – рецидив КРЭ (табл. 3).
Следует отметить, что каждая 3-я пациентка из ранее оперированных (19/63, 30,2%) не получала супрессивную гормонотерапию после проведенного оперативного вмешательства; частота рецидива в данной группе женщин составила 94,7% (18/19). Средняя продолжительность послеоперационного лечения пероральными прогестагенами составила 9,73 (5,46) месяцев, комбинированными оральными контрацептивами – 7,07 (3,67) месяца, агонистами гонадотропин рилизинг-гормона – 4,0 (1,56) месяца. Важно отметить, что в 56,8% (25/44) случаев терапия назначалась короткими 3–6-месячными курсами, и рецидив происходил через 3 и более месяца после ее окончания у 23/25 пациенток (92%). Лишь в 4 случаях рецидив НГЭ произошел на фоне приема гормонотерапии – в 2 случаях рецидив ЭК на фоне 9 и 36 месяцев приема диеногеста, в 1 случае – 12 месяцев приема комбинированных оральных контрацептивов, в 1 случае – 24 месяцев левоноргестрел-содержащей внутриматочной системы (ЛНГ-ВМС) 20.
Анализ причин обращаемости показал, что каждая 3-я женщина приходила на прием к гинекологу с жалобами, не характерными для НГЭ (70/200, 35%) (рис. 3). Каждая 10-я пациентка обращалась для планового ежегодного обследования (23/200, 11,5%), каждая 13-я – для подбора терапии, в том числе – контрацепции. К более редким причинам обращаемости можно отнести наличие акне, вульвовагинита, мастодинии и другие. Среди специфичных для эндометриоза жалоб можно отметить болевой синдром, включающий дисменорею и ХТБ (86/200, 43%), аномальные маточные кровотечения (АМК) (26/200, 13%), в более редких случаях – бесплодие (18/200, 9%).
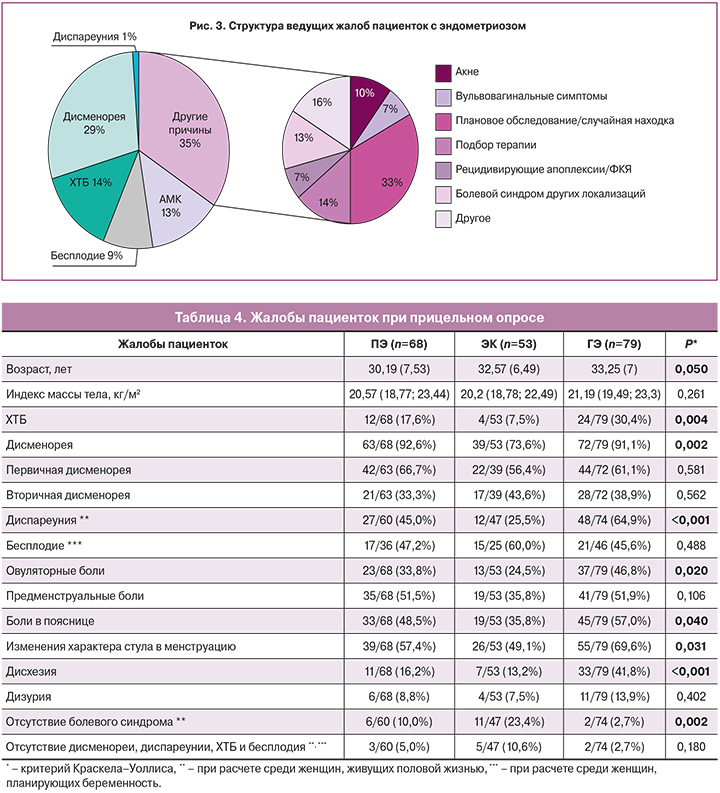
Структура жалоб варьировала в зависимости от формы эндометриоза. Так, по причине дисменореи, диспареунии или ХТБ обращались 23/68 (33,8%) пациентки с ПЭ, 16/53 (30,2%) – с ЭК и 47/79 (59,5%) – с ГЭ. С жалобами, не характерными для генитального эндометриоза, обращалась каждая 2-я пациентка с ЭК (26/53, 49,1%), каждая 3-я – с ПЭ (26/68, 38,2%) и лишь каждая 5-я – с ГЭ (18/79, 22,8%) (р=0,007). У каждой 3-й пациентки ЭК были случайной находкой, выявленной по УЗИ (19/53, 35,8%).
При прицельном опросе было установлено, что дисменорея с менархе отмечалась у 108/200 (54,0%), вторичная дисменорея – у 66/200 (33,0%) женщин. Среди общей когорты пациенток у 89,5% отмечалось хотя бы одно из проявлений болевого синдрома, несмотря на отсутствие таковых жалоб при обращении (табл. 4). Важно отметить, что ряд типичных для эндометриоза проявлений, таких как диспареуния, дисхезия и изменения характера стула в менструацию статистически значимо чаще регистрировались при ГЭ. ЭК примерно в каждом 5-м случае характеризовались отсутствием каких-либо жалоб на «классические» симптомы эндометриоза.
Несмотря на достаточно высокую частоту болевого синдрома, среднее время от момента возникновения жалоб, в частности – дисменореи, до верификации эндометриоза составило 10 (3,5; 15) лет, для ХТБ – 1 (0; 3) год. Можно полагать, что у 78/200 (39%) пациенток эндометриоз манифестировал в возрасте <18 лет, практически у каждой 2-й – до 20 лет (96/200, 48%), у 79,5% женщин – до 30 лет (159/200). После 30 лет тенденция к возникновению клинических проявлений эндометриоза снижалась – в возрасте 30–34 лет их частота составила 13,5% (27/200), 35–39 лет – 4,5% (9/200), 40 лет и старше – лишь 2,5% (5/200).
После впервые установленного диагноза НГЭ или подтвержденного рецидива 105/200 пациенткам (52,5%) была рекомендована гормонотерапия: 79/105 (75,2%) – диеногест, 18/105 (17,1%) – комбинированные оральные контрацептивы, 3/105 (2,9%) – агонисты гонадотропин-рилизинг-гормона, 5/105 (4,8%) установлена ЛНГ-ВМС 20. Остальным пациенткам терапия не была назначена: в связи с планированием беременности (18/200, 11,1%), необходимостью проведения оперативного вмешательства (59/200, 29,5%), а также по причине не явки на повторный прием (18/200,11%). Показаниями к оперативному лечению у 40/59 (67,8%) пациенток служило наличие ГЭ в сочетании с ЭК и/или ЭГЭ, у 12/59 (20,3%) – ЭК более 4 см в диаметре, у 7/59 (11,8%) – НГЭ в сочетании с бесплодием или интенсивным болевым синдромом.
Обсуждение
Эндометриоз – заболевание с достаточно ярко выраженными клиническими симптомами, которое, однако, нередко остается длительное время недиагностированным. По данным проведенного исследования, каждая 3-я пациентка с эндометриозом обращалась на прием с жалобами, не имеющими отношения к основному заболеванию. Что касается типичных проявлений НГЭ, то прослеживалась тенденция к их зависимости от формы эндометриоза. Так, при ЭК реже отмечались жалобы на боль, чем при ПЭ и ГЭ, у каждой 3-й пациентки ЭК являлись случайной находкой при выполнении УЗИ. Важно отметить, что женщины с ЭК в сравнении с пациентками с ПЭ и ГЭ статистически значительно реже предъявляли жалобы на дисменорею, в 2–2,5 раза реже – на диспареунию и в 2,5–4 раза реже – на ХТБ соответственно. Примерно у каждой 4-й пациентки с ЭК не наблюдались все 3 «классических» проявления болевого синдрома, в то время как отсутствие характерных эндометриоз-ассоциированных жалоб у женщин с ПЭ составило 10,0%, с ГЭ – лишь 2,7%. Действительно, согласно данным литературы, болевой синдром при ЭК чаще сопряжен с другими сопутствующими формами НГЭ. По результатам исследований среди пациенток с изолированными ЭК лишь в 38,3% случаев присутствовал болевой синдром, а в 61,7% активных жалоб не было [19, 20]. Разница между пациентками с ПЭ и ГЭ на первый взгляд не столь очевидна. Как показали результаты исследования, несмотря на то что для ПЭ, в отличие от ГЭ, менее характерно наличие ХТБ (17,6 и 30,4%) и дисхезии (16,2 и 41,8% соответственно), при этой форме достаточно часто отмечаются диспареуния (45,0 и 64,9%) и овуляторные боли (33,8 и 46,8% соответственно), а процент женщин с полным отсутствием эндометриоз-ассоциированных жалоб, включая бесплодие, и вовсе был сопоставим (5,0 и 2,7%). Эти данные указывают на целесообразность проведения МРТ при подозрении на НГЭ, а также пациенткам с эндометриомами, в особенности – с болевым синдромом, с целью оценки степени распространенности эндометриоза и определения дальнейшей тактики ведения. Важно отметить, что в возрастной группе от 18 до 24 лет в каждом 3-м случае был диагностирован ГЭ, причем в 9 из 10 случаев отмечались признаки первичного ГЭ, что ставит под сомнение концепцию о том, что данная форма НГЭ – это болезнь более «возрастных» женщин. Полученные нами данные позволяют рассмотреть вопрос о необходимости выполнения МРТ пациенткам молодого возраста с наличием болевого синдрома даже при отсутствии признаков генитального эндометриоза по УЗИ.
Несмотря на то что ЭК являются одной из наиболее распространенных форм эндометриоза с частотой встречаемости, по данным нашего исследования, в 50,5% случаев, изолированные эндометриомы наблюдались редко – в 4,5% случаев. Эти результаты сопоставимы с исследованием Theobald P. et al., в котором ЭК интраоперационно верифицировались в 40–50%, ПЭ – в 20–30%, КРЭ – в 10–20%, ЭМП – менее чем в 10% случаев [25]. В свою очередь, работы Blum S. et al. [26] и Piriyev E. et al. [27] также показали относительно редкую встречаемость изолированных ЭК – в 3,7 и 2,3% соответственно. Учитывая, что каждая 2-я пациентка с ЭК не предъявляла характерных жалоб на приеме у гинеколога, встает вопрос о целесообразности оценки коморбидности как достаточно информативного подхода к выделению группы риска по наличию НГЭ, что было показано в ранее проведенном нами исследовании [28]. Столь частое сочетание нескольких форм эндометриоза является основанием для направления пациенток с ЭК на МРТ с целью уточнения генеза и размеров кисты, а также оценки степени распространенности НГЭ.
Известно, что предшествующее оперативное лечение может быть сопряжено с возникновением более тяжелых форм эндометриоза [21, 22]. Результаты проведенного исследования показали, что у 48,7% пациенток, ранее оперированных по поводу ПЭ и ЭК, и у 85,7% с предшествующим ГЭ в последующем было отмечено прогрессирование или рецидив в ГЭ соответственно. Процент рецидивирования ЭК и ГЭ в ПЭ следует интерпретировать с осторожностью, в частности, ввиду частого сочетания форм (в 59,5% случаев по данным настоящего исследования) и невозможности интраоперационного иссечения всех поверхностных очагов. Ввиду чего в данном случае можно говорить лишь о клиническом рецидиве. Полученные в исследовании результаты согласуются с данными литературы. Nirgianakis K. et al. продемонстрировали, что женщины, ранее оперированные по поводу ЭК, в 46,8% случаев были направлены на повторную резекцию яичников по поводу эндометриом, в 39,5% – на повторную операцию по поводу ГЭ. Пациентки, у которых изначально был ГЭ, имели тенденцию к дальнейшему развитию той же формы НГЭ (53,7%) при следующей операции [29]. Xu B. et al. в своей работе показали увеличение степени распространенности эндометриоза и статистически значимое повышение выраженности болевого синдрома у пациенток с рецидивом ЭК в сравнении с первично оперированными женщинами (p<0,001) [30].
Тенденция к рецидивированию и прогрессированию эндометриоза указывает на значимость адекватной оценки показаний для оперативного лечения, и, если оно необходимо – послеоперационной длительной супрессивной гормонотерапии. Результаты настоящего исследования продемонстрировали, что после оперативного лечения треть пациенток не получали супрессивной гормонотерапии, а в 56,8% случаев она назначалась на 3–6 месяцев. Это, вероятно, является следствием низкой информированности врачей о возможности длительной медикаментозной терапии эндометриоза. Кроме того, на сегодняшний день отсутствуют исследования безопасности использования прогестагенов, в частности – диеногеста, продолжительностью более 7 лет [31]. Частота рецидивов после отмены 6-месячных курсов терапии составила 92%, ввиду чего назначение коротких курсов гормонотерапии, независимо от ее вида, не следует рассматривать в качестве вторичной профилактики НГЭ.
Подводя итоги вышесказанного, вопрос о тактике ведения пациенток молодого возраста с диагностированным эндометриозом и отсутствием показаний для операции требует дополнительных исследований по оценке эффективности и безопасности гормонотерапии в течение всего репродуктивного периода, а также поиска новых препаратов для консервативной терапии НГЭ.
Заключение
Таким образом, остается достаточное количество нерешенных вопросов, касающихся диагностики и терапии различных форм эндометриоза. Ввиду того, что у каждой 3-й пациентки отсутствуют характерные для эндометриоза жалобы при первичном обращении к врачу, целесообразно проводить прицельный опрос и сбор анамнеза. Такой подход может позволить заподозрить эндометриоз уже на первом амбулаторном приеме и направить пациентку на дообследование с применением визуальных методов диагностики, с последующим своевременным назначением терапии. Это особенно важно ввиду того, что тяжелые формы НГЭ, такие как ГЭ, в каждом 3-м случае манифестируют в возрасте до 25 лет. Кроме того, нельзя не учитывать тенденцию эндометриоза к рецидивированию и прогрессированию в более тяжелые формы после предшествующего оперативного лечения; однако короткие курсы супрессивной гормонотерапии, независимо от ее вида, не являются эффективными. Ввиду чего целесообразно продолжение исследований, направленных на изучение эффективности и безопасности длительного приема гормонотерапии и поиск новых консервативных подходов в лечении эндометриоза.



