Последние десятилетия отмечен быстрый рост заболеваемости гестационным сахарным диабетом (ГСД), что, по данным многочисленных исследований, в том числе многоцентрового исследования HAPO, частично объясняет и значительный рост частоты развития преэклампсии (ПЭ) – 2,6% при ГСД против 1,2% популяционных [1–3]. Оба осложнения беременности являются социально значимыми и приводят к высокой материнской и перинатальной заболеваемости и смертности. В то же время, причины повышенной частоты развития ПЭ при ГСД остаются неясными, так же, как и единство патогенеза –сомнительным. В многоцентровом многотысячном исследовании HAPO доказана тесная связь между степенью гиперинсулинемии (оцененной по уровню С-пептида сыворотки крови натощак) и ПЭ [4].
С-пептид соединяет α и β цепи молекулы проинсулина и секретируется в портальный кровоток в эквимолярных концентрациях с инсулином. Многие годы С-пептид считался побочным инертным продуктом синтеза инсулина и длительное время (до 1990-х) использовался исключительно, как маркер функции β-клеток поджелудочной железы. Пристальное внимание к изучению действия С-пептида появилось после открытия его самостоятельных от инсулина разнообразных биологических функций в организме. Обнаружение собственных участков связывания на мембранах (G-связанного рецептора) подтверждает возможность самостоятельной биологической активности С-пептида. Последовавшие исследования выявили провоспалительное атерогенное действие высоких концентраций С-пептида (более 3,1 нг/мл) в эксперименте. [5–10]
Известно, что после перенесенных, как ГСД, так и ПЭ, повышен риск развития сахарного диабета 2 типа и сердечно-сосудистых заболеваний. Так, при ПЭ повышается артериальная жесткость, которая может быть измерена, в том числе, осциллометрическим методом. Данный метод позволяет измерить ряд параметров упруго-эластических свойств плечевой артерии посредством оценки пульсовой волны. Литературные данные относительно влияния ГСД на данный показатель остаются противоречивыми. Не достаточно исследований, оценивающих вклад сочетания ГСД и ПЭ во время беременности в степень изменения эластических свойств периферических артерий, а, значит, и в кардиоваскулярный прогноз [11, 12]. Попытка оценить взаимосвязь артериальной жесткости с уровнем С-пептида при сочетании ГСД и ПЭ во время беременности позволит расширить представление об особенностях развития ПЭ при ГСД.
Цель исследования: оценить взаимосвязь между уровнем С-пептида, степенью выраженности артериальной жесткости и наличием ожирения при ПЭ и ГСД.
Материал и методы
В исследование включено 114 пациенток после 24 недель беременности (37,1±2,8 нед.) в возрасте от 20 до 40 лет с одноплодной беременностью после подписания добровольного информированного согласия, одобренного этическим комитетом ФГБУ «СЗФМИЦ им. В.А. Алмазова» МЗ России. Группы обследования составили: группа 1 (n=22) – женщины с ГСД и ПЭ; группа 2 (n=23) – пациентки с ПЭ; группа 3 – с ГСД (n=36); группа 4 – контрольная (n=33). ПЭ верифицировалась, как впервые возникшая гипертензия после 20 недель беременности с протеинурией не менее 0,3 г/л в суточной порции мочи, ГСД выставлен на основании критериев российского национального консенсуса от 2013 г. Наблюдение, лечение и родоразрешение пациенток осуществлялось согласно Протоколам ведения беременных с ГСД, ПЭ ФГБУ «НМИЦ им. В.А. Алмазова» МЗ России. Лечение ПЭ включало: гипотензивную, магнезиальную терапию, сохранение объема циркулирующей крови, электролитного, белкового баланса, нормализацию реологических и коагуляционных свойств крови. Тяжесть течения ПЭ оценена в соответствии со шкалой тяжести ПЭ, приведенной в протоколах Института перинатологии и педиатрии ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, основанных на Российских рекомендациях «Диагностика и лечение сердечно-сосудистых заболеваний при беременности» (табл. 1).
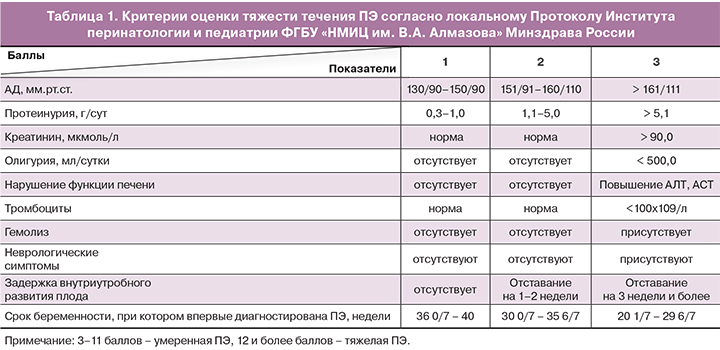
Тяжелая ПЭ выявлена статистически достоверно чаще в группе 2 (11/23) по сравнению с группой 1 (1/22). Частота ранней ПЭ (до 34 недель) статистически значимо не отличалась (p=0,82) между группами 1 (59,09%, n=13) и 2 (65,57%, n=16). Контроль гликемии у пациенток с ГСД осуществлялся с помощью диетотерапии, у некоторых – с помощью инсулинотерапии (18,1% пациенток группы 1, 4/22; 58,3% пациенток группы 3, 21/36). Применялись базисный и базис-болюсный режимы инсулинотерапии.
Критерии невключения в группы исследования: анамнез гипертензии до беременности, анемия средней и тяжелой степени, указания на системные заболевания соединительной ткани в анамнезе или в настоящее время, антифосфолипидный синдром клинически, анамнестически; указания на гломерулонефрит, заболевания надпочечников, заболевания сердца (в том числе гемодинамически значимые пороки сердца, миокардит), онкологические заболевания в анамнезе или в настоящее время; заболевания с некомпенсированным гипо- или гипертиреозом; трансплантация органов в анамнезе; антиретровирусная терапия; наркозависимость; хромосомные патологии развития плода; системный прием кортикостероидов и длительный прием нестероидных противовоспалительных средств; другие тяжелые соматические заболевания; беременность, наступившая при помощи вспомогательных репродуктивных технологий.
Использована стандартная методика расчета индекса массы тела (ИМТ) и критерии для диагностики ожирения (ИМТ=масса (кг)/рост (м2); ИМТ≥30). С помощью иммунохемилюминисцентного анализа (иммунохимический анализатор Elecsys (Roche, Switzerland)) определен уровень С-пептида сыворотки крови натощак. Оценка артериальной жесткости плечевой артерии в положении сидя после 5-минутного отдыха произведена с помощью осциллометрического метода (суточный монитор артериального давления BPLab с программным обеспечением «Vasotens», «Петр Телегин», 2011г.). Артериальная жесткость выражена в индексе аугментации (ИА, индекс усиления отраженной волны), приведенному к частоте сердечных сокращений =75 уд./мин.
Для выявления связей между исследуемыми факторами использованы корреляционный и дисперсионные однофакторный и трехфакторный анализы (Factorial ANOVA). Данные проверены на нормальность с использованием тестов Колмогорова-Смирнова и Лильефорса. Перед включением в анализ значения признаков C-пептида и ИМТ были прологарифмированы. При построении прогностического решающего правила для выделения пациенток с ПЭ по уровню С-пептида и артериальной жесткости использована эмпирическая ROC-кривая. Чувствительность, отношение шансов и другие характеристики этого правила оценивались на основе матрицы классификации. Все статистические расчеты произведены с помощью программы STATISTICA 10.0 (StatSoft, Inc.).
Результаты исследования
По данным нашего исследования, уровень С-пептида сыворотки крови натощак статистически значимо различался между группами (p=0,001). Наибольшее среднее значение логарифма С-пептида зарегистрировано в группе 1 (табл. 2). По результатам post-hoc анализа (тест Шеффе) статистически значимые различия выявлены между 1 и 3 (p=0,004), 1 и 4 группами (p=0,02). Отсутствие различий в уровне логарифма С-пептида между группой 3 и 4, вероятно, связано с компенсированным течением ГСД на момент обследования беременных.
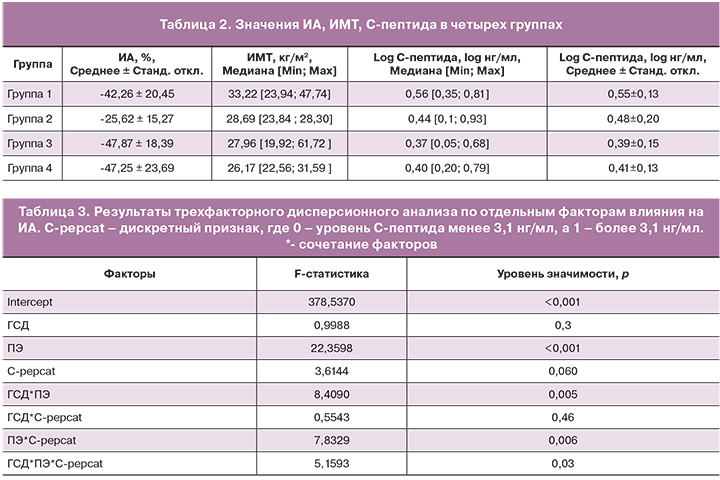
ИМТ статистически значимо различался между группами (p<0,001; таблица 1), частота ожирения в группах составила: 1 – 72,7%; 2 – 43,5%; 3 – 33, 3%; 4 – 12,1%. При этом ожирение III степени диагностировано в 16,67% – в 1 группе, в 2,8% – в 3 группе; II степени: в 11,11% случаев – в группе 1, в 36,4% – в группе 2, в 16,67% случаев – в 3 группе; I степени: у 72,22% и у 63,6% в 1 и 2 группах, соответственно, в 27,78% случаев – в 3 группе и в 12,1% случаев группы контроля (p<0,0001).
Для анализа ассоциаций между изучаемыми признаками использован трехфакторный дисперсионный анализ. Выявлена прямая положительная и независимая ассоциация между ИМТ и развитием ГСД, ИМТ и развитием ПЭ. Установлено, что ИМТ статистически значимо не связан (p=0,45) с развитием обоих осложнений совместно (ГСД+ПЭ). По данным исследования, ПЭ (p=0,04) и ожирение (p<0,001) имеют прямую и независимую ассоциацию с уровнем С-пептида; напротив ГСД никак не влияет на связь ПЭ и уровня С-пептида.
При анализе результатов измерения артериальной жесткости обнаружено, что ИА статистически значимо отличался между группами (p=0,002), наибольшее среднее значение обнаружено в группе 2 (табл. 2). При этом, согласно данным post-hoc анализа (тест Шеффе) значимыми явились отличия ИА между 2 и 3 (p=0,003), 2 и 4 группами (p=0,0095).
С помощью дисперсионного анализа обнаружена положительная ассоциация уровня ИА с ПЭ (p<0,001), ПЭ и высокого уровня (более 3,1 нг/мл) С-пептида (p=0,006), а также отрицательная связь с сочетанием факторов ГСД и ПЭ (p=0,004) (табл. 3). По данным анализа, артериальная жесткость ниже при сочетании факторов ГСД, ПЭ и высокого С-пептида, чем без ГСД, что, предположительно, связано с разностью в тяжести течения ПЭ между группами и, возможно, патогенезом, что требует дальнейшего исследования. При этом ИА статистически значимо не коррелирует с ИМТ (r=-0,01; p=0,9).
При анализе результатов трехфакторного дисперсионного анализа (табл. 3) влияние C-пептида на ИА оказывается статистически не значимым, но статистически значимо проявляется вместе с ПЭ. Причина такого «поведения» С-пептида заключается в разноплановом проявлении связи ПЭ с показателем ИА у пациенток с уровнем С-пептида, превышающем и не превышающим порог 3,1 нг/мл.
Этот эффект хорошо иллюстрируют диаграммы на рисунках 1–3. На рисунке 1 представлены доверительные интервалы для среднего значения ИА в группах пациенток с ПЭ и без нее. При превышении порога 3,1 нг/мл уровня С-пептида (0,49 – десятичный логарифм уровня С-пептида) проявляется большая статистически значимая разница между группами, а при меньших значениях уровня С-пептида группы неразличимы (рис. 1, 2). На рисунке 3 хорошо виден промежуток между двумя модами на гистограмме уровня C-пептида (сверху), соответствующий порогу 3,1 нг/мл. Также заметна разница в характере рассеяния слева и справа от штриховой линии. Справа плотность рассеяния меньше, чем слева, что также демонстрирует значимые различия пациенток с разным уровнем С-пептида.

В рамках данного исследования оценена значимость ИА и высокого С-пептида совместно по отношению к ПЭ. В выделенной группе пациенток с уровнем С-пептида более 3,1 нг/мл, был определен порог ИА = -45% в отношении наличия ПЭ на основе эмпирической ROC-кривой. Для полученного решающего правила чувствительность Sen=0,92, специфичность Spe=0,59, отношение шансов OR=17,14, доверительный интервал для отношения шансов CI95% = [1,80; 163,8]. По данным анализа, использование пороговых значений С-пептида и ИА может позволить с высокой точностью выявить больных с ПЭ, а учитывая данные литературы относительно прогностической ценности изучаемых маркеров – и группу высокого риска до манифестации симптомов. Для выявления связей с ПЭ у пациенток с уровнем С-пептида менее 3,1 нг/мл необходимы дальнейшие исследования [2, 4].
Обсуждение
Полученные нами данные продолжают дискуссию относительно общности происхождения ГСД и ПЭ, вклада ожирения в данную связь. Факторами риска, как для ГСД, так и для ПЭ, традиционно считают ожирение и инсулинорезистентность. Единства мнений о связи между ГСД и ПЭ в литературе нет. По результатам Шнайдер С. и соавт. (2012), Хаузер М. и соавт. (2011), ГСД сам по себе является независимым фактором риска развития ПЭ, и степень ожирения не влияет на данную взаимосвязь. Остлунд И. и соавт. (2004) заключают, что ожирение ‒ главный вмешивающийся фактор в данных взаимоотношениях, который, тем не менее, не может объяснить всю степень риска развития ПЭ при ГСД [13–15]. По данным нашего исследования, ожирение является фактором риска развития, как ГСД, так и ПЭ, но не связано с развитием обоих осложнений совместно.
Согласно современным исследованиям (Framingham heart study, 2010), сосудистая жесткость ‒ это один из факторов, определяющих прогноз по сердечно-сосудистой заболеваемости [11]. Наши данные о связи ИА с ПЭ и сочетанием ГСД и ПЭ дополняют имеющиеся результаты исследований. Найдены исследования, касающиеся значения ИА как предиктора ПЭ, а также верификации диагноза с помощью ИА. Кроме того, по некоторым данным патологические изменения ИА при ПЭ сохраняются и в послеродовом периоде, что говорит о значении показателя в отдаленной сердечно-сосудистой заболеваемости. Однако сведений, касающихся особенностей артериальной жесткости при ГСД, а также при сочетании ГСД и ПЭ, в доступной нам литературе недостаточно. Обнаружено одно исследование Phan K и соавт. (2015) с очень маленькой выборкой, где сочетанный исход (ГСД+ПЭ) связан с повышенной артериальной жесткостью, по сравнению с изолированным осложнением беременности, что противоречит полученным нами данным [11, 12, 16, 17].
Литературные данные, посвященные классическому пониманию связи инсулинорезистентности и гиперинсулинемии с сосудистой жесткостью и артериальным давлением, а также с исходом в первичную гипертензию вне беременности значительно разнятся. Согласно данным одних авторов, роль инсулина в раннем развитии гипертензии невелика, и эффекты уровней инсулина на величину артериального давления минимальны; что, однако, опровергнуто данными крупного мета-анализа: гиперинсулинемия и инсулинорезистентность ассоциированы с повышенным риском гипертензии в общей популяции. Другие авторы отмечают, что уровень инсулина и инсулинорезистентность связаны с жесткостью сонной артерии у пациентов среднего возраста с гипертензией и без диабета. Кроме того, известны результаты экспериментальной работы: продолжительное введение инсулина в почечную артерию крыс приводит к стойкому повышению артериального давления. Согласно данным новейшего исследования, метформин при применении в 32–34 недели способен снижать артериальную жесткость у пациенток с ГСД, однако авторы отмечают необходимость дальнейшего изучения данного вопроса. Тем не менее, авторы едины во мнении, что механизм связи гиперинсулинемии с гипертензией недостаточно ясен и требует изучения [18–25]. Вероятно, новые обнаруженные биологические свойства С-пептида могли бы служить «ключом» к разгадке.
Согласно использованным статистическим методам анализа результатов основные оцениваемые параметры (уровень С-пептида, ИА, ИМТ) значимо отличались между группами, что свидетельствует в пользу правомерного деления на группы обследованных беременных, а также о различиях патогенеза изучаемых осложнений беременности. По данным проведенного анализа, ожирение и высокий уровень С-пептида являются независимыми факторами риска развития ПЭ, что согласуется с некоторыми данными литературы. Несмотря на то, что ожирение тесно связано с развитием ГСД, хотя и не может объяснить всех рисков его развития, ИМТ не связан с развитием сочетанных осложнений беременности – ГСД и ПЭ, по данным исследования.
Ценность признанного маркера преэклампсии, отражающего эластические свойства сосудов – ИА, подтверждена в нашем исследовании. Учитывая, что, согласно обширному исследованию Framingham Heart Study, артериальная жесткость признана фактором риска развития кардиоваскулярных событий, считаем возможным предложить данный показатель в сочетании с уровнем С-пептида для изучения их ценности в отношении прогноза сердечно-сосудистой заболеваемости после перенесенной ПЭ. Результаты исследования впервые показали высокую ценность совместного использования пороговых значений С-пептида и ИА в качестве маркера ПЭ. Отдельно следует отметить, что ИА значимо ниже при сочетании ГСД и ПЭ, чем при изолированной ПЭ, что, вероятно, отражает разность патогенеза ПЭ в указанных условиях, а также степень повреждения упруго-эластических свойств сосудов. Особенно значимо то, что ИА не связан с ожирением, что делает его независимым и универсальным показателем, пригодным для дальнейшего изучения.
Заключение
Настоящее исследование продемонстрировало наличие независимой ассоциации уровня С-пептида с ожирением и ПЭ. Прослеживается два независимых пути повышения уровня С-пептида – один связан с ожирением, другой, вероятно – с инсулинорезистентностью без ожирения. Несмотря на выявленные ассоциации ожирения и ГСД, ожирения и ПЭ, не обнаружено связи высокого уровня С-пептида с сочетанием данных осложнений беременности. Полученные данные не подтверждают предположение о наличии единого триггера в развитии ПЭ и ГСД.
Результаты исследования также косвенно указывают на разность патогенеза изолированной ПЭ и ПЭ в сочетании с ГСД. Сочетание изучаемых осложнений беременности не приводит к снижению упруго-эластических свойств артерий, по сравнению с изолированным ГСД или ПЭ.
Обнаруженная высокая взаимосвязь между наличием ПЭ, уровнем С-пептида более 3,1 нг/мл и ИА выше -45% в сочетании с данными литературы позволяет рассматривать данные показатели не только, как предикторы ПЭ, но и как возможные маркеры отдаленной сердечно-сосудистой заболеваемости после ПЭ, перспективные для дальнейшего изучения, как вероятный патогенетический путь повреждающего действия гиперинсулинемии.



