В последние несколько десятилетий во всем мире наблюдается повышение частоты обнаружения гормонозависимых опухолей. Среди таких патологий репродуктивной системы лидирующее положение занимает миома матки (ММ).
Лейомиома матки – доброкачественная моноклональная, хорошо отграниченная, капсулированная опухоль, происходящая из гладкомышечных клеток шейки или тела матки, частота которой среди женщин репродуктивного возраста варьирует от 30 до 70% [1, 2].
Несмотря на доброкачественность процесса, симптоматика данного заболевания достаточно многообразна: дисфункция тазовых органов, аномальные маточные кровотечения, анемия, болевой синдром. Данные симптомы и определяют высокую частоту оперативных вмешательств по поводу ММ в гинекологических стационарах, особенно высока доля гистерэктомий у женщин репродуктивного возраста в связи с наличием данной опухоли [1, 3]. Развитие ММ может также стать причиной бесплодия, осложнять течение беременности, вызывая проблемы не только при вынашивании, но и в родах [4].
Упомянутые выше факты делают данное заболевание одной из важнейших социально значимых проблем репродуктивной системы женщин и определяют актуальность изучения патогенеза ММ, оптимизации диагностики, тактики ведения пациенток и прогнозирования риска рецидивирования данного заболевания.
Этиопатогенетические механизмы развития ММ до настоящего времени остаются дискуссионными и недостаточно изученными. Однако имеются сведения, согласно которым развитию ММ могут способствовать репродуктивный возраст, этническое происхождение (например, среди жительниц США миомы чаще встречаются у женщин афроамериканского происхождения), семейный анамнез, повышенный индекс массы тела (ИМТ) [5], стрессы, патологические процессы в иммунной системе, беременность, гормональный статус, а также генетические механизмы [5–7].
Наличие «семейных форм» данного заболевания у 5–10% женщин с ММ [6] свидетельствует о ключевой роли генетических механизмов в патогенезе данного заболевания.
Поиски генетических маркеров развития ММ активно ведутся на протяжении последних нескольких лет. Наиболее значимым открытием в этой области оказалось описание соматических мутаций в гене MED12, который кодирует одну из субъединиц медиаторного комплекса РНК-полимеразы II.
После публикации в 2015 г. группой авторов исследования [8], согласно которому встраивание в геном мышей мутантного аллеля гена MED12 ведет к развитию ММ, по всему миру начали активно исследовать данный ген у женщин с ММ в зависимости от локализации узлов, их размеров, количества [9, 10].
В предыдущем нашем исследовании мы выявили, что в общей популяции российских женщин в 50% образцов миоматозных узлов обнаруживались соматические мутации в экзоне 2 гена MED12 [11].
Дальнейшее изучение соматических мутаций в гене MED12 позволило нам обнаружить взаимосвязь между наличием мутаций в изучаемом гене и отягощенным анамнезом. Согласно полученным нами данным, в 61% узлов, полученных от женщин с отягощенным анамнезом, были обнаружены соматические мутации в экзоне 2 гена MED12 против 48% в группе женщин без отягощенного анамнеза (р=0,109) [12]. Также в ходе проведения исследования мы описали несколько уникальных соматических мутаций, которые ранее в источниках литературы и базах данных не упоминались.
Создание панелей генетических маркеров до сих пор остается одним из самых наукоемких направлений в репродуктивной генетике. Применение таких панелей может способствовать оптимизации тактики ведения, ранней диагностики, прогнозирования рисков рецидивирования ряда распространенных гинекологических заболеваний.
Цель исследования – выявить ассоциации полиморфизмов генов rs3020434, rs11742635, rs124577644, rs12637801, rs2861221, rs17677069 с отягощенностью анамнеза пациенток по ММ с дальнейшим выделением группы генов, способствующих развитию миомы, и «протективных» генов, препятствующих развитию данного заболевания.
Материалы и методы
В 2017–2018 гг. в отделении оперативной гинекологии ФГБУ «НМИЦ АГП им. В.И. Кулакова» были собраны образцы тканей 329 миом и аликвоты крови от 106 пациенток (от 1 до 5 миоматозных узлов от каждой), а также 24 аликвоты крови от пациенток для группы контроля.
Всем пациенткам проведено полное клинико-анамнестическое обследование: сбор анамнеза, общий и гинекологический осмотр, ультразвуковое исследование (УЗИ) органов малого таза, клинико-лабораторное обследование. Эндоскопическую операцию проводили по стандартизированной методике с помощью эндовидеохирургического оборудования фирмы KarlStorz (Германия). Сбор образцов тканей миом производили непосредственно во время операций по миомэктомии (МЭ) или гистероэктомии (ГЭ) в зависимости от размера и количества узлов. Фрагменты тканей помещали в физиологический раствор, отправляли в биобанк ФГБУ «НМИЦ АГП им. В.И. Кулакова» и замораживали на –70 °С для последующего хранения в коллекции. Образцы каждого узла также подвергали гистологическому исследованию с целью подтверждения наличия исключительно ткани миоматозного узла в образце и отсутствия в нем ткани капсулы или миометрия.
Для 20 пациенток с отягощенным семейным анамнезом и наличием соматических мутаций в гене MED12 (подгруппа Pat) и 14 пациенток контрольной группы (подгруппа Con) был проведен микроматричный анализ на чипах SNP 6.0 (Affymetrix, США), позволивший провести генотипирование образцов по 906 600 однонуклеотидным полиморфизмам (rs), распределенным по всему геному, и выявить наиболее значимые из них при помощи статистического анализа.
Выбранные «кандидатные» rs, наиболее статистически значимые, были проверены на всей выборке (130 пациенток) путем генотипирования методом секвенирования по Сэнгеру с дальнейшим сравнением частот аллелей по группам исследования.
В исследовании принимали участие 130 пациенток, разделенных на 4 группы: 1-я группа – пациентки группы контроля, женщины в постменопаузе, не имевшие в анамнезе ММ (24 пациентки), 2-я группа – женщины с отягощенным анамнезом, у которых миома была диагностирована у ближайших родственниц по материнской линии (мама, бабушка, сестра, тетя) – 51 пациентка, 3-я группа – женщины без отягощенного анамнеза по ММ (сведения об отягощенности анамнеза получены нами в ходе беседы с пациентками) – 36 пациенток, 4-я группа – пациентки, не имевшие информации об анамнезе по ММ – 19 пациенток.
Для выявления наиболее статистически значимых из потенциальных 906 600 rs использовали результаты генотипирования 34 образцов (подгруппы Pat и Con), которые могут быть интерпретированы и представлены в виде определенных вариантов аллелей для каждого образца и для каждого из исследуемых rs. Соответственно, рассматривая все образцы, можно посчитать встречаемость аллелей и генотипов на исследуемой выборке отдельно для группы контроля (Con) и для группы больных (Pat).
Таким образом, для каждого rs были определены 2 аллеля: A – референсный (мажорный) и B – альтернативный (минорный) и соответствующая им количественная встречаемость в подгруппах: PatA, PatB, ConA, ConB. Также были определены возможные генотипы: гомозиготные AA, BB и гетерозиготный AB и их количественная встречаемость в подгруппах: PatAA, PatBB, PatAB, ConAA, ConBB, ConAB.
Для определения значимости rs использовали точный критерий Фишера, который применялся независимо 4 раза для оценки статистической значимости следующих факторов: встречаемость аллелей A и B в подгруппе (test1), встречаемость генотипа AA в подгруппе (test2), встречаемость генотипа AB в подгруппе (test3), встречаемость генотипа AB в подгруппе (test4). Таблицы сопряженности приведены в табл. 1.
По завершении расчетов критерия Фишера было получено по 4 оценки значимости p-value для каждого rs: значимости аллелей и генотипов.
На этапе фильтрации и выделения значимых rs учитывались также популяционные данные. Из базы данных dbSNP выгружалась информация о частоте встречаемости аллелей по исследуемым rs как для европейской (EUR), так и для ряда других популяций (восточноазиатская EAS, южноазиатская SAS, американская AMR и африканская AFR).
Еще одним ограничением, участвующем в фильтрации rs, послужила координатная близость на геноме: из окрестности 1000 bp мог быть выделен не более 1 rs – необходимая мера для фильтрации предполагаемых сцепленных полиморфизмов.
Так, при выделении наиболее интересных, «кандидатных» для дальнейшего рассмотрения rs, учитывались следующие признаки: p-value 4 тестов Фишера, встречаемость в европейской популяции, координатная близость на геноме.
В итоге для дальнейшей проверки на всей выборке было выделено 6 «кандидатных» полиморфизмов: rs3020434, rs11742635, rs124577644, rs12637801, rs2861221, rs17677069, расположенных в генах ESR1, FBN2, CELF4, KCWMB2, частоты которых статистически значимо различались между группами. Затем по данным локусам была прогенотипирована вся выборка пациенток с миомами, с дальнейшим сравнением частот аллелей по группам исследования.
На втором этапе работы кандидатные rs были проанализированы на расширенной выборке пациенток с миомами, разделенных на группы в соответствии с анамнезом. Статистический анализ проводился с помощью точного теста Фишера (при ожидаемых значениях в таблице сопряженности менее или равно 5) либо с помощью критерия χ2 Пирсона (в остальных случаях).
Для проведения статистического анализа данных использовались следующие программные продукты: Microsoft Excel 2013, библиотеки SciPy, Pandas для языка программирования Python 2.7.
Результаты
Статистический анализ данных генотипирования с помощью микроматричного исследования 20 пациенток с отягощенным семейным анамнезом и наличием соматических мутаций в гене MED12 и 14 пациенток контрольной группы (подгруппы Pat и Con) позволил выделить 6 полиморфизмов rs3020434, rs11742635, rs124577644, rs12637801, rs2861221, rs17677069, расположенных в генах ESR1, FBN2, CELF4, KCWMB2, частоты которых статистически отличались у женщин с отягощенным анамнезом по ММ по сравнению с группой контроля (табл. 2).

Частоты данных полиморфизмов были сопоставлены с общепопуляционными показателями (табл. 3). Нами были выбраны редко встречающиеся аллельные варианты, которые могли бы в дальнейшем послужить предикторами риска развития миомы матки.
Все 6 полиморфизмов характеризовались повышенной встречаемостью редкого аллеля в контрольной группе и пониженной – в группе пациенток с ММ.
Дальнейшая работа была посвящена генотипированию более обширной выборки пациенток с целью выявления ассоциации между представленностью аллелей и отягощенностью анамнеза женщин по ММ.
Для каждого полиморфизма мы определяли частоты по аллелям в каждой исследуемой группе: группе контроля, в группе женщин с отягощенным анамнезом, без отягощенного анамнеза, в группе женщин, не имеющих точной информации об анамнезе по ММ, а также сравнили данные группы со всей популяцией и с общей группой женщин, имеющих ММ.
Гомозиготный вариант ТТ полиморфизма rs3020434 – ESR1 (табл. 4, рис. 1) отсутствует у пациенток с отягощенным анамнезом по ММ, а среди всех пациенток с данным заболеванием он встречается с частотой 5%, следовательно, данный вариант аллеля может являться «протективным», при этом гомозиготный вариант СС встречается в группе с отягощенным анамнезом с наибольшей частотой – 73%. Данный аллель может быть связан с повышенным риском развития ММ.

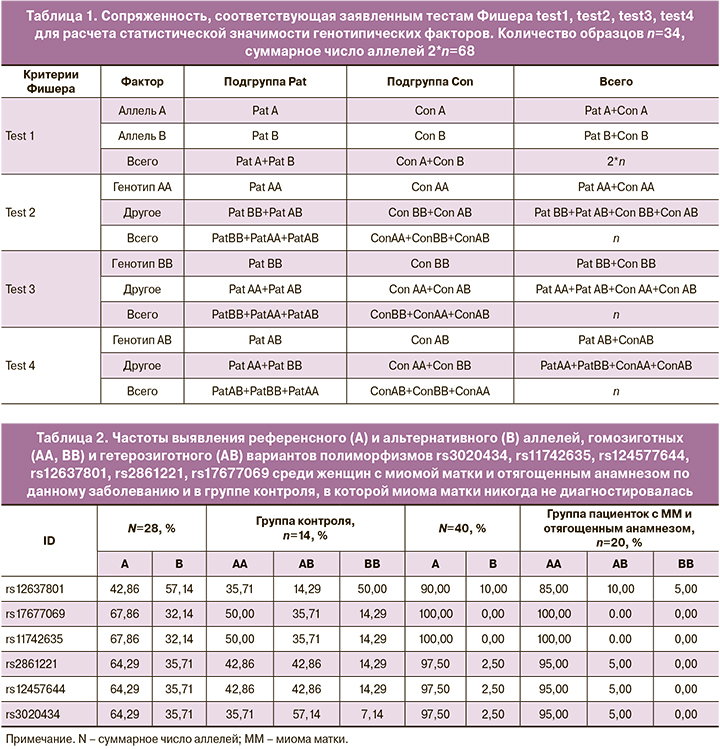
Гомозиготный вариант ТТ полиморфизма rs11742635 – FBN2 (табл. 5, рис. 2) отсутствует у пациенток с отягощенным анамнезом по ММ, а у всех пациенток с ММ частота ее встречаемости составляет 3%, следовательно, данный вариант аллеля может являться «протективным». Гомозиготный вариант GG в группе с отягощенным анамнезом встречается с наибольшей частотой – 82%, следовательно, данный вариант – аллель риска.
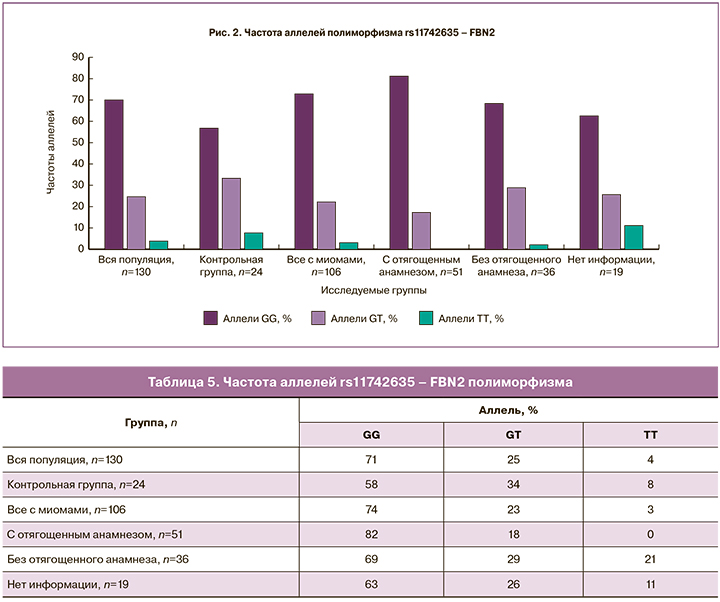
Гомозиготный вариант АА полиморфизма rs124577644 – СELF4 (табл. 6, рис. 3) встречается с наименьшей частотой – 6% у пациенток с отягощенным анамнезом по ММ по сравнению с другими группами, следовательно, данный вариант аллеля может являться «протективным», при этом гомозиготный вариант GG встречается в этой группе с наибольшей частотой – 78%, то есть может являться «аллелем риска».
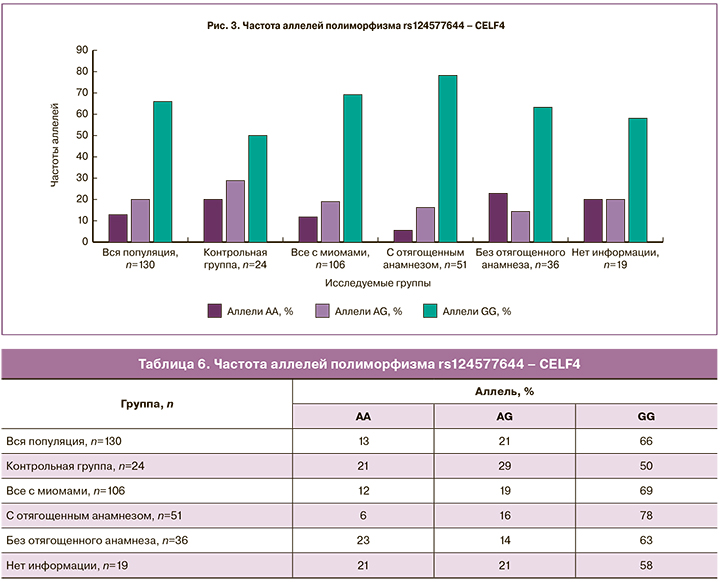
Гомозиготный вариант CC полиморфизма rs12637801 – KCWMB2 (табл. 7, рис. 4) встречается с наибольшей частотой (84%) у пациенток с отягощенным анамнезом по ММ по сравнению с другими группами, следовательно, данный вариант аллеля может являться фактором риска развития миомы матки.
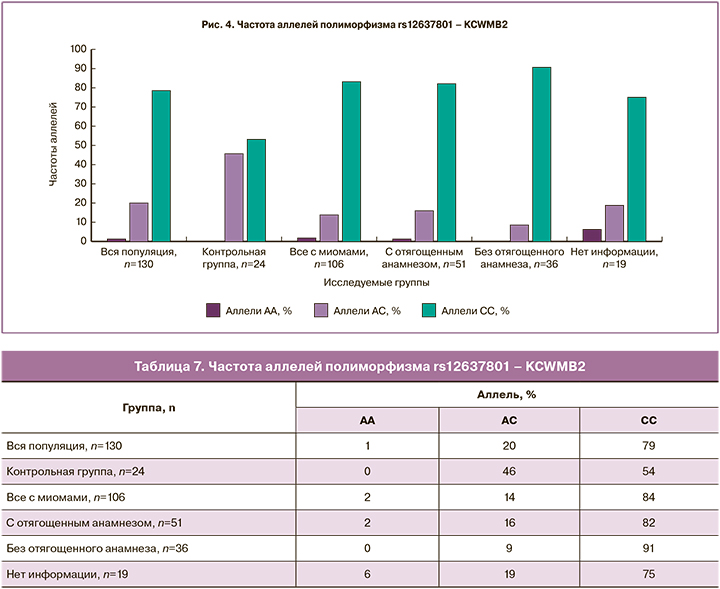
Гомозиготный вариант GG полиморфизма rs2861221 – СELF4 (табл. 8, рис. 5) не встречается в группе пациенток с отягощенным анамнезом по ММ по сравнению с другими группами, следовательно, данный вариант аллеля может являться «протективным», при этом гомозиготный вариант CC встречается в этой группе с наибольшей частотой – 82%, что свидетельствует о возможной роли данного аллеля как фактора риска.
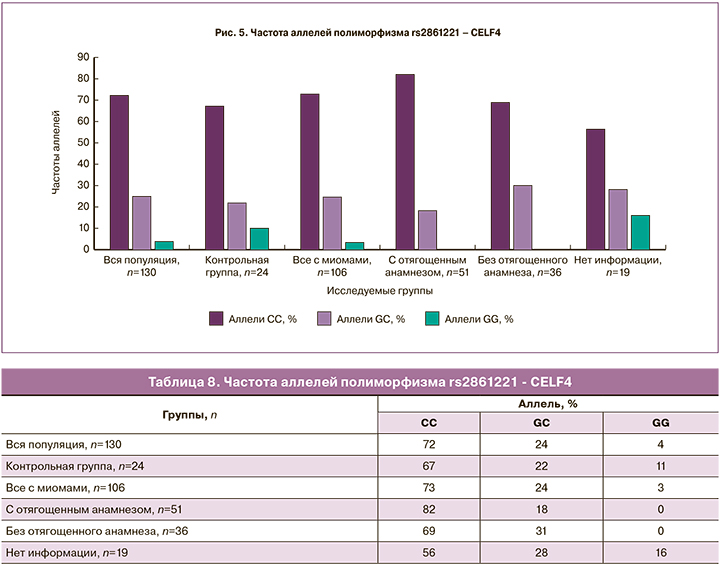
Гомозиготный вариант GG полиморфизма rs17677069 – FBN2 (табл. 9, рис. 6) не встречается в группе пациенток с отягощенным анамнезом по ММ по сравнению с другими группами, а в группе женщин с ММ, в которую вошли все пациентки, независимо от анамнеза, частота GG составила 2%, следовательно, данный вариант аллеля может являться «протективным», при этом гомозиготный вариант АА в группе с отягощенным анамнезом встречается с наибольшей частотой – 82%, следовательно, такой генотип может являться фактором, увеличивающим риск развития ММ.

В случае 4 полиморфизмов rs3020434, rs11742635, rs2861221 и rs17677069 в группе женщин с отягощенным анамнезом полностью отсутствует один из редких аллелей, гомозиготный вариант, что статистически отличает данную группу от остальных. Учитывая указанный выше факт, мы можем предполагать «протективную» роль редкого аллеля в патогенезе ММ, в частности, для «семейных форм» данного заболевания. Однако более высокая частота обнаружения второго гомозиготного варианта аллелей данных полиморфизмов, наоборот, может свидетельствовать о роли частых вариантов полиморфизма в патогенезе ММ. Данное предположение может быть также подтверждено тем, что 2 полиморфизма из обнаруженных, rs11742635 и rs17677069, являются сцепленными, т.е. располагаются в одном гене, который может быть прямо или опосредованно вовлечен в патологический процесс.
Статистический анализ данных, полученных при сравнении группы контроля с группой, в которую вошли все пациентки с миомой матки, вне зависимости от анамнеза, выявил высокую статистическую значимость в случае 4 из 6 исследованных локусов (табл. 10).

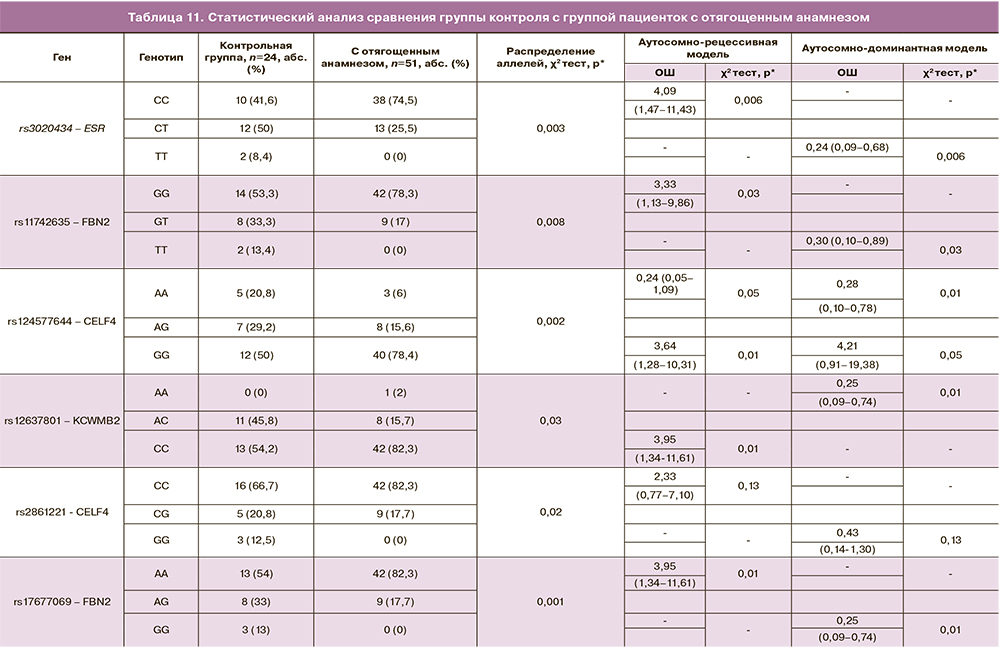
Сравнение группы контроля с группой пациенток с отягощенным анамнезом, в которой выборка в 2 раза меньше по сравнению с общей группой женщин, имеющих ММ, выявило статистически значимую разницу в частоте выявления «протективных» вариантов полиморфизмов и аллелей рисков развития миомы матки, что подтверждает участие обнаруженных полиморфизмов в патогенезе в большей степени «семейных форм» миомы матки (табл. 11).
Обсуждение
В настоящее время активно ведутся поиски генетических маркеров развития различных социально значимых гинекологических заболеваний для создания генетических панелей ранней диагностики, прогнозирования рецидивирования, оптимизации тактики ведения и создания новых таргетных препаратов для лечения данных заболеваний.
В современных геномных базах (Breast Cancer Information Core (BIC) Database, International Cancer Research Partnership (ICRP) Database, Cancer Genomics Hub (CGHub) Database, Online Mendelian Inheritance in Man (OMIM)) имеются данные о генах и их аллельных вариантах, которые могут быть вовлечены в патогенез онкологических заболеваний. К генам-маркерам, ассоциированным со злокачественными новообразованиями женских репродуктивных органов, относят гены BRCA (Breast cancer antigen) – BRCA1 и BRCA2, локализованные соответственно в 17 и 13 соматических хромосомах. В международной базе данных Breast Cancer Information Core (BIC) зарегистрировано 1809 мутаций и полиморфизмов в гене BRCA1 и 2019 – в гене BRCA2.
BRCA1, ответственный за наследственную предрасположенность к раку молочной железы (РМЖ) и раку яичников, состоящий из 22 кодирующих и 2 некодирующих экзонов, разделенных интронами, картирован Miki и соавт. [13] на длинном плече 17 хромосомы (17q21). Wooster и соавт. [14] клонировали второй ген BRCA2, локализованный в 13 хромосоме (13q12) и обусловливающий наследование повышенного риска РМЖ.
Гены BRCA1 и BRCA2 экспрессируются в нормaльных клеткaх и принимaют учаcтие в поддержании cтабильности генома. Герминальные мутации этих генов приводят к возникновению 20–25% всех случаев наследственного РМЖ и 15% случаев рака яичников [15]. Идентифицировано более 1000 мутаций в генaх BRCA1 и BRCA2, многие из которых связаны с повышенным риском развития рака (особенно РМЖ у женщин).
На сегодняшний день существуют различные диагностические панели, основанные на обнаружении различных мутаций в генах, ассоциированных с РМЖ, которые активно внедряются в практику с целью выявления рисков развития данного злокачественного новообразования, прогнозирования метастазирования, а также рецидивирования.
Самая первая панель экспрессии генов, одобренная Food and Drug Administration в феврале 2007 г., представляла собой микрочипы, состоящие из 70 классифицирующих генов, которые в результате многочисленных исследований показали различие в паттернах экспрессии между группами пациентов с высоким или низким риском рецидива в течение 10 лет [16].
Ведутся поиски генетических маркеров и для ряда других гинекологических заболеваний. Метаанализ, проведенный Nilufer Rahmioglu и соавт., продемонстрировал прямую связь шести генетических локусов: rs12700667 на 7p15.2, rs7521902 – WNT4, rs10859871 – VEZT, rs1537377 – CDKN2B-AS1, rs7739264-ID4 и rs13394619 в GREB1 с эндометриозом в популяциях женщин Австралии, Бельгии, Италии, Великобритании, США, а также Японии. При этом пять из шести локусов показали высокую частоту ассоциации с эндометриозом III/IV стадии. Данная ассоциация подчеркивает важность дальнейших исследований в этой области, с целью выявления влияния вариантов аллелей различных генов на патогенез столь распространенного и сложного с точки зрения диагностики и лечения заболевания, как эндометриоз [17].
В НМИЦ акушерства, гинекологии и перинатологии им. В.И.Кулакова было проведено исследование, целью которого также являлся поиск генетических маркеров развития эндометриоза. В ходе данного исследования была выявлена положительная ассоциация гетерозиготного генотипа C/G локуса rs4703908 и риска развития эндометриоидных кист яичников (OШ=1,78; 95% ДИ 0,88–3,62; p>0,05) и глубокого инфильтративного эндометриоза (OШ=2,02; 95% ДИ 0,85–4,73; p>0,05). Также была обнаружена положительная ассоциация C/G локуса rs4703908 и риска развития эндометриоза брюшины малого таза (OШ=1,24; 95% ДИ 0,49–3,16; p>0,05), однако, OШ не превышало 1,5, и отмечена положительная ассоциация гомозиготного генотипа СС локуса rs10859871 и риска развития эндометриоидных кист яичников (OШ=5,61; 95% ДИ 1,8–17,49; р<0,01), глубокого инфильтративного эндометриоза (OШ=5,92; 95% ДИ 1,68–20,83; p<0,01) и эндометриоза брюшины малого таза (OШ=4,44; 95% ДИ 1,15–17,07; p<0,05) по сравнению с условно здоровыми женщинами основной группы сравнения [18].
Впервые «семейные случаи» ММ, а также зависимость данного заболевания от этнического происхождения женщин были показаны в исследовании американских генетиков. Ученым удалось обнаружить геномные ассоциации с развитием ММ при генотипировании 261 женщины европеоидной расы, являющихся членами одной семьи (первая линия родства) [19]. Иммуногистохимическое и генетическое исследования данной группы пациенток выявили аллель риска развития ММ – ген, кодирующий синтазу жирных кислот FASN, который локализуется в участке 17q25.3.
В недавно опубликованной работе Маккинен и соавт. в качестве генетических маркеров развития ММ было предложено еще 27 полиморфизмов в различных геномных локусах, ассоциированных с патогенезом ММ. На очень обширных (десятки тысяч) выборках авторы сравнили частоты rs по двум группам: женщин с ММ и без нее. Гены-кандидаты были разделены также на две категории: участки генома, содержащие характерные опухолевые супрессоры и онкогены, и гены, участвующие в гормональных сигнальных путях, ранее ассоциированных с эндометриозом. Высокая частота полиморфизмов в выявленных генах у женщин с миомой матки, а также общие варианты полиморфизмов этих генов в случае миомы и эндометриоза могут свидетельствовать о схожих молекулярных механизмах развития и общих клетках-предшественницах двух социально значимых гинекологических заболеваний [20].
Полногеномное исследование 457 044 однонуклеотидных полиморфизмов у 1607 женщин с клинически диагностированной ММ и у 1428 женщин из группы контроля было проведено группой японских ученых. SNP, показавшие высокую степень ассоциации (p<5×10-5), были дополнительно генотипированы у 3466 пациенток с ММ и 3245 из группы контроля. В трех локусах на хромосомах 10q24.33, 22q13.1 и 11p15.5 были обнаружены значимые ассоциации с ММ. Наиболее значимыми ассоциациями при комбинированном анализе в каждом из этих локусов были rs7913069 (p=8,65×10–14, ОШ=1,47), rs12484776 (p=2,79×10–12; OШ=1,23) и rs2280543 (p= 3,82×10–12; OШ= 1.39) соответственно, дальнейшее изучение которых, по мнению авторов, смогло бы способствовать выявлению причин развития ММ [21].
В нашей работе было проведено генотипирование образцов по 906 600 однонуклеотидным полиморфизмам пациенток с ММ, с выявленной в анамнезе отягощенностью по данному заболеванию (ММ у родственниц первой линии родства по материнской линии) и контрольной группы, в которую вошли женщины без ММ в анамнезе. В результате генотипирования нам удалось выявить 6 полиморфизмов rs3020434, rs11742635, rs124577644, rs12637801, rs2861221, rs17677069 генов ESR1, FBN2, CELF4, KCWMB2, частоты которых статистически отличались в обеих исследуемых группах по сравнению с остальными однонуклеотидными полиморфизмами, при этом были больше в группе женщин с отягощенным анамнезом по сравнению с группой контроля. Дальнейшее наше исследование рассматривало только указанные выше 6 полиморфизмов, которые, вероятно, связаны с развитием ММ. Возможно, наша тактика исследования полиморфизма генов сможет объяснить механизмы формирования «семейных случаев» ММ и поможет создать генетическую диагностическую панель для данного заболевания.
Заключение
Полученные нами данные позволили выбрать из 906 600 однонуклеотидных полиморфизмов 6 (rs3020434, rs11742635, rs124577644, rs12637801, rs2861221, rs17677069), которые статистически отличались от остальных в исследуемых нами группах, и их частота была выше в группе женщин с отягощенным анамнезом по сравнению с группой контроля. следовательно, они могли иметь большую вероятную ассоциацию с развитием ММ.
Изучение выявленных полиморфизмов у женщин с ММ, имеющих отягощенный анамнез по данному заболеванию, позволило обнаружить статистически значимые различия в частотах аллелей по сравнению с группой контроля и общепопуляционной группой. В частности, редкие аллели полиморфизмов rs3020434, rs11742635, rs2861221 и rs17677069 отсутствовали у пациенток с отягощенным анамнезом, что может свидетельствовать о «протективной» роли данных вариантов аллелей в развитии ММ, в частности «семейных форм» ММ, а высокая частота гомозиготных вариантов аллелей, возможно, свидетельствует об их причастности к развитию ММ.
Дальнейшие исследования выявленных полиморфизмов должны быть направлены на обнаружение возможных молекулярных механизмов развития ММ, что может привести к созданию тест-систем для ранней диагностики, прогнозирования рисков рецидивирования, оптимизации тактики ведения пациенток с ММ с использованием генетических маркеров.



