Эндометриоз – это процесс, при котором за пределами полости матки происходит доброкачественное разрастание ткани, по морфологическим и функциональным свойствам подобной эутопическому эндометрию и так же, как эутопический эндометрий, отвечающей на циклические изменения гормонов яичников [1]. Эндометриоз диагностируется у 10% женщин репродуктивного возраста и 35–50% женщин с тазовой болью и бесплодием. В структуре гинекологической заболеваемости эндометриоз занимает 3-е место после воспалительных заболеваний и миомы матки, приводя к значительным нарушениям репродуктивной функции, стойкому болевому синдрому (71–87%) и бесплодию (21–47%) [1–3].
Причины и механизм развития эндометриоза до настоящего времени не установлены, основные гипотезы связывают развитие этого заболевания с воздействием различных внешних факторов, а также наличием наследственной предрасположенности, или же сочетанием этих причин [4, 5]. Открытыми остаются вопросы этиологии и патогенеза данного заболевания, особенностей клинической картины в зависимости от локализации процесса и тяжести течения заболевания, отсутствуют данные о сравнительной информативности отдельных методов диагностики и выявления рецидивов, а также эффективности различных методов лечения и реабилитации больных [1].
В настоящее время существует множество методов диагностики эндометриоза, однако они обладают довольно низкой специфичностью и позволяют поставить лишь предварительный диагноз, требующий верификации [6]. Единственным методом точной диагностики эндометриоза на сегодняшний день является инвазивное лапароскопическое исследование с прицельной биопсией подозрительных очагов и их последующим гистологическим исследованием [6, 7]. Такие процедуры являются трудоемкими и дорогостоящими, кроме того, временной интервал между первым появлением симптомов и постановкой окончательного диагноза может достигать 8–11 лет [6, 7]. Как показывают опубликованные данные, в 50% случаев эндометриоз может быстро прогрессировать [7, 8]. Таким образом, ранняя неинвазивная и/или малоинвазивная диагностика могла бы значительно ускорить постановку диагноза, после которой пациентки смогли бы обратиться за своевременной медицинской помощью, что имеет ключевое значение для профилактики прогрессирования и рецидивирования заболевания, а также сохранения репродуктивного здоровья пациентки и повышения качества ее жизни в целом.
В течение последних 10–15 лет для поиска маркеров эндометриоза все чаще применяется оценка транскрипционной активности генов, то есть измерение количества мРНК одного или нескольких генов непосредственно в ткани эктопического или эутопического эндометрия. Опубликован целый ряд исследований, посвященных анализу профилей экспрессии эндометрия с помощью микроматриц (mRNA microarray analysis). Этот метод позволяет оценить уровень синтеза мРНК всех уникальных генов человека [7, 9, 10]. Ключевым параметром для микроматричного анализа является плотность покрытия зондами уникальных генов. В последние годы стали доступны так называемые «микроматрицы высокой плотности», значительно точнее оценивающие не только уровень экспрессии каждого отдельного гена, но и всех транскриптов (сплайсоформ) этого гена. В опубликованных результатах исследований уже были выявлены некоторые различия транскрипционной активности генов в эутопическом эндометрии женщин с эндометриозом по сравнению с эутопическим эндометрием от женщин, не страдавших этим заболеванием. Однако в силу различий при составлении анализируемых групп пациенток, равно как и использованных для анализа транскриптомов методов (микрочипов с различным уровнем плотности зондов, а также секвенирования нового поколения (NGS)), полученные различными исследователями данные весьма противоречивы. Кроме того, поскольку эндометриоз является гетерогенным заболеванием, нельзя исключать различий в транскрипционной активности генов эндометрия при разных формах заболевания. Чтобы исключить влияние данного фактора, логично исследовать каждую форму заболевания отдельно, то есть формировать группы пациенток на основании существующей классификации эндометриоза.
Целью данного исследования было выявление генов, экспрессия которых в эутопическом пролиферативном эндометрии отличается у пациенток с эндометриоидными кистами яичников (ЭКЯ) по сравнению с эутопическим пролиферативным эндометрием женщин без эндометриоза. Для анализа были выбраны микроматрицы с наибольшей плотностью покрытия генома (GeneChip Human Exon 1.0 ST).
Такой анализ позволяет максимально точно сопоставлять экспрессионные профили тканей для выявления генов-кандидатов. Выборка из нескольких генов с повышенной или пониженной при эндометриозе экспрессией в дальнейшем послужит основой для создания ПЦР-систем, позволяющих быстро и недорого оценивать экспрессию генов. Уровень мРНК таких генов может стать основой для набора биомаркеров для диагностики эндометриоза как в начальной стадии, так и при рецидивах данного заболевания.
Материал и методы исследования
В исследование включены 20 пациенток репродуктивного возраста, находившиеся на лечении в отделении оперативной гинекологии ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России в 2015–2016 гг. Перед включением в исследование все женщины ознакомились, датировали и подписали информированное согласие в 2 экземплярах. Протокол исследования был одобрен этическим комитетом.
Всем пациенткам было проведено полное клинико-анамнестическое обследование: сбор анамнеза, общий и гинекологический осмотр, УЗИ органов малого таза, клинико-лабораторное обследование. Эндоскопическую операцию проводили по стандартизированной методике с помощью эндовидеохирургического оборудования фирмы Karl Storz (Германия). Диагноз ЭКЯ устанавливали при обнаружении кист яичников с характерным «шоколадным» содержимым, а также эндометриоидных гетеротопий на брюшине малого таза, матке, маточных трубах и при последующем подтверждении диагноза с помощью гистологического исследования. Гистероскопия применялась во всех случаях с диагностической целью. Гистероскопию сочетали с диагностическим выскабливанием эндометрия с последующим гистологическим исследованием полученного материала. Во время операции осматривали органы брюшной полости и малого таза, при обнаружении ЭКЯ и/или эндометриоидных очагов оценивали степень распространенности эндометриоза. Стадирование эндометриоза во время лапароскопического оперативного вмешательства производили по пересмотренной в 1996 г. классификации Американского общества репродуктивной медицины (ASRM).
Критерии включения в исследование: репродуктивный возраст (18–45 лет); наличие ЭКЯ, выявленных при лапароскопическом оперативном вмешательстве и подтвержденных при последующем гистологическом исследовании; пролиферативная фаза менструального цикла (средняя стадия); отсутствие патологических изменений в эутопическом эндометрии по данным гистероскопии и гистологического исследования эндометрия; отсутствие гормональной терапии в течение 6 месяцев до оперативного вмешательства; отсутствие эндометриоза, подтвержденное при лапароскопическом оперативном вмешательстве, и отсутствие операций по поводу эндометриоза в анамнезе; подписанное информированное согласие на участие в исследовании.
На основании полученных данных сформированы следующие группы пациенток: 10 женщин с ЭКЯ (основная группа) и 10 женщин без эндометриоза (группа сравнения). Группу сравнения составили женщины, не имеющие по данным лапароскопического исследования эндометриоза и поступившие на оперативное вмешательство в связи с бесплодием, спаечным процессом, параовариальными кистами.
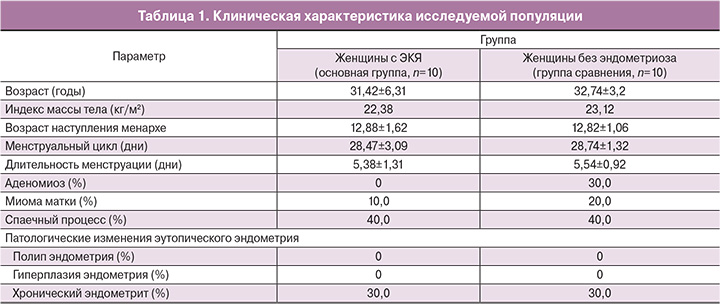
Статистический анализ клинических данных проводили с применением стандартных методов математико-статистической обработки с использованием пакетов программ прикладного статистического анализа (Statistica for Windows v. 10.0, Office 2003, Microsoft Excel и др.). Для оценки межгрупповых различий значений признаков применяли U-критерий Манна–Уитни. Для всех критериев и тестов величину критического уровня значимости принимали равной 0,05, то есть различия признавали статистически значимыми при p<0,05. Данные по выборкам пациенток приведены в табл. 1.
Материалом для исследования были образцы эутопического пролиферативного эндометрия, собранные в пробирки с транспортной средой для стабилизации РНК в биопробах (RNA-latter, Qiagen, США). Сбор образцов производили при помощи пайпель-биопсии непосредственно во время операции до проведения гистероскопического исследования с последующим выскабливанием эндометрия и гистологическим исследованием. Образцы эндометрия отправляли в биобанк ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России и замораживали при -70ºС для последующего хранения в коллекции.
Выделение РНК проводили на колонках с помощью набора RNeasy Mini Kit (Qiagen, США) по стандартной методике. Исходным количеством для анализа было 500 нг РНК каждого образца. С помощью in vitro транскрипции была синтезирована целевая кДНК, затем образцы были фрагментированы и помечены биотином согласно протоколу производителя (Affymetrix, США). Гибридизация образцов производилась на микрочипах GeneChip Human Exon 1.0 ST Arrays (Affymetrix, США), инкубация при 45°C продолжалась 17 ч на 60 об./мин. Затем микрочипы были промыты и окрашены на Fluidics Station 450 (Affymetrix, США). После промывки микрочипы были сканированы на лазерном сканере Affymetrix GeneChip 3000 7G (Affymetrix, США). Файлы DAT изображения микромассивов были получены с помощью пакета программ Affymetrix GeneChip Command Console (version 0.0.0.676, Affymetrix). Анализ полученных данных производился с помощью программ Expression Console и TAC (Transcriptome Analysis Cosnole) (Affymetrix, США). Для оценки межгрупповых различий в уровне экспрессии генов применяли критерий ANOVA (данные приведены в табл. 2).
Результаты исследования
Основную группу составили 10 женщин с ЭКЯ. У всех женщин выявлены ЭКЯ, размеры которых колебались от 1,5 до 10,0 см (средний размер кисты 3,56±1,08 см). Из 10 женщин с ЭКЯ при оперативном вмешательстве у 8 пациенток (80,0%) также были выявлены очаги эндометриоза на брюшине малого таза, у 4 пациенток (40,0%) также был диагностирован глубокий инфильтративный эндометриоз и у 3 пациенток (30,0%) – аденомиоз 1–2-й степени распространенности. По пересмотренной в 1996 г. классификации Американского общества репродуктивной медицины (ASRM) I–II степень заболевания выявлена у 40,0% пациенток, III–IV степень – у 60,0% пациенток.
Средний возраст женщин с ЭКЯ составил 31,42±6,31 года. У всех женщин был регулярный менструальный цикл, все женщины находились в пролиферативной фазе менструального цикла. Возраст наступления менархе колебался от 12 до 16 лет (в среднем – 12,88±1,62 года). Длительность менструации варьировала от 4 до 7 дней (средняя длительность – 5,38±1,31 дня), продолжительность менструального цикла – от 24 до 35 дней (средняя продолжительность – 28,47±3,09 дня).
Группу сравнения составили 10 женщин с лапароскопически подтвержденным отсутствием эндометриоза. Средний возраст женщин составил 32,74±3,2 года. У всех женщин был регулярный менструальный цикл, все женщины находились в пролиферативной фазе менструального цикла. Возраст наступления менархе колебался от 12 до 16 лет (в среднем – 12,82±1,06 года). Длительность менструации варьировала от 4 до 7 дней (средняя длительность – 5,54±0,92 дня), продолжительность менструального цикла – от 24 до 35 дней (средняя продолжительность – 28,74±1,32 дня).
Возраст пациенток и характеристики менструального цикла в основной группе и группе сравнения достоверно не различались (p<0,05). Клиническая характеристика пациенток представлена в табл. 1.
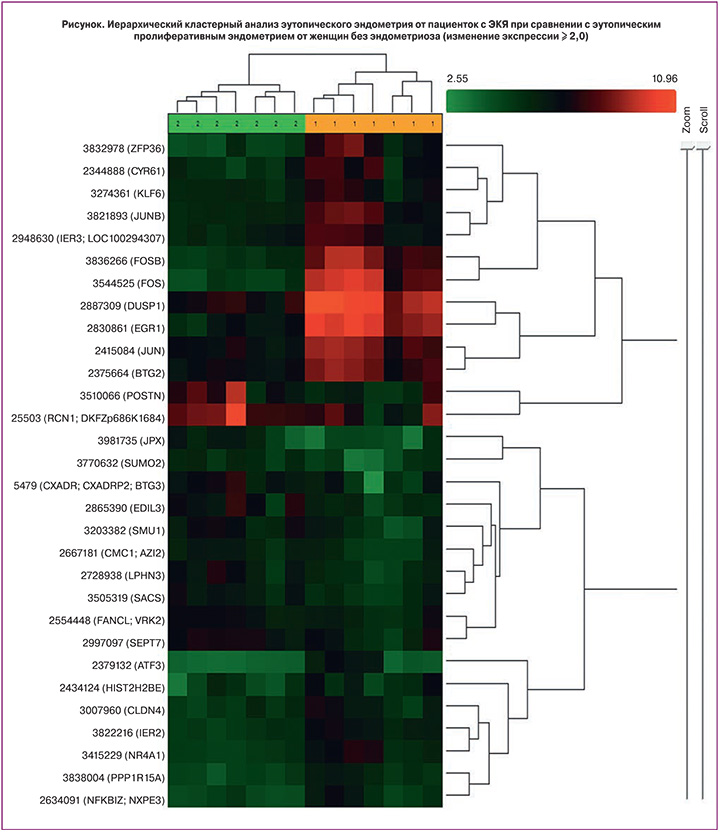
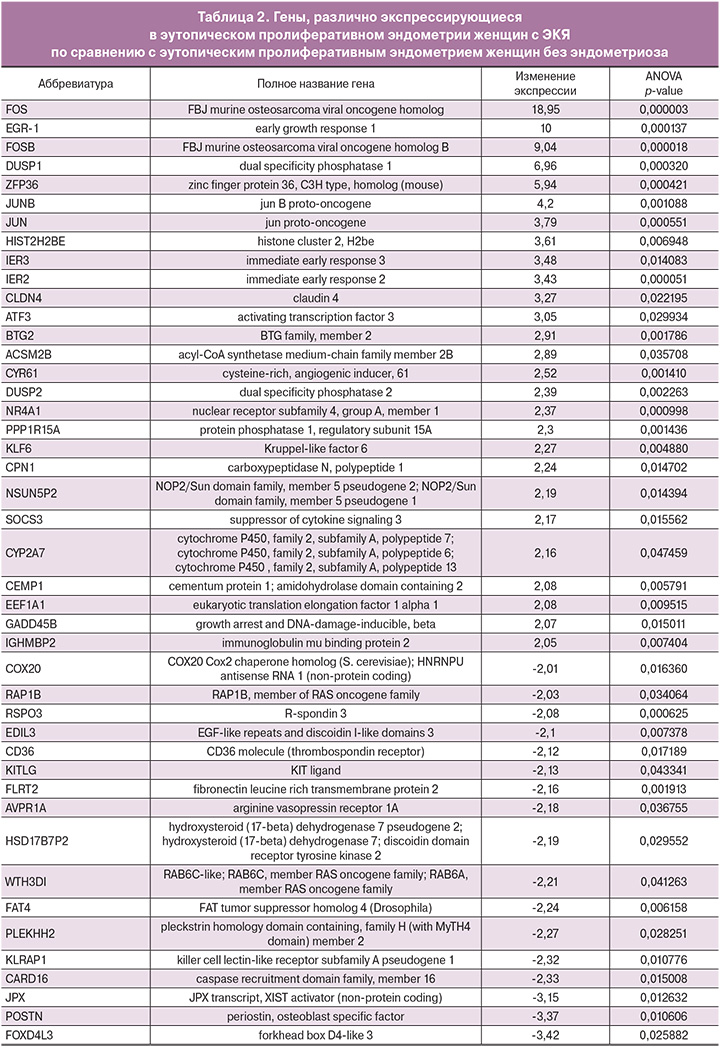
При сравнении генной экспрессии эутопического пролиферативного эндометрия от женщин с ЭКЯ (основная группа) и эутопического пролиферативного эндометрия от женщин без эндометриоза (группа сравнения) из 14 318 транскриптов было выявлено повышение экспрессии 27 генов и понижение экспрессии 17 генов. Порог отсечения составил 2. Результаты сопоставления экспрессионных профилей представлены в табл. 2.
Как следует из табл. 2, наибольшие различия в уровнях экспрессии в эутопическом пролиферативном эндометрии от женщин с ЭКЯ по сравнению с эутопическим пролиферативным эндометрием от женщин без эндометриоза были выявлены для следующих генов: FOS, EGR-1, FOSB, ZFP36, JUNB, JUN, HIST2H2BE – повышение экспрессии; а также FOXD4L3, POSTN и JPX – понижение экспрессии.
Результаты иерархического кластерного анализа по 30 различно экспрессирующимся генам представлены на рисунке. Анализ показал, что исследованные образцы распределяются по двум группам, совпадающим с нашими выборками: в группе женщин с ЭКЯ и группе женщин без эндометриоза транскрипционная активность генов пролиферативного эндометрия внутри групп практически не отличается, а между группами обнаруживаются четкие различия.
Гены с повышенной экспрессией в эутопическом эндометрии пролиферативной фазы менструального цикла от женщин с ЭКЯ относятся к генам раннего ответа, белковые продукты которых относятся к АР-1 (активирующий протеин-1) семейству транскрипционных факторов, которое состоит из белков Fos- и Jun-семейств; семейству факторов транскрипции EGR (early growth response); семейству белковых тирозиновых фосфатаз (protein tyrosine phosphatase (PTP) family); семейству TIS11 (TPA-induced sequence); генам гистоновых белков и связаны со следующими биологическими процессами: регуляцией молекулярных механизмов клеточной пролиферации, дифференцировки, апоптоза и трансформации; онкогенной трансформацией и канцерогенезом; инициацией и, по некоторым данным, с пролонгированием воспалительных реакций; ответом на стрессовые стимулы; взаимодействием с межклеточным матриксом; изменением адгезивных характеристик клетки; воздействием на гены, участвующие в регуляции клеточного цикла, а также процессов репарации и репликации ДНК и ремоделирования хроматина.
Гены с пониженной экспрессией в эутопическом эндометрии пролиферативной фазы менструального цикла от женщин с ЭКЯ кодируют белки, которые относятся к семействам транскрипционных факторов FOX (Forkhead box); семейству каспаз; опухолевым супрессорам и выполняют важную роль в регуляции экспрессии генов, вовлеченных в клеточный рост, пролиферацию, дифференцировку и выживаемость; регуляции адгезии и миграции эпителиальных клеток; участвуют в процессе инактивации Х-хромосомы; регуляции апоптоза; опухолевой супрессии.
Обсуждение результатов
Поиск биомаркеров, с помощью которых можно было бы проводить быструю и малоинвазивную диагностику эндометриоза, является в настоящее время одним из главных направлений в области исследований данного заболевания. С развитием таких технологий, как высокопроизводительное секвенирование (NGS) и гибридизации на микрочипах, появилась возможность получать большие массивы данных, характеризующих как состав всего генома, так и процессы, связанные с работой отдельных генов, их транскрипцией и экспрессией. Изучение профилей транскриптомов позволяет выявлять «перспективные биомаркеры» на небольших выборках пациенток, а затем проверять уровень экспрессии таких биомаркеров на большем количестве пациенток более дешевыми и быстрыми методами (обратная транскрипция с помощью ПЦР).
Исследования, посвященные дифференциальной экспрессии генов при различных заболеваниях, публикуются ежегодно, поскольку диагностика, основанная на неинвазивных или малоинвазивных биомаркерах, является быстрой и менее трудоемкой процедурой, а также в ряде случаев позволяет избежать хирургических вмешательств. Такой подход использовался в ряде исследований по эндометриозу, однако до настоящего времени не было выявлено надежных биомаркеров для создания диагностических ПЦР-систем. Недавний обзор по более чем 200 потенциальным биомаркерам эндометриоза, таким как гормоны и их рецепторы, цитокины и факторы, выявленные с помощью протеомного анализа, показывает, что специфичность таких биомаркеров очень сильно варьирует [8].
Поскольку эндометриоз является заболеванием, связанным с разрастанием ткани эндометрия вне полости матки, основные усилия исследователей в последнее время направлены на поиски отличий в транскрипционной активности клеток эутопического эндометрия у женщин с эндометриозом [11, 12].
Сопоставление профилей экспрессии больных и здоровых женщин позволило выявить целый ряд генов, уровень мРНК которых существенно отличается как в большую, так и в меньшую сторону. Также довольно существенно отличаются списки таких генов в работах разных групп исследователей, поэтому для поиска биомаркеров и отработки их измерений в условиях конкретного медицинского центра необходимо проводить собственные научные изыскания на образцах эндометрия пациенток, проходящих лечение в отделениях хирургии.
В нашей работе мы ограничились образцами эутопического эндометрия женщин с ЭКЯ, поскольку нельзя исключать, что при разных формах эндометриоза могут быть задействованы различные молекулярные механизмы, то есть изменения экспрессии генов могут быть разнонаправленными и анализ объединенных групп не даст результатов.
Анализ полученных нами данных c экспрессионных чипов Human Exon ST Array 1.0 показал значительное увеличение уровней экспрессии следующих генов в эутопическом пролиферативном эндометрии от женщин с ЭКЯ по сравнению с эутопическим пролиферативным эндометрием от женщин без эндометриоза: FBJ murine osteosarcoma viral oncogene homolog (FOS), Early growth response 1 (EGR-1), FBJ murine osteosarcoma viral oncogene homolog B (FOSB), Dual specificity phosphatase 1 (DUSP1), Zinc finger protein 36, C3H type, homolog (mouse) (ZFP36), Jun B proto-oncogene (JUNB), Jun proto-oncogene (JUN).
Все эти гены упоминаются в ряде работ по экспрессии эутопического эндометрия; таким образом, наши результаты во многом соответствуют опубликованным данным, однако позволяет нам опираться на собственные данные о различиях в экспресии, а не полагаться на часто противоречивые результаты других исследований. Так, в работе J.S. Tamaresis и соавт. [11] показано, что в эутопическом пролиферативном эндометрии женщин с эндометриозом по сравнению с эутопическим пролиферативным эндометрием здоровых женщин наибольшие отличия наблюдаются по уровню экспрессии генов FOSB (в 34,1 раза), FOS (в 28,5 раза), EGR1 (в 15,2 раза) и JUNB (в 13,1 раза), но не упоминаются гены JUN и ZFP36. Полученные нами данные также отчасти совпадают с данными исследования L. Zhao и соавт. [12], в котором среди 72 дифференциально экспрессируемых генов также встречаются гены FOSB (повышение по сравнению с нормой в 66,12 раза), FOS (в 14,54 раза), EGR3 (в 13,24 раза), EGR1 (в 5,47 раза), EGR2 (в 4,41 раза) и DUSP1 (в 4,35 раза). Поскольку в упомянутых выше работах использовались различные методики полногеномных исследований (гибридизация на микрочипах U133 (Affymetrix) в первом и NGS-транкриптомов во втором), проведенный нами анализ может служить подтверждением ценности этих генов как потенциальныих биомаркеров эндометриоза.
Молекулярные механизмы участия вышеупомянутых генов в развитии эндометриоза пока не описаны подробно, однако опубликован ряд исследований, посвященных некоторым из них [11–15]. Например, в ряде работ исследована экспрессия гена FOS, которая значительно (в 200 раз) превышала норму в эутопическом эндометрии бабуинов, у которых эндометриоз был индуцирован экспериментально [11, 13]. На данной животной модели эндометриоза было также установлено, что уровень мРНК гена FOS постепенно снижался в течение прогрессирования заболевания от 93-кратного до 60-кратного превышения по сравнению с уровнем в контрольной группе через 6 и 12 месяцев соответственно. Через 15 месяцев после индукции заболевания уровень экспрессии мРНК гена FOS был сопоставим с уровнем в контрольной ткани от животных без заболевания (5-кратное увеличение по сравнению с контрольной группой) [13]. Возможно, повышение уровня экспрессии FOS наиболее значительно во время активного периода развития и прогрессирования заболевания. Предположительно, увеличение уровня мРНК гена FOS, показанное в эутопическом эндометрии на бабуиновой модели эндометриоза, может быть опосредовано гиперэстрогенной активностью, которая связана с этим заболеванием [13]. Хорошо известно, что экспрессия гена FOS индуцируется эстрадиолом, считается, что эта индукция играет важную роль в эстрадиол-опосредованной пролиферации клеток эндометрия [13]. J.L. Kirkland и соавт. [15] продемонстрировали ингибирование эстрадиол-индуцированной экспрессии гена FOS с помощью медроксипрогестерон ацетата, предполагая, что опосредованное прогестероном ингибирование пролиферации клеток эндометрия во время секреторной фазы менструального цикла опосредуется ингибированием экспрессии гена FOS. Кроме того, предполагается, что продукт гена FOS может опосредованно влиять на экспрессию других генов. Было показано, что этот белок ингибирует транскрипционную активность гена PGR [13]. Более того, результаты клеточных исследований рака молочной железы свидетельствуют о том, что эстрадиол-индуцированная экспрессия гена FOS может запускаться через G-белковые рецепторы и MAPK- и PI3K-внутриклеточные сигнальные каскады [16, 17]. Таким образом, повышенный уровень мРНК гена FOS, наблюдаемый в эутопическом эндометрии животных на ранних стадиях развития эндометриоза, может быть частично опосредован негеномными воздействиями эстрадиола.
Анализ генетически модифицированных мышей и клеточных линий указал на важную роль этого белка в развитии, поддержании гомеостаза тканей и в клеточном ответе на воздействия окружающей среды. FOS может являться негативным регулятором воспаления, ингибируя активность NF-κB [17].
Нарушения функционирования FOS связывают с развитием иммунологических отклонений, а также онкогенной трансформацией и развитием опухолей. Роль FOS в развитии разных типов опухолей различна – имеются публикации, описывающие как протоонкогенные свойства данного белка, так и его противоопухолевую активность [18, 19]. Конститутивная экспрессия FOS, как было показано в нескольких исследованиях, является маркером канцерогенеза и неблагоприятным прогностическим фактором при раке молочной железы, шейки матки, поджелудочной железы и гепатоцеллюлярной карциноме [20]. Постоянная активация связана с опухолевой прогрессией: повышением инвазивности и усилением ангиогенеза. Данная связь объясняется тем, что фактор транскрипции АР-1 контролирует экспрессию ряда генов, например, нескольких матриксных металлопротеиназ (MMP-1, -3, -9, -13). Данные ферменты в норме участвуют в процессе реорганизации межклеточного матрикса [20].
Данные опубликованных исследований свидетельствуют, что экспрессия гена FOSB, аналогично FOS, увеличивается в ответ на различные митогены. FOSB образует комплекс с белками JUN, JUNB и JUND, и является сильным транскрипционным активатором. Как и FOS, FOSB является регулятором жизненного цикла клетки и зачастую может компенсировать функции этого белка у нокаутных по FOS животных. В отличие от FOS, FOSB в комплексе с JUN вызывает Fas/FasL-опосредованный апоптоз клеток. Определено, что FOSB может оказывать стимулирующее воздействие на образование опухолей [20]. В нашей работе было выявлено 19-кратное увеличение уровня экспрессии гена FOS и 9-кратное увеличение уровня экспрессии гена FOSB в эутопическом пролиферативном эндометрии от женщин с ЭКЯ.
Еще для двух близких генов, JUNB и JUN, было выявлено 4-кратное увеличение экспрессии в эутопическом пролиферативном эндометрии от женщин с ЭКЯ по сравнению с женщинами без эндометриоза. Ген JUN играет важную роль в миграции опухолевых клеток [21]. Повышение экспрессии этих генов может способствовать развитию эндометриоза, воздействуя на пути фокальной адгезии. С другой стороны, JUN также воздействует на регуляцию актинового цитоскелета, который связан с измененной клеточной адгезией, встречающейся при эндометриозе [21, 22]. Таким образом, изменение экспрессии этих генов может быть важной причиной нарушения регуляции актинового цитоскелета и фокальной адгезии, способствуя развитию и прогрессированию эндометриоза.
Еще один перспективный кандидатный ген EGR-1 (early growth response 1) показал 10-кратное повышение экспрессии в эндометрии пациенток с СКЯ. Эти данные совпадают с данными других исследований [11, 12, 14]. По данным J.A. Birt и соавт. [14], уровень экспрессии EGR1 значительно повышен также в ткани яичников крыс при индуцированном эндометриозе яичников, по сравнению с контрольной группой. Авторы некоторых исследований считают, что продукт гена EGR1 регулирует генные механизмы овуляции [14]. Промотор гена EGR1 реагирует на передачу сигналов в каскадах, регулируемых фактором некроза опухоли-α (TNF-α). Изменение экспрессии яичникового EGR1 индуцируется повышенной концентрацией TNF-α в перитонеальной жидкости, которая связана с наличием эндометриоза яичников или перитонеального эндометриоза. Взаимодействия между повышенным уровнем TNF-α в перитонеальной жидкости и сверхэкспрессией фолликулярного Egr1/EGR1 при эндометриозе могут влиять на снижение активности протеаз и препятствовать овуляции [14]. Возможно, именно это приводит к частому нарушению овуляции у женщин с ЭКЯ.
Ген DUSP1 (альтернативное название MKP1), экспрессия которого по нашим данным была повышена в 7 раз, кодирует фермент фосфатазу, которая специфически инактивирует МАР-киназы через одновременное дефосфорилирование остатков треонина и тирозина. При онкологических заболеваниях экспрессия этого гена может изменяться различным образом в зависимости от заболевания и условий его протекания.
Уровень мРНК гена ZFP36 (zinc finger protein 36) в эутопическом пролиферативном эндометрии от женщин с ЭКЯ был повышен в 6 раз. Это ген изначально был описан как активный регулятор воспалительного ответа [25]. В настоящее время опубликованы данные указывающие, что его экспрессия снижена во многих типах раковых клеток по сравнению с нормальными клетками [25, 26]. Более того, повышение его экспрессии противодействует злокачественной трансформации путем вмешательства различными способами, в зависимости от модели заболевания [25]. В частности, совсем недавно было продемонстрировано, что ZFP36 способен индуцировать сдвиг от мезенхимного к эпителиальному фенотипу в разных линиях раковых клеток посредством понижения регуляции генов TWIST1 и SNAIL1 [6]. Эпителиально-мезенхимальный переход (ЭМТ) – это процесс, состоящий в превращении клеток эпителия в подвижные мезенхимальные клетки. Такое превращение наблюдается при заживлении ран и дифференцировки стволовых клеток, однако имеет место и при прогрессирования онкологических процессов [6, 27]. Доказано, в частности, что снижая экспрессию генов, задействованных в развитии рака, продукт гена ZFP36 положительно влияет на процесс эпителиально-мезенхимального превращения (ЕМТ) и, по-видимому, способен возвращать клетки к эпителиальному фенотипу [27].
Среди генов с пониженным уровнем экспрессии в эутопическом пролиферативном эндометрии от женщин с ЭКЯ по сравнению с эутопическим пролиферативным эндометрием от женщин без эндометриоза мы выделили всего 3: POSTN, FOXD4L3 и JPX. Однако эти гены практически не встречаются в результатах других исследований транскриптомов эутопического эндометрия, поэтому использовать их в качестве биомаркеров эндометриоза не представляется возможным, пока не будут проведены более детальные исследования.
Полученные данные подтверждают гипотезу о том, что процессы, происходящие в эутопическом эндометрии, имеют непосредственное отношение к развитию эндометриоза. Повышенная экспрессия ряда генов является характерным признаком изменения функциональных свойств ткани эндометрия у женщин, страдающих эндометриозом. Такие функциональные изменения, возможно, и являются причиной возникновения эндометриозных очагов за пределами полости матки. Дальнейшие исследования сигнальных путей, в которых задействованы выявленные гены, поможет установить механизмы, регулирующие рост и развитие эктопического эндометрия и предложить способы регуляции этих процессов.
Заключение
Полученные данные о повышенной экспрессии генов FOS, EGR-1, FOSB, DUSP1, ZFP36, JUNB и JUN в эутопическом пролиферативном эндометрии женщин с ЭКЯ согласуются с результатами ранее опубликованных работ, что делает данные гены перспективными биомаркерами для создания диагностических систем на основе ПЦР в реальном времени для детекции уровня мРНК в тканях эндометрия. Создание и внедрение в клиническую практику таких диагностических систем может существенно снизить затраты и ускорить постановку диагноза для пациенток, у которых возникают симптомы эндометриоза.



