Преэклампсия (ПЭ) – это осложнение беременности, возникающее после 20 недель и характеризующееся артериальной гипертензией (АГ) и протеинурией. ПЭ осложняет 3–5% всех беременностей и является ведущей причиной материнской и перинатальной заболеваемости и смертности [1–3].
ПЭ, наряду с такими осложнениями беременности, как преждевременная отслойка нормально расположенной плаценты (ПОНРП), задержка роста плода (ЗРП), является одним из синдромов, патогенетически связанным с плацентарной дисфункцией [4]. В основе плацентарной дисфункции лежит дисбаланс ангиогенных (плацентарный фактор роста – PlGF) и антиангиогенных факторов (растворимая fms-подобная тирозинкиназа – sFlt-1), который коррелирует с манифестацией клинической картины как ПЭ, так и других плацентарных синдромов [5–7].
К сожалению, золотой стандарт диагностики ПЭ (уровень артериального давления и протеинурии) не всегда отражает степень тяжести этого осложнения беременности и не всегда является предиктором неблагоприятных исходов беременности [8]. Такие материнские и перинатальные осложнения ПЭ, как отслойка плаценты, эклампсия, острая почечная недостаточность, антенатальная и постнатальная гибель плода, ЗРП менее 5 перцентиля, преждевременные роды до 34 недель, низкая оценка по шкале Апгар, по данным Zhang J. [8], имеют место у 2,1, 0,2, 0,1, 1,7, 1,0, 8,4 и 3,2% беременных с ПЭ соответственно. Однако корреляция уровня АГ и протеинурии с неблагоприятными исходами противоречива по данным литературы. Так, в фундаментальных работах Page E., Christianson R. и Sibai B. [9, 10] перинатальные потери и рождение детей с ЗРП зависят от выраженности протеинурии и АГ. По мнению других авторов [8], не выявлено корреляции неблагоприятных материнских и перинатальных осложнений с уровнем повышения АД и протеинурии.
Определение соотношения sFlt-1/PlGF, по данным зарубежной литературы [11] и нашим собственным данным [12], зарекомендовало себя в качестве дополнительного лабораторного инструмента, позволяющего оценить степень тяжести ПЭ. Так, Verlochren S. и соавт. [13] показали, что уровень sFlt-1/PlGF у пациенток с ранней (до 34 недель) ПЭ более 655 в 2,69 раза повышает риск неминуемого досрочного родоразрешения. Соотношение sFlt-1/PlGF ≥655 может использоваться в качестве порогового значения, которое дополнительно к клинической картине помогает принять решение о времени родоразрешения пациентки с ПЭ, что особенно важно в случае очень ранних преждевременных родов.
Однако нет четких доказательств, что cut-off (пороговое значение) 655 является предиктором неблагоприятных перинатальных исходов у пациенток с преэклампсией.
В работе Gomez-Arriaga P. и соавт. [14] показано, что комбинированная оценка sFlt-1/PlGF со сроком дебюта ПЭ и пульсовым индексом (PI) маточных артерий может оказывать существенную помощь в перинатальном прогнозе [14–16].
Поиск порогового значения sFlt-1/PlGF в качестве маркера риска перинатальных осложнений необходим в связи с возможностью выжидательной тактики при ранней ПЭ. Основная цель заключается в улучшении перинатальных исходов путем увеличения гестационного возраста и снижения риска заболеваемости новорожденного, связанной с недоношенностью, при условии безопасности пролонгирования беременности для здоровья матери и отсутствия дистресса у плода.
Цель настоящего исследования – найти пороговый уровень соотношения sFlt-1/PlGF в качестве предиктора неблагоприятных перинатальных исходов у пациенток с тяжелой ПЭ.
Материалы и методы
Исследование проведено на базе Перинатального Медицинского Центра ГК «Мать и Дитя» и лаборатории Клинического Госпиталя «Лапино» ГК «Мать и Дитя» в течение 2016–2018 гг.
В исследование были включены 28 беременных с тяжелой ПЭ и сроком гестации 20–39 недель. В зависимости от перинатальных исходов все исследуемые пациентки разделены на 3 группы: в 1-ю группу включены 5 беременных с антенатальной и постнатальной гибелью плода, 2-ю составили 7 пациенток без перинатальных потерь, но с промежуточными перинатальными исходами (оценка по шкале Апгар на 5-й минуте ≤7 баллов, рН пуповинной крови новорожденного при рождении <7,2, лактат – ≥4,8 ммоль/л); в 3-ю группу включены 16 пациенток без перинатальных потерь с благоприятными перинатальными исходами (оценка по шкале Апгар на 5-й минуте >8 баллов, рН пуповинной крови при рождении ≥7,2, лактат – <4,8 ммоль/л).
Критерии включения в исследование: наличие у пациенток диагноза тяжелой ПЭ, установленного в соответствии с клиническими рекомендациями «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия»; систолическое артериальное давление (САД) ≥160 мм рт. ст. и/или диастолическое артериальное давление (ДАД) ≥110 мм рт. ст., суточная протеинурия ≥5 г/л или >3 г/л в 2 порциях мочи с интервалом 6 ч после 20 недель беременности, наличие дополнительных критериев тяжелой ПЭ (HELLP, устойчивые головные боли, нарушения функции почек и т.п.) [17].
Критерии исключения: 1 пациентка со сроком гестации менее 20 недель; 2 пациентки, беременность которых завершилась вне стационаров ГК «Мать и Дитя»; 2 пациентки с многоплодной беременностью.
Сывороточная концентрация PlGF и sFlt-1 в крови беременных определена с помощью электрохемилюминесцентных диагностических тестов Elecsys sFlt-1 концерна «Ф. Хоффманн-Ля Рош» (Швейцария) на автоматических анализаторах Cobas e411. Для каждого образца крови рассчитано соотношение sFlt-1/PlGF.
Показатели пуповинной крови новорожденных: pH, ВЕ (сдвиг буферных оснований), лактат определены на анализаторе Radiometr ABL 835.
Статистический анализ проводили при помощи программного пакета IBM SPSS Statistics 23.0. Описательная статистика для количественных переменных представлена в виде M (SD) или Me (Q1;Q3) в зависимости от нормальности распределения переменной. Описательная статистика для порядковых и качественных переменных представлена в виде частоты и доли (%) каждой категории. Во всех случаях применяли двусторонние варианты статистических критериев. Нулевую гипотезу отвергали при р<0,05.
В случае количественной зависимой переменной при количестве категорий независимой переменной более 2 для сравнения использовали критерий Краскела–Уоллиса (для распределения, не соответствующего нормальному), при количестве категорий независимой переменной, равном 2, и попарном сравнении – критерий Манна–Уитни с поправкой на множественные сравнения. Для сравнения качественных параметров, их частот использовался точный критерий Фишера.
Также проводили оценку предсказательной ценности показателей PlGF, sFlt-1, соотношения sFlt-1/PlGF для каждой из изучаемых групп относительно двух других с использованием логистической регрессии. Затем при помощи ROC-анализа оценивали чувствительность и специфичность каждого из показателей.
Результаты
Исследуемые группы не отличались друг от друга по таким фоновым показателям, как возраст, индекс массы тела (ИМТ). Первобеременные пациентки чаще встречались в группе перинатальных потерь по сравнению с группами без потерь: 5/5 (100%) vs 4/7 (57%) и 9/16 (56%) .
ПЭ в анамнезе, гестационный сахарный диабет (ГСД), хроническая артериальная гипертензия (ХАГ), заболевания почек преобладали в группе с благоприятными перинатальными исходами: 1/16 (6%), 3/16 (18%), 4/16 (25%), 1/16 (6%) соответственно. Беременности после экстракорпорального оплодотворения (ЭКО) также встречалась только в 3-й группе (табл. 1).
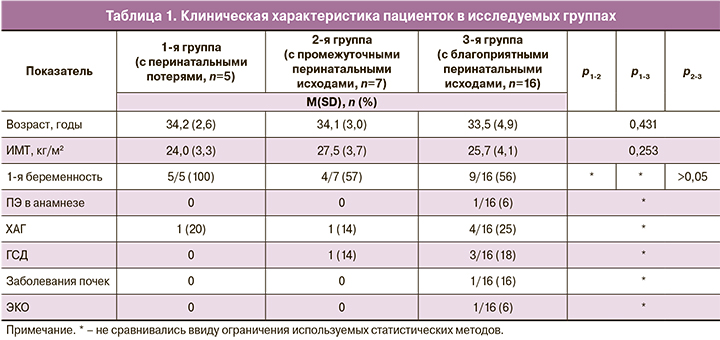
Исследуемые группы сравнивали по перинатальным исходам. Срок родоразрешения и масса ребенка при рождении достоверно были меньше в 1-й группе по сравнению со 2-й и 3-й, 29 (0) недель, 532 (151) г vs 34 (4) недели, 1991 (743) г vs 34 (3) недели, 2314 (848) г, р1-2=0,029, 0,034, р1-3=0,003, 0,001, р2-3=1,1 соответственно. В 1-й исследуемой группе антенатальная гибель плода имела место у 2 (33%) из 5, постнатальная гибель – у 3 (67%) из 5 пациенток. Все 5 погибших плодов имели массу менее 5 перцентиля. Во 2-й и 3-й группах ЗРП менее 10 перцентиля имелась у 4 (57%) из 7, 6 (37%) из 16 и менее 5 перцентиля – у 3 (42%) из 7, 2 (12%) из 16 соответственно.
Оценка по шкале Апгар на 5-й минуте была ниже в группе неблагоприятных исходов по сравнению с группами промежуточных и благоприятных исходов, 7 (1) vs 7,5 (0,8) и 8,5 (0,5) соответственно. В 1-й группе рН также был ниже по сравнению со 2-й и 3-й группами, 7,25 (0,03) vs 7,3 (0,1) vs 7,3 (0,02) соответственно. Лактат пуповинной крови 3 живорожденных детей 1-й группы был выше, чем лактат 2-й и 3-й групп: 5 (3) vs 4,3 (1,7) vs 1,7 (0,52).
Всем 3 новорожденным из 1-й группы потребовались госпитализация в отделение реанимации и интенсивной терапии новорожденных (ОРИТН) и искусственная вентиляция легких (ИВЛ), в отличие от детей 2-й и 3-й групп, где в пребывании в ОРИТН и ИВЛ нуждались 85 и 42%, 62 и 50% новорожденных соответственно. Отличий по длительности пребывания в ОРИТН и на ИВЛ между 1-й, 2-й и 3-й группами не получено: 3,6 (1,15) vs 6,6 (9,2) vs 2,9 (4,8) дня, р=0,252 и 3,6 (1,15) vs 2,6 (5,5) vs 1,3 (2,6) дня, р=0,083. Внутрижелудочковое кровоизлияние (ВЖК) 3–4 степени имело место только у 1 новорожденного 1-й группы. Такие перинатальные осложнения, как сепсис и некротический энтероколит (НЭК), не зафиксированы ни в одной из групп (табл. 2).
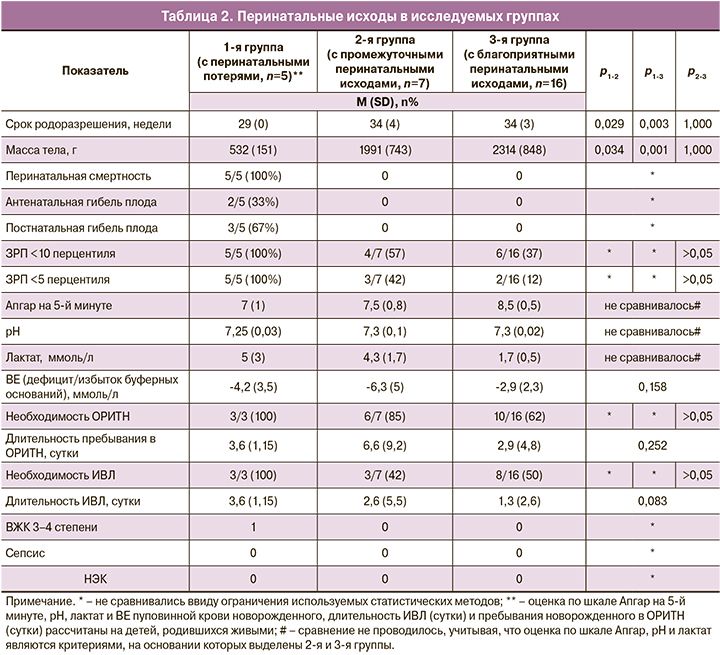
При сравнении всех пациенток с тяжелой ПЭ (n=28) с данными Stolz M. и соавт. [23] существенных отличий по перинатальной смертности (18% vs 18,3%), оценке по шкале Апгар на 5-й минуте (8 (7,75–9,0) vs 9 (6–10), рН пуповинной крови новорожденного (7,29 (0,06 vs 7,25 (0,09), необходимости пребывания новорожденного в ОРИТН (79% vs 85%) не отмечено. Обращает на себя внимание, что срок родоразрешения и, соответственно, масса тела новорожденного были больше в нашем исследовании (32,7 (4,9) недели vs 29,1 (3,5) недели и 1799 (964) г vs 1136 (517) г, однако детей с весом менее 10 перцентиля у наших пациенток родилось больше, чем в исследовании Stolz M. и соавт. (60% vs 21,7%) [23] (табл. 3).
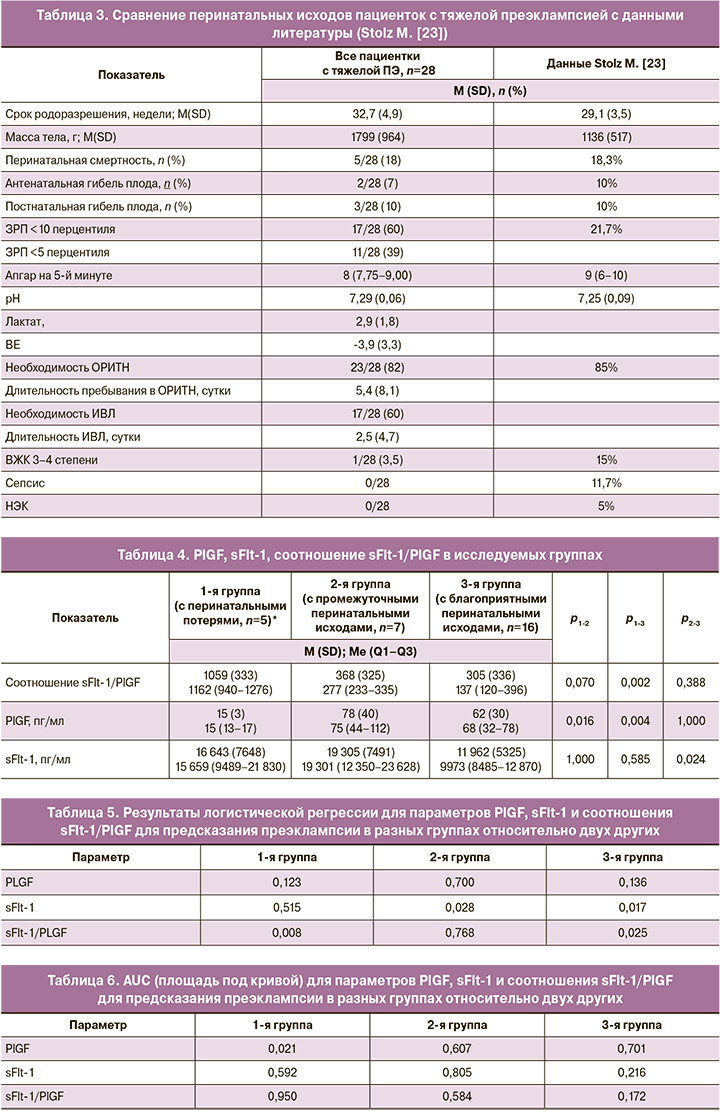
В трех исследуемых группах проведен сравнительный анализ сывороточных концентраций PlGF, sFlt-1 и уровня соотношения sFlt-1/PlGF.
Уровень соотношения sFlt-1/PlGF статистически значимо был больше у пациенток с перинатальными потерями по сравнению с пациентками с благоприятными перинатальными исходами, 1162 (940–1276) vs 137 (120–396), p1-3=0,002. Существенных отличий по уроню соотношения sFlt-1/PlGF между 1-й и 2-й группами не получено, р=0,07. Отсутствие значимых отличий, вероятно, связано с количественным ограничением выборок. В 1-й группе показатель PlGF был ниже, чем в группах с промежуточными и благоприятными перинатальными исходами, 15 (13–17) vs 75 (44–112) и 68 (32–78), р1-2=0,016, р1-3=0,004 соответственно. Отличия по сывороточной концентрации sFlt-1 получены только между группами с промежуточными и благоприятными перинатальными исходами, 19 301 (12 350–23 628) vs 9973 (8485–12 870), р=0,024 (табл. 4).
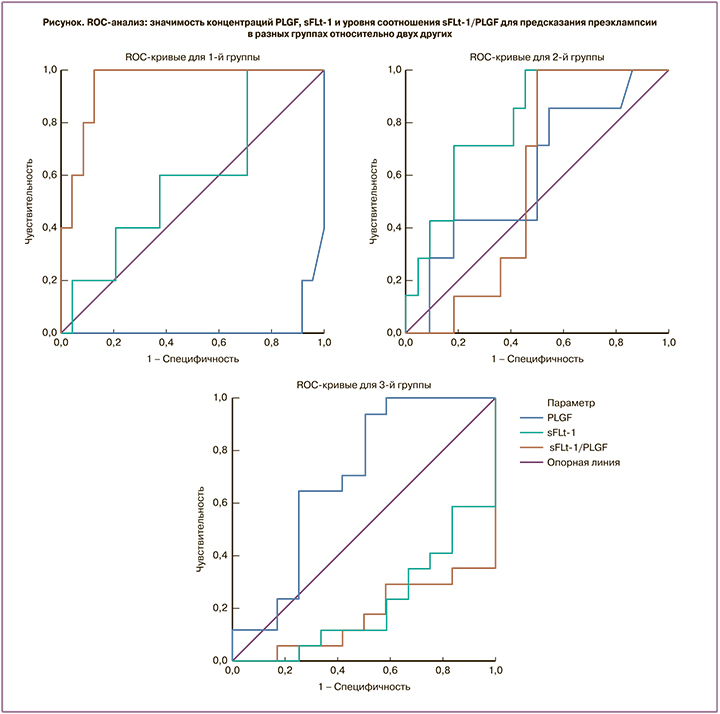
При проведении логистической регрессии для определения предикторов перинатальных потерь у пациенток с тяжелой ПЭ (предикторов 1-й группы относительно 2-й и 3-й) значимым оказалось соотношение sFlt-1/PlGF (р=0,008), а параметры PlGF (р=0,123) и sFlt-1 (р=0,515) – незначимыми. Метод логистической регрессии дополнен ROC-анализом, с помощью которого удалось подтвердить прогностическую значимость соотношения sFlt-1/PlGF, площадь под кривой (AUC) составила 0,950. Пороговый уровень для соотношения sFlt-1/PlGF выбрали по максимальной сумме чувствительности и специфичности. В нашем исследовании для утверждения, что пациентки с диагнозом «тяжелая ПЭ» имеют риск перинатальных потерь, установлен пороговый уровень sFlt-1/PLGF, равный 520, чувствительность и специфичность составили 100% и 88% соответственно.
При проведении логистической регрессии для определения предикторов 2-й группы (группы с промежуточными перинатальными исходами) относительно 1-й и 3-й групп значимым оказалось sFlt-1 (р=0,028), а соотношение sFlt-1/PlGF (р=0,768) и показатель PlGF (р=0,700) незначимыми. Метод логистической регрессии дополнен ROC-анализом, с помощью которого удалось подтвердить прогностическую значимость параметра sFlt-1, AUC составила 0,805. Пороговый уровень для sFlt-1 выбрали по максимальной сумме чувствительности и специфичности, что составило 18 668,5 пг/мл при чувствительности и специфичности 71,4 и 81,8% соответственно.
При проведении логистической регрессии для определения предикторов рождения детей с благоприятными перинатальными исходами у пациенток с тяжелой ПЭ (предикторы 3-й группы относительно 1-й и 2-й) значимым оказалось определение sFlt-1 (р=0,017) и соотношение sFlt-1/PlGF (р=0,025), а параметр PLGF (р=0,136) – незначимым. Метод логистической регрессии дополнен ROC-анализом, с помощью которого удалось подтвердить прогностическую значимость параметра sFlt-1 и соотношения sFlt-1/PlGF, AUC составила 0,216 и 0,172 соответственно. При обратной оценке AUC составила 0,784 и 0,828 соответственно. Пороговый уровень для параметра sFlt-1 выбрали по максимальной сумме чувствительности и специфичности при обратной оценке. В нашем исследовании для утверждения, что пациентки с тяжелой ПЭ будут иметь благоприятные перинатальные исходы, установлен уровень sFlt-1, равный 10 674,5 пг/мл при чувствительности и специфичности 58,8 и 83,3% соответственно. Пороговый уровень для соотношения sFlt-1/PlGF выбрали по максимальной сумме чувствительности и специфичности при обратной оценке, что составило 162,3 при чувствительности и специфичности 64,7 и 100% соответственно (табл. 5, 6, рис. 1).
Обсуждение
Наша работа подтвердила, что ПЭ – это осложнение беременности, связанное с плацентарной дисфункцией. Так, 58% пациенток с тяжелой ПЭ (17 из 29) имели ЗРП менее 10 перцентиля. Интересно, что по данным Shear R.M. и соавт. [18], Mitani M. и соавт. [19] ЗРП у пациенток с тяжелой преэклампсией встречается в 12,8–58,6% случаев [18, 19]. Перинатальные потери в нашем исследовании отмечены у 30% пациенток с ЗРП менее 10 перцентиля (5 из 17), что схоже с данными Benton S. [20], где 44% пациенток с тяжелой ПЭ и ЗРП менее 10 перцентиля имели антенатальную и постнатальную гибель плода.
По данным литературы, перинатальные потери достоверно чаще имеют место у пациенток с ЗРП менее 10 перцентиля, причем антенатальная гибель – у 15% в исследовании Engineer N. и соавт. [21], постнатальная – у 8% в работе Garite T. и соавт. [22].
Основной целью нашей работы явился поиск порогового значения соотношения sFlt-1/PlGF в качестве предиктора неблагоприятных перинатальных исходов. В первую очередь интересно было оценить медиану соотношения sFlt-1/PlGF у пациенток с перинатальными потерями, которая составила, по нашим данным, 1162 (940–1276). Схожие результаты получены и другими исследователями. Так, в работе Leanos-Miranda A. и соавт. [24] уровень соотношения sFlt-1/PlGF у пациенток с тяжелой ПЭ и перинатальными потерями составил 972 (380) vs 605 (373) без потерь, p<0,001. В исследовании Stolz M. и соавт. [23] не получено отличий по перинатальным исходам в 2 группах пациенток с соотношением sFlt-1/PlGF <655 и >655 . Однако при пороговом значении соотношения sFlt-1/PlGF ≥1000 авторы выявили, что перинатальные исходы (масса тела новорожденного, оценка по шкале Апгар на 5-й минуте, рН пуповинной крови) были хуже, чем при значении менее 1000, и предложили уровень соотношения sFlt-1/PlGF более 1000 использовать в качестве cut-off для предикции неблагоприятных перинатальных исходов. Проведенный нами ROC-анализ выявил пороговый уровень sFlt-1/PlGF для прогноза перинатальных потерь 520 с максимальной суммой чувствительности (100%) и специфичности (88%). Однако при снижении чувствительности метода до 60% и повышении специфичности до 96% пороговое значение соотношения sFlt-1/PlGF составило 1197, что хорошо согласуется с медианой sFlt-1/PlGF 1162 (940–1276), полученной для оценки риска перинатальных потерь в нашем исследовании, а также с результатами Stolz M. и соавт. [23].
В отношении PlGF нами выявлено значительное снижение этого маркера у пациенток с перинатальными потерями по сравнению с 2-й и 3-й группами: 15 (13–17) vs 75 (44–112) и 68 (32–78) пг/мл. В исследовании Benton S. и соавт. [20] показано, что у пациенток с ЗРП менее 10 перцентиля сывороточная концентрация этого маркера составила 12 и менее пг/мл. Авторы даже предлагают использовать уровень PlGF для дифференциальной диагностики ЗРП вследствие плацентарной недостаточности от маловесных плодов (SGA – small gestation age) по причине конституциональных особенностей.
Показатель sFlt-1 показал себя в наибольшей степени в качестве предиктора рождения детей с промежуточными перинатальными исходами (2-я группа) и составил 18 668,5 пг/мл.
Заключение
Определение соотношения sFlt-1/PlGF может использоваться в качестве предиктора неблагоприятных перинатальных исходов. Согласно результатам нашего исследования, пороговым уровнем соотношения sFlt-1/PlGF с целью прогноза перинатальных потерь предлагаем считать значение 1197 при чувствительности 60% и специфичности 96%. Таким образом, определение уровня соотношения sFlt-1/PlGF является дополнительным инструментом не только для постановки диагноза ПЭ и определения степени ее тяжести, но и для определения срока родоразрешения с целью профилактики неблагоприятных перинатальных осложнений.
Собственное исследование считаем пилотным, и очевидно, что для определения более точных значений предикторов перинатальных исходов требуется дальнейшее исследование с большим количеством участников групп.



