Завершающим этапом стимуляции суперовуляции в программах ЭКО является введение триггера финального созревания ооцитов. Традиционно с этой целью используется человеческий хорионический гонадотропин (ЧХГ), заменяющий преовуляторный пик ЛГ, существующий в естественных менструальных циклах. В связи с идентичностью α-субъединиц и 85% сходством β-субъединицы, ЧХГ и ЛГ воздействуют на один и тот же ЛГ/ЧХГ рецептор [1]. Однако эти гормоны не являются полностью аналогичными, так как ЧХГ имеет более длительный период полураспада – 24 часа, по сравнению с ЛГ – около 60 мин [2–4]. Введенный ЧХГ оказывает устойчивый лютеотропный эффект, который характеризуется образованием множества желтых тел и супер-физиологическими концентрациями эстрадиола и прогестерона. Вследствие длительного периода полураспада уровень ЧХГ возвращается к базальному только через неделю после введения [5].
Указанные выше свойства ЧХГ стали причиной и пусковым фактором развития синдрома гиперстимуляции яичников (СГЯ), что послужило поводом для поиска альтернативного, более безопасного триггера овуляции, которым стал агонист гонадотропин-рилизинг гормона (а-ГнРГ), индуцирующий выброс эндогенных ЛГ и ФСГ [5, 6]. Использование в качестве триггера овуляции а-ГнРГ взамен ЧХГ позволяет снизить риск развития СГЯ. На сегодняшний день причиной этого считается лютеолиз, обусловленный тем, что волна гонадотропинов, индуцированная введением а-ГнРГ, не способна поддержать функционирование желтых тел [7]. ЛГ волна в натуральном цикле характеризуется 3 фазами: восходящим коленом длительностью 14 часов, фазой плато длительностью 14 часов, нисходящим коленом в 20 часов, в сумме около 48 часов [8]. В то же время индуцированная ЛГ волна включает в себя две фазы: короткое восходящее колено (4 часа) и длинное нисходящее колено (20 часов); в общей сложности – 24–36 ч [9]. Следует отметить, что для нормально функционирующего желтого тела ЛГ волна должна длиться не менее 48 часов [10]. При введении а-ГнРГ концентрация ЛГ возвращается к своей базальной линии в день трансвагинальной пункции (ТВП), в то время как концентрация ЧХГ к этому моменту достигает своего пика [11]. Как уже было сказано выше, важную роль играет значительно более длительный период полураспада у ЧХГ, по сравнению с ЛГ.
Впервые использовать а-ГнРГ для финального созревания ооцитов в программе ЭКО предложил Itskovitz и соавт. в 1988 г. [12]. В последующем, при введении а-ГнРГ взамен ЧХГ, многие авторы отметили отсутствие СГЯ у пациенток, составляющих группу риска по развитию этого грозного осложнения (наличие случаев тяжелого СГЯ в анамнезе, пациентки с СПКЯ, высокие уровни преовуляторного эстрадиола) [13].
При дальнейшем изучении этой проблемы было обнаружено отсутствие различий в количестве полученных ооцитов, числе зрелых ооцитов, частоте оплодотворения и числе перенесенных эмбрионов при использовании различных триггеров финального созревания ооцитов [14]. Однако ряд авторов отметили снижение частоты имплантации, клинической беременности и повышение частоты ранних самопроизвольных выкидышей при использовании в качестве триггера а-ГнРГ по сравнению с ЧХГ при стандартной поддержке лютеиновой фазы [13].
Такая низкая частота наступления беременности, вероятно, связана с гормональной недостаточностью лютеиновой фазы стимулированного цикла после введения а-ГнРГ. В 2002 году Fauser и соавт. [5] впервые опубликовали результаты исследования гормонального профиля сыворотки крови женщин, получавших в качестве триггера аГнРГ (трипторелин 0,2 мг, лейпрорелин 0,5 мг) или ЧХГ 10 000 МЕ. Поддержка лютеиновой фазы осуществлялась только препаратами прогестерона (прогестин 50 мг/день), перенос эмбрионов (ПЭ) осуществляли на 2–5-й день после ТВП. Пик эндогенного ЛГ после введения а-ГнРГ (как трипторелина так и лейпрорелина) приходился на 4 часа от введения триггера. Происходило увеличение концентрации ЛГ от 0,9±0,4 МЕ/л до введения триггера овуляции до 130±60 МЕ/мл (P<0,001) при введении трипторелина и до 107±55 МЕ/мл (P<0,001) при введении лейпрорелина. В день ТВП ЛГ снижался до базального уровня – 4,8±2,5 МЕ/л в группе с трипторелином и 2,6±0,4 МЕ/л в группе с лейпрорелином, и оставался низким в течение всей лютеиновой фазы. В сыворотке пациенток получавших ЧХГ, пик его концентрации приходился на 24 часа от введения препарата, соответствовал 240±101 МЕ/л и снижался до 5,0±1,6 МЕ/л через неделю после ПЭ. Уровень ФСГ повышался с 5,8±1,6 МЕ/л до 19,2±5,2 МЕ/л через 8 часов после введения трипторелина и с 5,2±1,6 МЕ/л до 19,7±5,1 МЕ/л после введения лейпрорелина (P<0,001 для обеих групп). В группе с ЧХГ ФСГ изменялся от 5,8±1,6 МЕ/л до 3,4±0,8 МЕ/л (P<0,001) в день ТВП. Сывороточные уровни эстрадиола и прогестерона до дня ТВП были идентичны во всех группах. В день ПЭ концентрации эстрадиола составляли 279±48 пг/мл в группе с трипторелином, 204±30 пг/мл в группе с лейпрорелином, и 609±115 пг/мл в группе с ЧХГ; через неделю после ПЭ – 46±4 пг/мл, 45±9 пг/мл и 490±145 пг/мл соответственно. Уровни прогестерона в день ПЭ составили 7,2±1,7 нг/мл, 8,0±1,5 нг/мл и 58,6±9,6 нг/мл соответственно, а через неделю после ПЭ – 18,0±3,6 нг/мл, 23,2±3,7 нг/мл и 45,9±11,2 нг/мл соответственно. В конце лютеиновой фазы уровни гормонов во всех трех группах были сопоставимы [5].
Также в 2005 году P. Humaidan и соавт. [15] изучили гормональный профиль сыворотки крови пациенток, получавших ЧХГ и а-ГнРГ с последующей модифицированной поддержкой лютеиновой фазы препаратами прогестерона (крайнон 90 мг) и эстрадиола (эстрадиол валерат 4 мг/день), ПЭ производили на 3-и сутки. Обнаружено статистически значимо большее количество зрелых ооцитов в группе пациенток с заменой триггера овуляции (P<0,02), концентрации ЛГ и ФСГ были выше в группе с а-ГнРГ (P<0,001), а концентрации прогестерона и эстрадиола в лютеиновую фазу – статистически значимо ниже в группе с а-ГнГР. Частота клинической беременности была значимо выше в группе с ЧХГ и составила 36%, в то время как в группе с а-ГнРГ- 6% (P<0,002), а частота репродуктивных потерь – значимо выше в группе с а-ГнРГ и составила 79%, в группе с ЧХГ – 4% (P<0,005). Эти результаты послужили началом поиска механизмов коррекции недостаточности лютеиновой фазы после замены триггера овуляции [15].
В 2006 году C. Yding Andersen и соавт. [16] изучили гормональный профиль фолликулярной жидкости при замене триггера овуляции и при введении ЧХГ. В фолликулярной жидкости пациенток, которым вводился а-ГнРГ уровень ФСГ в два раза превосходил таковой в фолликулярной жидкости пациенток с ЧХГ (6,3±0,6 МЕ/л и 3,3±0,2 МЕ/л (P<0,001)), а уровень ЛГ – в четыре раза (11,1±0,5 МЕ/л и 3,6±0,3 МЕ/л (P<0,001)). Однако пониженные уровни гонадотропинов были компенсированы высоким уровнем ЧХГ, достигавшим более 140 МЕ/л. Таким образом, сочетанная ЛГ-ЧХГ активность была выше в группе с ЧХГ. Уровень эстрадиола не отличался в обеих группах (P>0,10), в то время как уровень прогестерона был статистически значимо выше в группе, получавшей ЧХГ (P<0,001)). В группе с а-ГнРГ выявлена отрицательная корреляция между концентрацией прогестерона в фолликулярной жидкости и частотой наступления беременности. По мнению авторов, имплантация не связана с интрафолликулярной средой, а зависит от функционального состояния образованных желтых тел. В группе, получавшей ЧХГ, концентрации ФСГ и ЛГ в фолликулярной жидкости были значительно ниже у женщин с положительным тестом на беременность. Данное исследование показало, что а-ГнРГ индуцирует ЛГ-активность, достаточную для успешного дозревания ооцитов, но слишком низкую для поддержания функции желтых тел и обеспечения полноценной лютеиновой фазы [16].
В настоящее время продолжается дискуссия о наиболее эффективной схеме поддержки лютеиновой фазы после замены триггера овуляции [17].
Цель нашего исследования: изучить динамику концентраций половых гормонов в сыворотке крови и в фолликулярной жидкости у пациенток с высоким риском развития СГЯ при замене триггера овуляции и различных вариантах поддержки лютеиновой фазы.
Материал и методы исследования
В исследование были включены 134 женщины в возрасте от 20 до 39 лет с высоким риском развития СГЯ (концентрация антимюллерова гормона (АМГ) в сыворотке крови более 2,5 нг/мл, наличие более 14 антральных фолликулов, наличие 18 и более фолликулов диаметром более 11 мм в день введения триггера овуляции [18, 19]), прошедших программу ЭКО или ЭКО/ИКСИ с последующим ПЭ в лечебном цикле в период с марта 2013 г. по июль 2014 г. Проведение исследования было одобрено этическим комитетом ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России.
Критериями исключения женщин из исследования были: наличие наружного и внутренного эндометриоза III–IV степени распространения; интерстициальной или субсерозной миомы матки размером более 4 см; гидросальпингса и/или тубоовариального образования по данным УЗИ органов малого таза; пороков развития внутренних половых органов; патозооспермии III–IV степени у супруга; соматических заболеваний, являющихся противопоказаниями для вынашивания беременности и родов.
Отобранные для исследования пациентки были разделены на три группы с учетом введенного триггера овуляции: I группа (n=48), где триггером являлся а-ГнРГ (диферелин) в дозе 0,2 мг; II группа (n=45), где триггером являлся а-ГнРГ (диферелин) в дозе 0,2 мг и ЧХГ (прегнил) в дозе 1500 МЕ; III группа (n=41), где триггером являлся ЧХГ (прегнил) в дозе 10 000 МЕ.
Распределение пациенток по группам осуществлялось методом случайных чисел.
Со 2-го дня менструального цикла и до дня введения триггера овуляции пациенткам вводили индивидуально подобранную дозу рекомбинантного ФСГ (пурегон/гонал) от 112,5 МЕ до 200 МЕ в сутки или человеческого менопаузального гонадотропина (менопур) 75–150 МЕ в сутки. При достижении фолликулами диаметра 14 мм, для предотвращения преждевременного пика ЛГ пациенткам вводился антагонист ГнРГ (цетрореликс 0,25 мг). Триггер овуляции вводили при наличии в яичниках трех и более фолликулов диаметром более 17 мм. ТВП выполнялась через 35–36 часов после введения триггера овуляции. Перенос 1 или 2 эмбрионов осуществляли на 5-е сутки.
Поддержку лютеиновой фазы в группе пациенток с заменой триггера овуляции на а-ГнРГ проводили с первых суток после ТВП фолликулов микронизированным прогестероном (утрожестан) в дозе 600 мг/день и эстрадиолвалератом (прогинова) 4 мг/день. Дополнительно для поддержки лютеиновой фазы вводили 1500 МЕ ЧХГ в день ТВП.
В группе пациенток, получавших в качестве триггера овуляции а-ГнРГ и ЧХГ, для поддержки лютеиновой фазы использовали микронизированный прогестерон (утрожестан) в дозе 600 мг/день и эстрадиол валерат (прогинова) 4 мг/день.
В группе пациенток, получавших ЧХГ для финального дозревания ооцитов, для поддержки лютеиновой фазы использовали микронизированный прогестерон (утрожестан) в дозе 600 мг.
Из пациенток, вошедших в настоящее исследование, отобрали 66 женщин, у которых определили гормональный профиль в фолликулярной жидкости: в I группе – у 23 женщин, во II группе – у 23 женщин, в III группе – у 20 женщин.
Забор периферической крови для определения концентраций ЛГ, эстрадиола и прогестерона осуществляли в день введения триггера овуляции, день ТВП, на 3-и и 5-е сутки после ТВП. На 14-е сутки после ТВП определяли концентрацию β-субъединицы ЧХГ, эстрадиола и прогестерона. Исследовали фолликулярную жидкость, аспирированную из двух первых фолликулов. Полученный материал центрифугировали в течение 10 мин при 3000 об/мин и 40C, аликвотировали и хранили при -800C.
 Содержание ЛГ, эстрадиола и прогестерона в образцах сыворотки крови и фолликулярной жидкости определяли методом твердофазного иммунохемилюминесцентного анализа на анализаторе IMMULITE 2000 с использованием тест-систем: LH, Estradiol, Progesterone (Siemens, США). В образцах фолликулярной жидкости концентрации ЛГ определяли без разведения. Для определения концентрации эстрадиола и прогестерона образцы фолликулярной жидкости были разведены 1:500 коммерческим дилюентом Siemens.
Содержание ЛГ, эстрадиола и прогестерона в образцах сыворотки крови и фолликулярной жидкости определяли методом твердофазного иммунохемилюминесцентного анализа на анализаторе IMMULITE 2000 с использованием тест-систем: LH, Estradiol, Progesterone (Siemens, США). В образцах фолликулярной жидкости концентрации ЛГ определяли без разведения. Для определения концентрации эстрадиола и прогестерона образцы фолликулярной жидкости были разведены 1:500 коммерческим дилюентом Siemens.
Классификацию СГЯ производили согласно критериям Golan и соавт. от 1989 г. [20].
Статистическую обработку данных производили общепринятыми методами вариационной статистики. Данные представлены как среднее ± ошибка среднего (М±m). Значимость наблюдаемых отклонений оценивали с помощью t-критерия Стьюдента с использованием пакета статистического анализа SPSS Statistics 22. Статистически значимыми считали отличия при р<0,05. Непараметрические данные исследованы также с использованием пакета статистического анализа SPSS Statistics 22. Критерий Краскела–Уоллеса считали значимым при значении менее 0,05.
Результаты исследования
Все пациентки, вошедшие в исследование, были сопоставимы по возрасту и индексу массы тела (ИМТ). Средний возраст в I группе составил 30,00±0,54 года, во II группе – 30,97±0,56 года, в III группе – 31,53±0,68 года (р>0,05); ИМТ в I группе – 15,54±1,57, во II группе – 13,96±1,89, в III группе – 15,9±1,68 соответственно (р>0,05).
Также не выявлено статистически достоверных различий в продолжительности стимуляции суперовуляции, которая составила 9,35±0,26 дня в I группе, 9,95±0,24 дня во II группе, 9,74±0,20 дня в III группе (р>0,05) и суммарной дозе гонадотропина: 1489±77 МЕ в I группе, 1552±99 МЕ во II группе, 1619±402 МЕ в III группе (р>0,05). Число фолликулов в день введения триггера овуляции составило: 19,13±0,24 в I группе, 19,40±0,25 во II группе, 19,0±0,31 в III группе (р>0,05); число фолликулов диаметром 17 и более мм – 14,69±0,49, 15,07±0,42 и 15,07±0,41 соответственно (р>0,05).
Среднее число ооцитов на день ТВП во всех группах статистически достоверно не различалось и составило 13,79±0,54 в группе с а-ГнРГ, 13,80±0,71 в группе с а-ГнРГ и ЧХГ и 13,46±0,38 в группе с ЧХГ (р>0,05); из них зрелых ооцитов – 10,56±0,47 в I группе, 11,26±0,55 во II группе и 11,12±0,36 в III группе (р>0,05). Количество бластоцист на день ПЭ составило 6,06±0,45, 5,88±0,47 и 5,42±0,39 соответственно (р>0,05), число бластоцист отличного качества – 4,16±0,35 в I группе, 4,25±0,41 во II группе, 3,9±0,36 в III группе (р>0,05). Вышесказанное позволяет говорить об отсутствии негативного влияния замены триггера овуляции на параметры оо- и эмбриогенеза, что согласуется с данными кокрановского обзора [13].
Частота наступления беременности на ПЭ оказалась статистически значимо выше в I группе по сравнению со II группой и составила 41,7% (n=20) и 20,0% (n=9) соответственно (критерий Краскела–Уоллиса с учетом поправки Бонферрони = 0,024); при сравнении с III группой – 39,0% (n=16) статистически достоверных различий не обнаружено (критерий Краскела–Уоллиса>0,05). При сравнении групп между собой не было выявлено статистически значимых различий по частоте прерывания беременности: 16,7% (n=8) в группе с а-ГнРГ, 6,7 % (n=3) в группе с двойным триггером (одномоментным введением а-ГнРГ и ЧХГ), 7,3% (n=3) в группе с ЧХГ (критерий Краскела–Уоллиса >0,05).
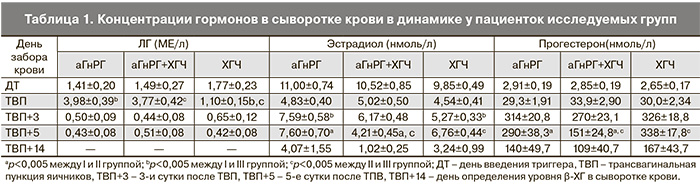
При сравнении полученных значений гормонов по группам (табл. 1) выявлена статистически значимая разница в концентрации ЛГ в день ТВП, которая оказалась выше в группах с заменой триггера овуляции при сравнении каждой из них с группой ЧХГ и составила 3,98±0,3 МЕ/л, 3,77±0,42 МЕ/л против 1,10±0,15 МЕ/л (pI/III=0,000, pII/III=0,000).
Концентрации эстрадиола статистически значимо различались на 3-и сутки после ТВП между I и III группой и составили 7,59±0,58 нмоль/л в группе с а-ГнРГ и 5,27±0,33 нмоль/л группе с ЧХГ (p=0,002); статистически достоверных различий со II группой не выявлено (p>0,05). На 5-е сутки после ТВП статистически значимо различались, как концентрации эстрадиола, так и концентрации прогестерона между II и III группой: концентрация эстрадиола на 5-е сутки после ТВП составила 4,21±0,45 нмоль/л и 6,76±0,44 нмоль/л соответственно (p=0,000), а концентрация прогестерона была существенно ниже в группе с одномоментным введением а-ГнРГ и ЧХГ по сравнению с III группой: 151±24,8 нмоль/л и 338±17,8 нмоль/л соответственно (p=0,000).
При сравнении группы с а-ГнРГ и группы с одномоментным введением а-ГнРГ и ЧХГ также выявлена статистически значимая разница в концентрации эстрадиола и прогестерона на 5-е сутки после ТВП. Концентрация эстрадиола была выше в I группе и составила 7,60±0,70 нмоль/л (p=0,000), концентрация прогестерона также оказалась выше -290±38,3 нмоль/л (p=0,003). Следует отметить, что концентрация прогестерона на 5-е сутки после ТВП в группе с а-ГнРГ сопоставима с таковой в группе, где в качестве триггера овуляции был использован ЧХГ (p>0,05). Концентрации половых гормонов в день ТВП+14 между группами достоверно не различались (p>0,05). Статистически значимой корреляции между уровнями изучаемых гормонов в сыворотке крови и клиническими исходами выявлено не было.
В фолликулярной жидкости отмечена статистически значимо большая концентрация ЛГ в группах с а-ГнРГ по сравнению с группой с ЧХГ (pI/III=0,001; pII/III=0,000); концентрация эстрадиола в фолликулярной жидкости во всех группах была идентична (p>0,05); уровень прогестерона был статистически значимо выше в III группе по сравнению с I и II группами (pI/III=0,001; pII/III=0,003) (табл. 2). Корреляции между уровнями изучаемых гормонов в фолликулярной жидкости и клиническими исходами выявлено не было.
Обсуждение
Проведенное исследование показало, что использование каждого из представленных триггеров овуляции приводит к определенным особенностям люцерновой фазы. Так, в день ТВП обнаружено статистически значимое увеличение концентрации ЛГ в сыворотке крови в группах с заменой триггера овуляции по сравнению с группой с ЧХГ, что связано с выбросом эндогенного ЛГ в ответ на введение а-ГнРГ; однако эта разница компенсируется высокими уровнями ЧХГ у пациенток III группы, что подтверждаются исследованием проведенным P. Humaidan в 2005 году [15, 17]. При одномоментно ведении а-ГнРГ и ЧХГ происходит резкое падение уровня эстрадиола на 5-е сутки после ТВП, а также статистически значимое снижение концентрации прогестерона в сыворотке крови. Возможно, это связано с тем, что ЧХГ вводится одномоментно с а-ГнРГ, и его период полураспада, составляющий более 24 часов, совпадает с длительностью индуцированной ЛГ волны. По истечению данного срока сочетания ЛГ-ЧХГ активность в крови падает, что приводит к регрессу желтого тела и снижению его функциональной активности. Это, в свою очередь, проявляется низкими уровнями эстрадиола и прогестерона в люцерновую фазу, начиная с 5-х суток после ТВП. Статистически значимо высокая концентрация эстрадиола на 3-и сутки после ТВП в группе с а-ГнРГ по сравнению с группой с ЧХГ, возможно, связана с тем, что по мере угасания индуцированной ЛГ волны, вводится инъекция ЧХГ в день ТВП; таким образом, поддерживается сочетания ЛГ-ЧХГ активность в сыворотке крови. Также важно отметить, что люцерновая фаза I и II группы дополнена препаратами эстрадиола. При сравнении концентрации прогестерона в группе с а-ГнРГ и в группе с ЧХГ на 5-е сутки (день ПЭ), статистически значимой разницы не выявлено, что позволяет говорить о том, что замена триггера овуляции с последующей инъекцией ЧХГ в день ТВП позволяет достичь тех же уровней эстрадиола и прогестерона в люцерновую фазу, которые наблюдаются при использовании ЧХГ в качестве триггера овуляции. В пользу этого свидетельствует тот факт, что частота наступления беременности на ПЭ в группе с а-ГнРГ статистически значимо не отличается от таковой в группе с ЧХГ, однако статистически значимо ниже в группе с одномоментный введением а-ГнРГ и ЧХГ по сравнению с группой с а-ГнРГ; при этом частота прерывания беременности во всех группах статистически достоверно не отличается.
Следует отметить, что уровни прогестерона в группах с заменой триггера овуляции в нашей работе гораздо выше, чем в предыдущих исследованиях [5, 15]. Вероятно, это связано с модифицированной поддержкой люцерновой фазы.
При изучении концентрации гормонов в фолликулярной жидкости обращает на себя внимание статистически значимо высокая концентрация прогестерона в группе с ЧХГ по сравнению с обеими группами, где использовались а-ГнРГ. Что касается концентрации ЛГ в фолликулярной жидкости, то она статистически значимо выше в группах с заменой триггера овуляции, при этом наиболее значимого уровня достигает в группе с одномоментный введением а-ГнРГ и ХГЧ. Эти данные согласуются с данными, полученными в исследовании C. Yding Andersen, и показывают, что ЧХГ оказывает большую поддержку формирующимся желтым телам [16].
Однако мы не выявили корреляции между параметрами фолликулярной жидкости и частотой наступления беременности.
Заключение
На сегодняшний день нет исследований, при которых изучался гормональный профиль при одномоментно введении а-ГнРГ и ЧХГ в день триггера овуляции, с которыми можно было бы сопоставить полученные данные.
Независимо от триггера овуляции, эмбриологические показатели были идентичны во всех исследуемых группах, что согласуется с литературными данными об отсутствии негативного влияния замены триггера на параметры эмбриогенез [14].
На основании полученных результатов можно сделать вывод о том, что модифицированная поддержка люцерновой фазы эффективно координирует ее недостаточность после замены триггера овуляции, что позволяет проводить эффективную профилактику развития СГЯ, не оказывая влияния на частоту наступления беременности.



