Применение высоких технологий в неонатологии привело к повышению показателей выживаемости среди недоношенных новорожденных, в особенности с очень низкой массой тела (ОНМТ) и экстремально низкой массой тела (ЭНМТ) при рождении. Наиболее частыми проявлениями различного рода патологических процессов в раннем неонатальном периоде у недоношенных детей являются дыхательные нарушения, наличие которых может свидетельствовать как о манифестации раннего неонатального сепсиса (РНС), так и о развитии врожденной пневмонии или тяжелого респираторного дистресс-синдрома (РДС). Ранняя диагностика врожденной инфекции применительно к данной категории новорожденных продолжает представлять значительные трудности как в силу неспецифического характера выявляемых у глубоконедоношенных детей клинических симптомов, быстрой скорости генерализации инфекционного процесса, так и ввиду отсутствия высокочувствительных и специфичных биологических маркеров [1]. В связи с этим изучение генетической предрасположенности к реализации врожденных инфекций у новорожденных детей может способствовать лучшему пониманию механизмов реализации патофизиологических процессов, ускорить диагностический поиск, предложить новые пути лечения, усовершенствовать меры профилактики.
Целью исследования явилось изучение генетических полиморфизмов, ассоциированных с риском заболевания и особенностями течения врожденных инфекций у новорожденных с учетом их гестационного возраста.
Материалы и методы
В исследование были включены 379 новорожденных с дыхательными нарушениями, потребовавшими проведения респираторной терапии. Все дети родились в «НМИЦ АГП им. В.И. Кулакова» Минздрава России и проходили лечение в ОРИТН в период с января 2013 по декабрь 2015 г. Критерии невключения: наличие врожденных пороков развития и выраженная задержка внутриутробного развития (масса тела при рождении менее 3-го процентиля по стандартным антропометрическим шкалам).
Родителями новорожденных было подписано добровольное информированное согласие на участие детей в исследовании. Данное исследование было одобрено этическим комитетом ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
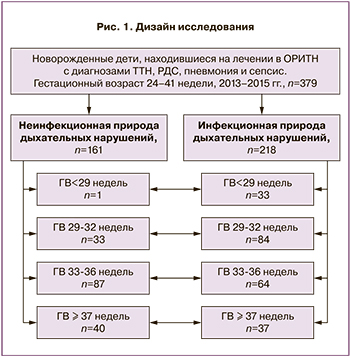 Всем новорожденным с целью диагностики врожденной инфекции проводилось клинико-лабораторное обследование, включавшее в себя рентгенографию органов грудной полости, анализ гемокультуры, клинический анализ крови с подсчетом абсолютного числа лейкоцитов, тромбоцитов, нейтрофилов и вычисление нейтрофильного индекса, контроль уровня белков острой фазы воспаления (С-реактивный белок) в первые сутки жизни. По результатам проведенного клинико-лабораторного и инструментального обследования в возрасте 72 ч жизни делалось заключение о наличии или отсутствии у детей врожденной инфекции [2, 3]. Дифференциальный диагноз между врожденной пневмонией, сепсисом, РДС, транзиторным тахипноэ новорожденных (ТТН) проводили в соответствии с общепринятыми критериями [4, 5]. В зависимости от генеза дыхательных нарушений (ДН) дети, вошедшие в исследование, были разделены на две основные группы: в 1-ю группу вошли дети с неинфекционной природой ДН: (ТТН) или респираторным дистресс-синдромом (РДС) (n=161), во вторую – новорожденные с инфекционной природой ДН: врожденной пневмонией или ранним неонатальным сепсисом (РНС) (n=218). Дизайн исследования приведен на рис. 1.
Всем новорожденным с целью диагностики врожденной инфекции проводилось клинико-лабораторное обследование, включавшее в себя рентгенографию органов грудной полости, анализ гемокультуры, клинический анализ крови с подсчетом абсолютного числа лейкоцитов, тромбоцитов, нейтрофилов и вычисление нейтрофильного индекса, контроль уровня белков острой фазы воспаления (С-реактивный белок) в первые сутки жизни. По результатам проведенного клинико-лабораторного и инструментального обследования в возрасте 72 ч жизни делалось заключение о наличии или отсутствии у детей врожденной инфекции [2, 3]. Дифференциальный диагноз между врожденной пневмонией, сепсисом, РДС, транзиторным тахипноэ новорожденных (ТТН) проводили в соответствии с общепринятыми критериями [4, 5]. В зависимости от генеза дыхательных нарушений (ДН) дети, вошедшие в исследование, были разделены на две основные группы: в 1-ю группу вошли дети с неинфекционной природой ДН: (ТТН) или респираторным дистресс-синдромом (РДС) (n=161), во вторую – новорожденные с инфекционной природой ДН: врожденной пневмонией или ранним неонатальным сепсисом (РНС) (n=218). Дизайн исследования приведен на рис. 1.
Антропометрические данные недоношенных новорожденных оценивались с помощью центильных таблиц Fenton, доношенных – с помощью центильных таблиц Всемирной организации здравоохранения (ВОЗ).
Принимая во внимание результаты ранее проведенных нами исследований, выявивших особенности цитокинового статуса и экспрессии мРНК у новорожденных на разных сроках гестации [6–8], в данном исследовании дети основных групп были разделены на 4 подгруппы (24–28 недель, 29–32 недели, 33–36 недель, 37 и более недель) (рис. 1).
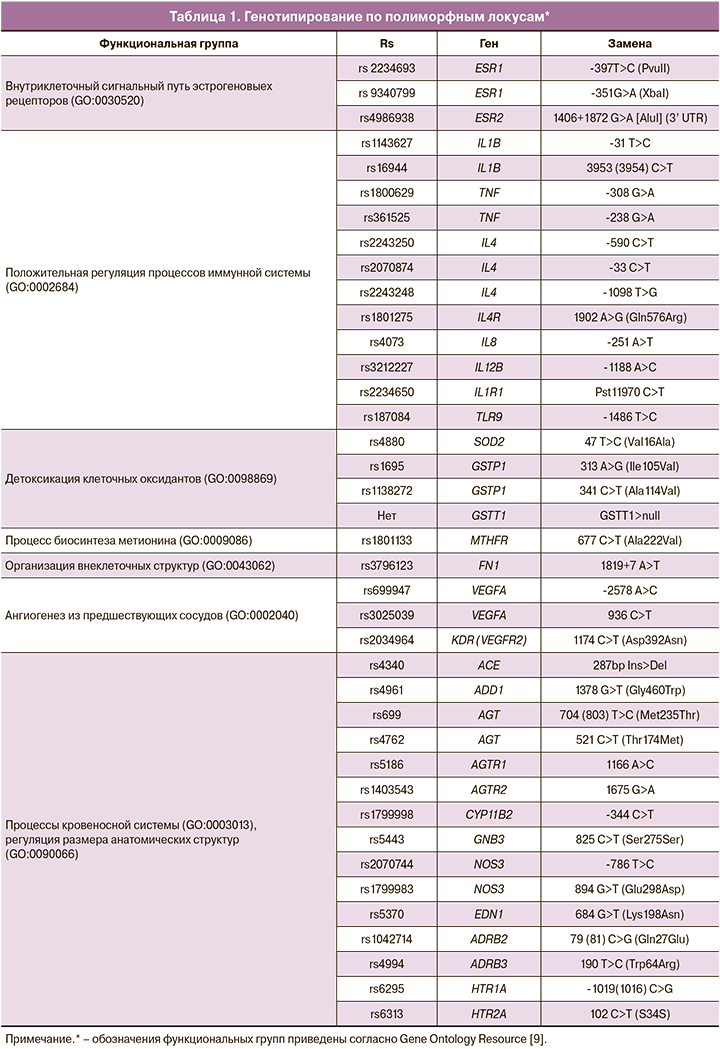
У всех новорожденных детей, включенных в исследование, взятие крови осуществлялось в пробирки с консервантом ЭДТА в первые сутки жизни одновременно с проведением обязательного клинико-лабораторного обследования при поступлении новорожденных в ОРИТН до начала специфической терапии. Генотипирование проводили по полиморфным локусам (обозначения функциональных групп приведены согласно Gene Ontology Resource [9]), приведенным в табл. 1.
Генотипирование выполняли методом ПЦР с анализом кривых плавления модифицированным методом «примыкающих проб» (adjacent probes, kissing probes) с помощью диагностических тест-систем производства ООО «НПО ДНК-Технология», Россия.
ДНК для генотипирования выделяли из лимфоцитов периферической крови, взятой с ЭДТА в качестве антикоагулянта с помощью комплекта реагентов «Проба-ГС-генетика» ООО «НПО ДНК-Технология», Россия. Метод основан на использовании для лизиса клеток сильного хаотропного агента с последующей сорбцией нуклеиновых кислот на твердом носителе, последовательных отмывках сорбента и элюции ДНК с сорбента. Объем образцов после выделения составил 100 мкл. Концентрация ДНК, определенная на ДНК-минифлуориметре (Ноеfer, США), составляла в среднем 50–100 мкг/мл
ПЦР, определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-964 (ООО «НПО ДНК-Технология», Россия).
Статистическую обработку проводили с использованием пакета программ SPSS Statistics version 23 (IBM, США). Проверку нормальности распределения оценивали с помощью критерия Колмогорова–Смирнова с поправкой Лиллиефорса, Шапиро–Уилка, а также показатели эксцесса и асимметрии. Во всех подгруппах отмечалось распределение, отличное от нормального, для выявления статистической значимости различий между группами использовали непараметрический U-критерий Манна–Уитни. Результаты представлены как медиана (Ме) и интерквартильный размах 25–75-й процентили, минимальное и максимальное значения (min-max). Различия считали достоверными при уровне значимости p<0,05. Для оценки корреляционных взаимосвязей использовали коэффициент корреляции Спирмана. При анализе номинальных переменных (частоты) применялись критерий χ2 Пирсона с поправкой Йетса, и точный критерий Фишера при малом количестве наблюдений.
Результаты и обсуждение
Клиническая характеристика пациентов приведена в табл. 2.
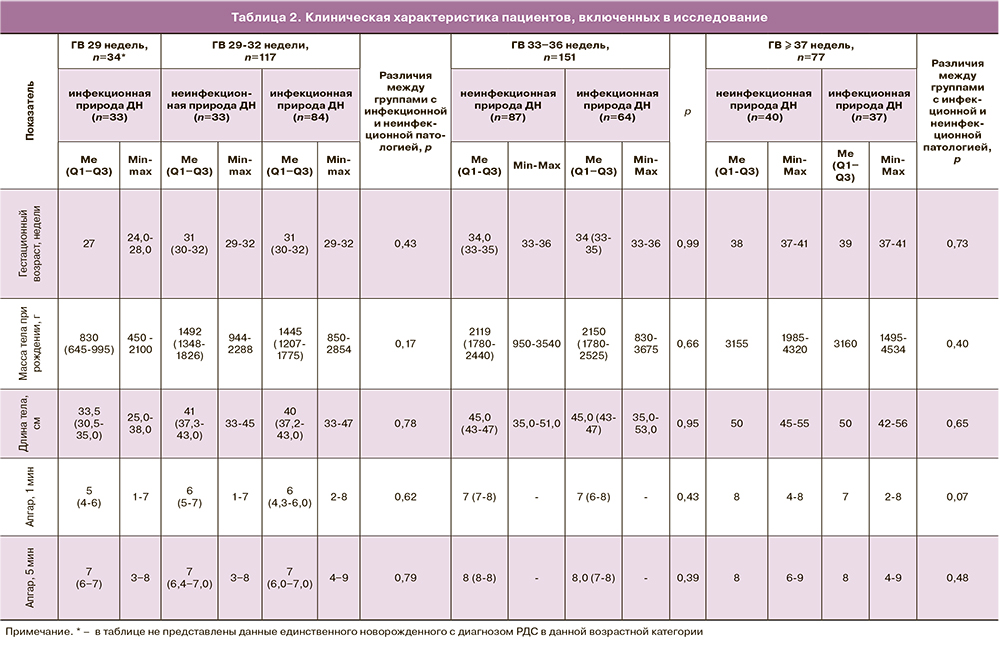
Следует отметить, что среди новорожденных, родившихся на сроке менее 29 недель, основной причиной развития ДН являлись врожденная пневмония и РНС (1 ребенок в подгруппе неинфекционной природы ДН).
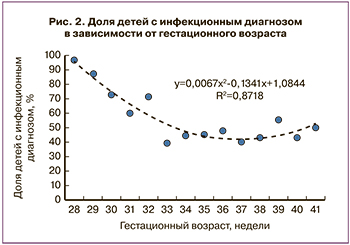 Как продемонстрировано на рис. 2, среди обследованных новорожденных до 33 недель гестации преобладали дети с РНС и врожденной пневмонией. В целом по мере возрастания ГВ пациентов увеличивалась частота респираторных нарушений неинфекционного генеза. Начиная с 33 недель беременности и далее, частота инфекционных причин дыхательных нарушений у новорожденных оставалась на относительно постоянном уровне.
Как продемонстрировано на рис. 2, среди обследованных новорожденных до 33 недель гестации преобладали дети с РНС и врожденной пневмонией. В целом по мере возрастания ГВ пациентов увеличивалась частота респираторных нарушений неинфекционного генеза. Начиная с 33 недель беременности и далее, частота инфекционных причин дыхательных нарушений у новорожденных оставалась на относительно постоянном уровне.
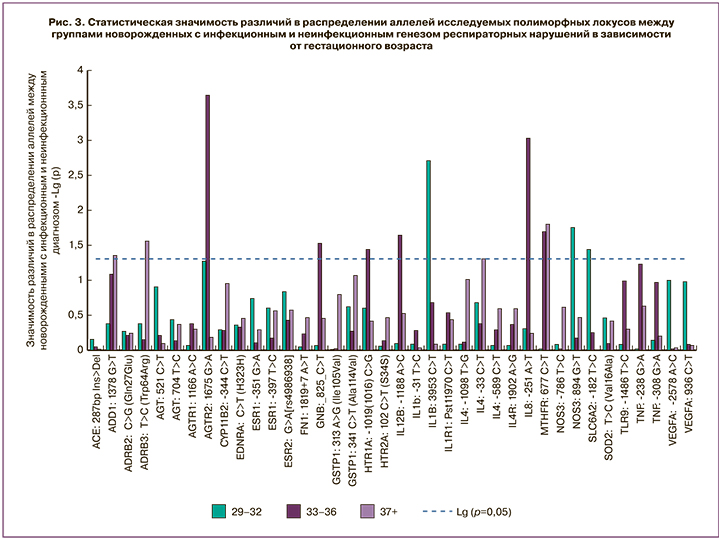
В ходе проведенного исследования были выявлены статистически значимые различия между распределением аллельных вариантов ряда генов у новорожденных, родившихся на различных сроках гестации в зависимости от инфекционной и неинфекционной причины респираторных нарушений (рис. 3): на сроке 29–32 недель гестации различия наблюдались для генов NOS3 и IL1b, на сроке 33–36 недель – для генов AGTR2, IL4R, IL8, GNB3, HTR2A, на сроке 37 недель и более – IL8, ADD1, ADRB3.
Полученные данные позволили нам заключить, что с развитием инфекционных заболеваний ассоциированы полиморфизмы генов различных функциональных групп. С целью понимания возможной роли указанных выше генов нами проведен анализ данных литературы.
Ген NOS3. В своей работе мы анализировали распределение аллелей и генотипов двух полиморфных локусов гена NOS3 (эндотелиальная синтетаза азота, eNOS): 894 G>T в 7 экзоне и -786 T>C в промоторе, ассоциированных с изменением продукции оксида азота (NO). Неравновесного сцепления для этих локусов нами не выявлено. NOS3 постоянно экспрессируется эпителием дыхательных путей, его уровень повышается при физической нагрузке, стрессе, хронической гипоксии. Оксид азота известен как сильный эндогенный агент, принимающий участие в процессах ангиогенеза, иммунорегуляции и выработки поверхностно-активных веществ, вызывающий расслабление гладкой мускулатуры в стенках кровеносных сосудов, повышающий проницаемость эндотелия и подавляющий адгезию тромбоцитов к стенке сосуда. Снижение уровня продукции эндогенного оксида азота вызывает вазоконстрикцию, в результате которой повышается артериальное давление. Оксид азота также участвует в стимуляции нейронов, в передаче нейронами импульсов, в регуляции деятельности желудочно-кишечного тракта и органов дыхательной и мочеполовой систем, в формировании обонятельной памяти, синаптических связях (передаче нервного импульса) и в ангиогенезе (образовании новых кровеносных сосудов).
Вопрос о роли полиморфизма гена NOS3 в генезе дыхательных нарушений y новорожденных в отечественной литературе в настоящий момент остается практически неосвещенным. В единственном исследовании, ранее проведенном Ионовым О.В. и соавт. [10], удалось выявить ассоциацию аллеля С полиморфного локуса гена NOS3: -786 с тяжелым проявлением дыхательных нарушений и потребностью в проведении высокочастотной осцилляторной вентиляция легких (ВЧОВЛ) у новорожденных с врожденной пневмонией (р=0,028). NOS3, участвуя в реакциях окислительного стресса и синтезе NO, оказывающего релаксирующее действие на эндотелий, по-видимому, влияет на эндотелиальную проницаемость, вызывая изменение вентиляционно-перфузионных соотношений, что приводит к потребности в жестких параметрах респираторной терапии.
В эксперименте установлено, что наличие аллеля С в положении -786 промотора гена NOS3 приводит к снижению его активности, а замена G на T, приводящая к замене аминокислоты Glu на Asp в кодоне 298 в зрелом белке, повышает восприимчивость NOS3 к ферментативному расщеплению in vitro, что может привести к снижению продукции NO [11]. В нашем исследовании наблюдалось статистически значимое повышение частоты носительства аллелей, связанных со снижением NO, среди детей с инфекционно-воспалительными нарушениями, рожденных в сроке 29–32 недели гестации (для -786 T>C 62,5% против 34,6%: ОШ=3,15 ( 1,21–8,17), р= 0,02 и для 894 G>T 53,1% против 30,8%: ОШ=2,55 (0,97–6,71), р=0,05 согласно аутосомно-доминантной модели). На более поздних сроках гестации статистически значимых различий в распределении аллелей и генотипов NOS3 не наблюдалось.
Ген IL1b кодирует синтез провоспалительного цитокина, который вырабатывается активированными макрофагами и является важным медиатором воспалительного ответа, участвует в различных клеточных процессах, включая пролиферацию, дифференцировку и апоптоз клеток. Известно, что уровень Il1b повышается при развитии РНС. В ходе исследования уровня экспрессии мкРНК hsa-miR-92a-3p (потенциально регулирующих трансляцию IL-1β) у новорожденных менее 32 недель было выявлено повышение мкРНК в образцах венозной крови при инфекционном генезе дыхательных нарушений (p=0,004) по сравнению c показателями детей с ТТН и РДС [8].
В данном исследовании анализировали распределение аллелей двух функционально значимых полиморфизмов: -31 T>C (rs1143627) и 3953 C>T (rs16944). Аллели -31T и 3953С ассоциированы с повышенной продукцией IL1b, а гаплотип T>C характеризуется максимальной транскрипционной активностью гена.
В ходе данного исследования выявлены статистически значимые различия по распределению генотипов и аллелей полиморфного локуса: -31 T>C у недоношенных детей 29–32 недель гестации с врожденной инфекцией по сравнению с группой ТТН/РДС. Носительство низкопродуцирующего аллеля С гена значительно чаще отмечалось у новорожденных с сепсисом и врожденной пневмонией, чем у новорожденных с РДС (68,8% против 38,5% соответственно, ОШ=3,52; 95% ДИ: 1,36–9,11, р=0,008) согласно аутосомно-доминантной модели наследования. При этом, хотя статистически значимых различий в распределении аллелей и генотипов второго полиморфного локуса нами выявлено не было, частота встречаемости низкопродуцирующего гаплотипа C>T у пациентов с инфекционными осложнениями была в 2,8 раз выше, чем при РДС (4,8% против 1,7%), но в силу редкой встречаемости указанного гаплотипа данные различия не достигали статистической значимости.
В нашей более ранней работе, посвященной экспрессии генов цитокинов у недоношенных детей, родившихся на 25–32 неделях гестации, в первые сутки жизни в буккальном соскобе и венозной крови, отмечена тенденция к снижению экспрессии мРНК-генов врожденного иммунитета Il1b у недоношенных детей с реализацией врожденной инфекции [6]. Данные результаты могут быть следствием врожденной недостаточности иммунной системы, проявляющейся склонностью к инфекционным осложнениям у глубоко недоношенных детей.
В то же время по данным исследования Abu-Maziad A. и соавт. [12], проведенного в США и включавшего 535 недоношенных (ГВ 23–36 недель), ассоциации раннего неонатального сепсиса с полиморфизмом гена Il1b не выявлено. Однако следует учитывать тот немаловажный факт, что в приведенной работе не анализировался гестационный возраст обследованных пациентов. В нашем исследовании также не выявилось статистически значимых различий в распределении аллелей и генотипов гена IL1B после 32 недели гестации.
Ген AGTR2 кодирует рецепторы 2-го типа ангиотензина 2 и, соответственно, является одним из ключевых генов ренин-ангиотензиновой системы (РАС). Роль каскада реакций РАС широко изучена в процессах регуляции артериального давления, почечной и сердечно-сосудистой деятельности, однако в настоящее время признано, что РАС имеет несколько точек приложения в организме, в том числе и в ряде легочных процессов. Ангиотензин 2, основной гормон РАС, in vitro показал себя как активатор воспаления, повышающий синтез провоспалительных цитокинов и хемокинов через АТ1 и АТ2 рецепторы с последующей активацией NF-κB пути (нуклеарный фактор каппа бета). NF-κB – белковый комплекс, регулирующий транскрипцию ДНК, продукцию цитокинов, и выживаемость клеток. NF-κB играет ключевую роль в регулировании иммунного ответа на инфекцию.
Основные эффекты ангиотензина 2: индуцирует апоптоз эндотелиальных клеток легочных артерий и альвеолярных эпителиальных клеток; играет важную роль в фиброзном ответе на острое повреждение легких, вызывая трансформацию экспрессии фактора роста -α в легких, способствует пролиферации фибробластов; запускает гипертрофический и гиперпластический рост гладкомышечных клеток сосудов (миоинтимальная гиперплазия); регулирует экспрессию NO-синтетазы [13, 14].
Следовательно, вполне вероятно, что РАС активно участвует в развитии повреждения легких с нарушением функции легких. По данным последних исследований, отсутствие AGTR2 и селективное его «выключение» улучшает показатели легочной функции в моделях на животных. Таким образом, AGTR2 рассматривается как точка возможного терапевтического приложения при сниженной легочной функции у пациентов с муковисцидозом, воспалительными процессами в легких и формированием бронхолегочной дисплазии (БЛД).
В результате нашего исследования выявлено, что аллель Т ассоциирован с инфекционными осложнениями у новорожденных 29–32 и 33–36 недель гестации. Суммарная генотипическая частота аллеля Т в этих возрастных группах составила 58% при сепсисе против 36% при РДС (р=0,00002). При этом наблюдаемая ассоциация может быть описана как аутосомно-доминантной (р=0,003), так и аутосомно-рецессивной (р=0,002) моделью наследования. После 36 недель гестации частота аллеля Т в группах статистически значимо не различалась (54 и 58% соответственно).
Ген Il4R кодирует рецептор регуляторного цитокина Il4, являющегося основным регулятором сдвига Th1-Th2 и играющего важную роль в предотвращении избыточного воспалительного процесса. В нашем исследовании найдена статистически значимая ассоциация носительства аллеля G c инфекционным генезом дыхательных нарушений только у недоношенных ГВ 33–36 недель (ОШ=3,55 95% ДИ 1,59–7,93, р<0,001). Протективная роль и полиморфизм гена Il4R описаны в нескольких работах, посвященных изучению некротизирующего энтероколита (НЭК) у новорожденных [15]. The interleukin-4 (IL-4, полиморфизм гена IL4R ассоциирован с бронхиальной астмой. В нашем исследовании носительство аллеля G статистически значимо чаще встречалось среди новорожденных в возрасте 33–36 недель гестации с инфекционными причинами дыхательной недостаточности (53,2% против 24,2% соответственно, р=0,002; ОШ=3,55 (1,59–7,93) согласно аутосомно-доминантной модели наследования). В других возрастных группах различия не достигали статистической значимости, хотя сходная тенденция отмечалась у новорожденных в возрасте 29–32 недели: частота носительства аллеля G составила 40,6% против 30,8%.
Ген IL8 кодирует интерлейкин 8 (ИЛ-8) – один из основных провоспалительных цитокинов, синтезируемых макрофагами, эпителиальными и эндотелиальными клетками, содержащими Toll-like рецепторы. Повышение уровня Il8 приводит к миграции вышеуказанных клеток в очаг поражения, где происходит стимуляция фагоцитоза [17, 18]. В клетках–мишенях вызывает реакции, необходимые для фагоцитоза, такие как увеличение внутриклеточного Са2+, экзоцитоза и респираторного взрыва. Также Il8 известен как индуктор ангиогенеза.
Полиморфизм -251 А>Т расположен в промоторной области, аллель A ассоциирован с низким уровнем IL8 Установлено, что ИЛ-8 вызывает хемотаксис и активацию нейтрофилов при бактериальных инфекциях, что способствует дальнейшей выработке цитокинов.
По данным исследования врожденного иммунного ответа у новорожденных детей первых суток жизни, показано, что выраженный подьем уровня IL8 в ответ на инфекционные состояния наблюдался только у новорожденных 25–31 недели гестации. В более позднем гестационном возрасте уровень IL8 не изменялся при воспалительных процессах [7]. Генетически обусловленная склонность к недостаточности цитокинового ответа проявляется снижением устойчивости к инфекционным агентам. В настоящем исследовании выявлена ассоциация низкопродуктивного генотипа А/А с развитием воспалительных респираторных нарушений у недоношенных новорожденных ГВ 33–36 недель (ОШ=2,56; 95% ДИ 1,09–6,02; р=0,02). Примечательно, что у доношенных новорожденных этот же низкопродуктивный генотип ассоциирован с невоспалительными респираторными нарушениями (ОШ=4,76 (1,18–19,15); р=0,02), что может отражать переключение механизмов цитокиновой регуляции иммунного ответа перед родами.
Ген HTR2A кодирует рецептор серотонина 2A, широко исследуется в настоящее время в неврологии и психиатрии как генетический маркер, ассоциированный с развитием обсессивно-компульсивных расстройств и шизофрении [19]. У новорожденных этот ген ранее не исследовался. В ходе данной работы выявлена ассоциация генотипа 102 С/С с реализацией врожденной инфекции в подгруппе ГВ 33–36 недель (ОШ=2,35 (1,07–5,16), р=0,03). В других возрастных группах данная ассоциация не прослеживалась.
Ген GNB3 кодирует гуанин-нуклеотид-связывающий белок, который участвует в дифференцировке лимфобластов и фибробластов, пролиферативной активности, внутриклеточной передаче сигналов α2-адренергического рецептора [20]. Замена С на Т в 9 экзоне в позиции 825 приводит к альтернативному сплайсингу и синтезу укороченного на 41 аминокислоту варианта белка. Аллель 825Т у больных артериальной гипертонией связан с повышением пролиферативной активности и повышенной вазоконстрикцией [21]. Публикаций, касающихся исследований полиморфизмов данного гена у новорожденных, мы не обнаружили. В ходе нашего исследования выявлена ассоциация редкого генотипа Т/Т с дыхательными нарушениями неинфекционного генеза. Примечательно, что доля носителей этого генотипа среди новорожденных с ТНТ/РДС была высокой во всех обследованных группах, но наиболее выраженная ассоциация наблюдалась на ранних сроках (ОШ=8,22 (0,81–83,04), р=0,04 на ГВ 29–33 недели и ОШ=2,92 (0,92–9,28), р=0,058 после 33 недель гестации).
Ген ADD1 кодирует альфа-аддуктин, который является белком цитоскелета и участвует в передаче сигнала внутри клетки и может взаимодействовать с другими мембранными и скелетными белками, отвечающими за транспорт ионов через клеточную мембрану. Аддуктины регулируют динамику актина, который обуславливает барьерную функцию эндотелия. Эндотелий сосудов, выстилающий внутреннюю поверхность кровеносных сосудов, точно контролирует прохождение растворенных веществ, макромолекул, белков плазмы и медиаторов воспаления и, следовательно, обеспечивает избирательный барьер между кровью и окружающей тканью. При воспалительных состояниях происходит образование межклеточных разрывов и повышение проницаемости сосудов. Аддуктины являются ключевыми регуляторами процесса полимеризации актина, они также контролируют миграцию клеток и образование межклеточных контактов. По данным последних исследований, аддуктин участвует в формировании целостности эндотелиального барьера и модулирует Ca2+-зависимую реорганизацию укрепляющих адгезионных узлов между клетками, контролируя межклеточную проницаемость. С аллелем 1378T (460Trp) у взрослых пациентов ассоциирована более высокая чувствительностью к изменениям натриевого баланса, что предполагает предрасположенность к артериальной гипертензии [22, 23]. В нашем исследовании дети с врожденной пневмонией и РНС значительно чаще, чем дети с РДС и ТТН, являлись носителями аллеля 1378Т гена ADD1 при доношенном сроке беременности (ОШ= 3,08; 95% ДИ 1,06–8,94; р= 0,036).
Ген ADRB3 кодирует β3-адренергический рецептор (β3-AR, ADRB3), являющийся важным компонентом симпатической нервной системы, который регулирует процессы липолиза и термогенеза, ангиогенеза и вазорелаксации. При активации рецептора происходит повышение локального липолиза и, соответственно, производства энергии, что является патогенетическим звеном множества состояний. Эндотелиальные β3-AR вызывают вазорелаксацию коронарных артерий посредством влияния на выработку оксида азота. Замена 190 T>C (Trp64Arg) приводит к снижению активности аденилилциклазы в ответ на действие ряда агонистов, включая эндогенные катехоламины, адреналин и норадреналин [24]. Полиморфизм данного гена опосредованно связывают с развитием эссенциальной артериальной гипертензии и высокой физической выносливостью [25]. У новорожденных исследования полиморфизмов данного гена ранее не проводили. В нашем исследовании носительство аллеля С ассоциировано с развитием инфекционных осложнений у доношенных новорожденных (ОШ= 4,69 (1,29–17,07), р=0,01 согласно аутосомно-доминантной модели наследования. У новорожденных меньшего гестационного возраста статистически значимых различий в распределении аллелей и генотипов по данному полиморфному локусу выявлено не было.
Кроме того, нами был выполнен предварительный анализ метаболических путей, включающих гены с выявленными статистически значимыми различиями между распределением аллельных вариантов. Анализ проведен с использованием сервиса Gene Ontology [9]. В результате анализа показано, что гены NOS3 и IL1b, для которых различия наблюдались на сроке 29–32 недель, совместно задействованы в процессах адаптации гладкой мускулатуры (GO:0014805, р=6,1×10–8) и сигнальном пути, опосредованном липополисахарилами (GO:0031663, р=2,9×10–6). Для остальных двух групп генов, соответствующих более поздним срокам гестации, не удается выявить статистически значимых общих биологических процессов. Возможной причиной этого может являться малая выборка проанализированных генов. В то же время, данный факт может являться также и отражением значительного количества факторов и биологических аспектов, влияющих на подверженность новорожденных детей врожденным инфекциям.
Заключение
Проведенное нами исследование явилось одним из шагов на пути изучения генетических предикторов реализации врожденных инфекций у новорожденных детей различного гестационного возраста, в том числе с ОНМТ и ЭНМТ при рождении. Продемонстрирована вовлеченность в развитие инфекционных осложнений не только генов врожденного иммунитета, но и регуляторов энергетического обмена и сосудистого тонуса, что свидетельствует о сложном механизме развития инфекционных состояний у новорожденных. Показано, что в различном гестационном возрасте с развитием инфекционно-воспалительных заболеваний ассоциированы разные гены (на сроке 29–32 недель гестации – NOS3 и IL1b, на сроке 33–36 недель – AGTR2, IL4R, IL8, GNB3, HTR2A, на сроке 37 недель и более – IL8, ADD1, ADRB3), что, по-видимому, отражает процесс созревания иммунной системы. Развитие молекулярно-генетических технологий и дальнейшие исследования могут способствовать развитию новых подходов в диагностике и лечении врожденной инфекции.



