Эндометриоз, являясь одной из актуальных проблем гинекологии, представляет собой патологию, характеризующуюся эстроген-зависимым ростом вне матки ткани, подобной эндометрию, которая встречается у 7–10% женщин. Сложное заболевание, обычно сопровождающееся хронической болью в тазу, болезненными менструациями, усталостью и часто бесплодием, оказывает существенное влияние на качество жизни женщины. Основными критическими механизмами, приводящими к возникновению эндометриоза, считаются избыточная продукция эстрадиола, резистентность к прогестерону, увеличение продукции провоспалительных цитокинов и недостаточная способность иммунных клеток подавлять воспалительный ответ [1]. Диагноз генитального эндометриоза обычно устанавливается при лапароскопической оценке малого таза, а лечение бывает комплексным с применением гормональной терапии и хирургического вмешательства. Многие вопросы, касающиеся патогенеза и терапии эндометриоза, остаются недостаточно изучены, хотя выполнено большое количество научных и клинических исследований [2–4].
Развитие эндометриоза в настоящее время связывают с комплексом патологических изменений, ассоциирующихся с генетическими/эпигенетическими, гормональными, иммунологическими и другими факторами. У женщин с эндометриозом выявлены изменения в содержании разных популяций иммунных клеток и в их функциональной активности, свидетельствующие об активном участии иммунной системы в патогенезе эндометриоза [5–9]. Клетки и гуморальные факторы системы врожденного иммунитета, который направлен на поддержание и сохранение гомеостаза, выполняют эффекторную и регуляторную функции, а также участвуют в запуске адаптивного иммунитета.
Функциональная направленность клеток определяется их фенотипом. Так, субпопуляции NK-клеток, в зависимости от интенсивности экспрессии тех или других рецепторов, проявляют преимущественно регуляторную способность (CD56brightCD16dim\--NK-клетки) или цитотоксическую активность (CD56dim\-CD16bright-NK-клетки) [10–12]. Регуляторной способностью обладают экспрессирующие Т-клеточный рецептор (TCR), в основном αβTCR, NKT-клетки (CD3+CD56+16+-NK-клетки) и субпопуляция, экспрессирующая γδTCR (CD56γδTCR-NK-клетки).
Находящиеся в кровотоке и перитонеальной жидкости моноциты, являются предшественниками макрофагов, которые играют важную роль при воспалении, травмах и развитии неопластических процессов [13–16]. В зависимости от интенсивности экспрессии молекул CD14 и CD16 выделяют две основные субпопуляции: CD14highCD16low (или CD14++CD16-, классическая) и CD14+/lowCD16high (или CD14+CD16++, неклассическая), а также промежуточную субпопуляцию (CD14highCD16+, или CD14++CD16+) [17, 18].
Основные исследования при эндометриозе клеток врожденного иммунитета, таких как NK-клетки и моноциты/макрофаги, посвящены изучению их функциональных свойств. Показано ослабление процесса фагоцитоза у перитонеальных макрофагов, понижение цитотоксической активности NK-клеток, положительно коррелирующих с тяжестью заболевания [7, 19]. Однако у женщин с эндометриозом недостаточно охарактеризованы фенотипические характеристики и соотношение субпопуляций этих клеток после хирургического лечения эндометриоза.
Цель данного исследования состояла в изучении особенностей фенотипа клеток врожденного иммунитета у женщин с эндометриозом до и через 6 месяцев после комплексной терапии, включившей хирургическое лечение.
Материалы и методы
В проспективное исследование были включены пациентки, наблюдавшиеся и оперированные в гинекологическом отделении ФГБУ «НМИЦ АГП им. В.И. Кулакова» МЗ РФ. Группу исследования составили 40 пациенток с наружным генитальным эндометриозом (НГЭ), подтвержденным данными УЗИ и/или МРТ, а также впоследствии обзорным гистологическим исследованием удаленных очагов эндометриоза для верификации диагноза. Женщины с эндометриозом разделены на 2 группы в соответствии со степенью распространения поражения: 12 пациенток с I–II степенью распространения эндометриоза (ЭМ-1) и 28 пациенток с III–IV степенью (ЭМ-2). 15 пациенток (7 практически здоровых фертильных женщин и 8 женщин с неполной внутриматочной перегородкой, без воспалительных и пролиферативных гинекологических заболеваний, с отсутствием генитального эндометриоза, что подтверждено лапароскопически), составили контрольную группу (К).
Критерии включения в группы исследования: возраст пациенток 18–45 лет; подтвержденный диагноз НГЭ; подписанное информированное согласие на участие в исследовании. Критерии исключения: пациентки со злокачественными новообразованиями, острыми воспалительными заболеваниями органов малого таза, с тяжелой сопутствующей экстрагенитальной патологией.
Иммунологическое исследование клеток периферической крови (ПК) и перитонеальной жидкости (ПЖ) проводилось у всех женщин перед оперативным удалением эндометриоидных очагов. Через 6 месяцев после оперативного вмешательства проведено повторное исследование фенотипа клеток периферической крови у 15 пациенток (4 женщины из группы ЭМ-1 и 11 женщин из группы ЭМ-2).
Кровь для анализа у женщин забирали натощак из локтевой вены перед оперативным вмешательством на 13–24-й день цикла и через 6 месяцев после него. Перитонеальную жидкость забирали во время операции сразу после лапароскопического вхождения в брюшную полость. Фенотипирование лимфоцитов осуществляли методом проточной цитометрии с помощью моноклональных антител (мАт), (Becton Dickinson и eBioscience, США), меченных FITC, PE, АРС. Лимфоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью мАт к СD45 (Dako, Дания). Оценивалось содержание субпопуляций NK-клеток (СD56+СD16+), моноцитов (СD14+СD16+). Т-регуляторные клетки (Тreg) определяли, как клетки, экспрессирующие Т-клеточный рецептор типа γδ (TCRγδ), а также как Тreg с фенотипом CD4+CD25+CD127low/-. Анализ проводили на проточном цитофлуориметре Navios (Beckman Coulter, США) с использованием программы Kaluza.
Статистический анализ
Статистическая обработка данных проводилась с использованием пакета Microsoft Office Excel 2007 и программы MedCalc v16.8. Проверку гипотезы о нормальном распределении осуществляли, используя критерии Колмогорова–Смирнова и Шапиро–Уилка. Данные представлены средней арифметической величиной и стандартным отклонением (M (SD)). Для оценки значимости различий в случае нормального распределения признаков использовали t-критерий Стьюдента. Различия считали значимыми при р<0,05. В случае отклонения распределения количественных признаков от нормального данные были представлены как медиана и интерквартильный размах (Ме (Q1; Q3)). В случае отклонения распределения количественных признаков от нормального проверку статистических гипотез об отсутствии межгрупповых различий количественных признаков в нескольких группах осуществляли с помощью непараметрического критерия Краскела–Уоллиса, при попарных сравнениях использовали U-критерий Манна–Уитни с поправкой Бонферрони для множественных сравнений или критерий Вилкоксона. Качественные признаки представлены как в абсолютных (n), так и в относительных (%) величинах, для их сравнения был использован точный тест Фишера. Различия считали значимыми при p<0,05.
Результаты
При изучении анамнеза, жалоб, перенесенных и имеющихся на момент осмотра экстрагенитальных и гинекологических заболеваний, оперативных вмешательств и наличия или отсутствия наследственной патологии получены результаты, представленные в таблицах 1 и 2.
Статистически значимых различий по возрасту, индексу массы тела, среднему возрасту менархе, времени менструации между группами пациенток с эндометриозом разной степени распространенности и с контрольной группой не было выявлено. Показатели общего анализа крови свидетельствуют о значимом увеличении содержания лейкоцитов, снижении доли лимфоцитов и увеличении соотношения нейтрофилов и лимфоцитов в группах пациенток с эндометриозом по сравнению с контрольной группой.
Женщины с эндометриозом обеих групп часто жаловались на боли внизу живота, не связанные с менструацией, при отсутствии подобных жалоб в контрольной группе. Болезненные менструации значимо чаще имели место в группе ЭМ-1, диспареуния отмечалась чаще среди пациенток группы ЭМ-2, по сравнению с контрольной группой (табл. 2).
По количеству беременностей в анамнезе значимых различий между исследуемыми группами пациенток не выявлено. Количество родов было ниже в обеих группах по сравнению с контролем, но значимо отличалась только ЭМ-2 группа. В ЭМ-2 группе также чаще было диагностировано бесплодие.
Значимых различий по частоте случаев ожирения, наличия аллергических заболеваний между группами не наблюдалось. Онкологические заболевания у близких родственников пациенток отмечены у пациенток с эндометриозом обеих групп при отсутствии в контрольной группе, однако различие было незначимым. Существенных различий в частоте заболеваний органов дыхательной, сердечно-сосудистой, мочевыделительной системы и заболеваний желудочно-кишечного тракта между группами не наблюдалось. Перенесенные в прошлом операции по поводу эндометриоза отмечены в обеих группах пациенток с эндометриозом без значимых различий.
Во время гинекологического осмотра до оперативного лечения болезненность при пальпации придатков матки у пациенток с ЭМ III–IV степени распространения отмечалась чаще, чем у пациенток с ЭМ I–II степени (у 28/28 (100%) и у 5/12 (41,6%), соответственно, р=0,001), также более часто у женщин из ЭМ-2 группы при пальпации крестцово-маточных связок (в 24/28 (81,5%) случаев против 3/12 (25%), р<0,001).
Всем женщинам с эндометриозом было проведено хирургическое лечение. Показаниями к оперативному лечению являлись боли внизу живота различной локализации и характера, болезненные менструации, боли при половом контакте, а также отсутствие наступления беременности в течение более 1 года регулярной половой жизни без контрацепции. В 100% случаев операция проводилась лапароскопическим доступом.
При оперативном вмешательстве было обнаружено, что наиболее часто поверхностные поражения локализовались на брюшине (у 8/12 (66,6%) и у 28/28 (100%) пациенток в ЭМ-1 и ЭМ-2 группах соответственно, р=0,005) и на крестцово-маточных связках (в первой группе в 4/12 (33%) случаях, во второй – в 17/28 (61,1%) случаях, р>0,05), на кишечнике и в ретроцервикальной области у женщин группы ЭМ-1 (у 5/12 (41,6) и у женщин группы ЭМ-2 в 11/28 (40,7%) случаях (р>0,05). В группе ЭМ-1 у 3/12 (25%) женщин при лапароскопии обнаружены эндометриоидные кисты только на одном яичнике, а в группе ЭМ-2 у 8/28 (29,6%) женщин на одном и у 12/28 (44%) на двух яичниках (р<0,05).
Кроме оперативного удаления очагов эндометриоза комплексная терапия включала медикаментозную, направленную на нормализацию баланса гормонов и подавление воспаления. Пребывание в стационаре в среднем составило 5,8 (1,2) дня в зависимости от объема и тяжести проведенного оперативного лечения. В качестве послеоперационного лечения проводилась антибактериальная, симптоматическая и, при необходимости, антианемическая терапия. В рамках восстановительных послеоперационных мер также применялась физиотерапия (импульсные токи низкой частоты, магнитные и электромагнитные поля низкой частоты в режиме магнитного поля частотой 50 Гц и индуктивности от 35 мТл, 1–3 раза в день, до 20 на курс). По показаниям на следующем этапе восстановительного лечения назначали бальнеотерапию – общие радоновые и йодобромные ванны (средняя концентрация радона от 40 до 200 нКи/л (1,5–7,5 кБк/л), концентрация йода не менее 10 мг/дм3 и брома не менее 25мг/дм3).
После оперативного лечения, в зависимости от объема операции, возраста и репродуктивных планов, 55,5% пациенткам проводилась гормональная терапия: в 33,3% случаев в группе ЭМ-1 и в 66,6% в группе ЭМ-2. Препаратами выбора явились агонисты гонадотропин-рилизинг-гормона (аГнРГ) 3,6 мг каждые 28 дней; диеногест в дозе 2 мг. В зависимости от распространенности процесса и наличия сочетанной патологии аГнРГ назначались на 3–6 месяцев, а диеногест на 6–12 месяцев.
Степень влияния оперативного, гормонального и антивоспалительного лечения оценивалась через 6 месяцев после плановой хирургической операции. Проведено клиническое обследование 27 женщин: 9 женщин в группе ЭМ-1 и 18 женщин в группе ЭМ-2 (катамнез, бимануальное гинекологическое исследование, ультразвуковое исследование органов малого таза). Наличие спаечного процесса в малом тазу выявлено у 2/9 (22,2%) пациенток в группе ЭМ-1 и у 6/18 (33,3%) в группе ЭМ-2 (р>0,05).
Рецидив заболевания был установлен при возобновлении клинической симптоматики у 3 (11,1%) из 27 обследованных женщин. Пациентки предъявляли жалобы на периодические боли внизу живота и болезненные менструации. При ультразвуковом исследовании выявлялись очаги НГЭ.
После проведенного лечения у 6 (22,2%) женщин наступила беременность: в группе ЭМ-1 у 1/9 (11,1%) и в группе ЭМ-2 – у 5/18 (27,7%). При этом в 16,6% случаев самостоятельно и у 83,3% женщин с помощью программы ВРТ.
Отдаленные результаты органосохраняющего хирургического лечения НГЭ отслежены в течение от 6 до 24 месяцев у 39 пациенток. После проведенного лечения беременность наступила у 10/39 (26%) женщин, в 2 (16,6%) случаях самостоятельно и у 8/39 (20%) женщин с помощью ЭКО.
Проведено исследование исходного содержания субпопуляций лимфоцитов (NK-клеток, TCRγδ и Тreg) и моноцитов (классические, неклассические и промежуточные) в периферической крови и перитонеальной жидкости у женщин в контрольной группе (n=15) и у пациенток с эндометриозом (n=15), которым повторно проведено иммунологическое исследование клеток того же фенотипа в периферической крови через 6 месяцев после операции.
Средние показатели исходного содержания лейкоцитов и соотношения нейтрофилов и лимфоцитов (НФ/ЛФ) в периферической крови женщин исследуемой группы, также, как и в общей группе, были увеличены по сравнению с контролем (9,7 (6,9;12,4) против 6,3(5,1;9,1), р=0,029, и 3,4 (2,07;5,01) против 1,9(1,68;2,55), р=0,022, критерий Манна–Уитни). При этом имело место уменьшение доли лимфоцитов и отсутствие изменения в содержании моноцитов. Соотношение НФ/ЛФ в периферической крови пациенток с эндометриозом увеличено почти в полтора раза при сравнении с контролем.
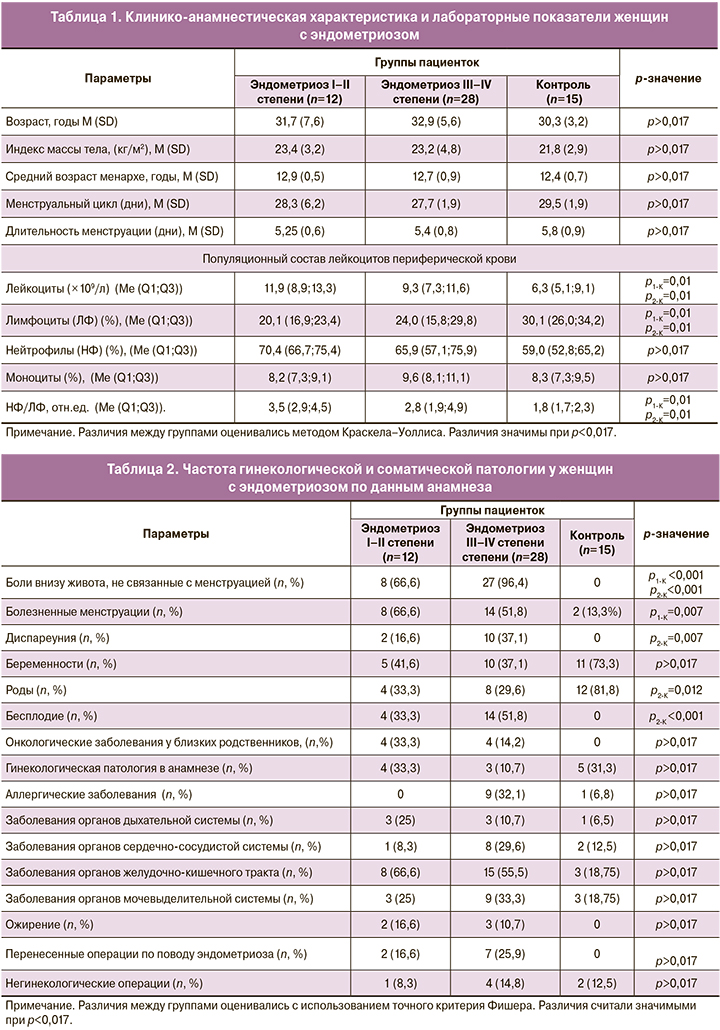
При сравнительном исследовании исходного содержания субпопуляций NK-клеток, TCRγδ и Тreg в периферической крови и перитонеальной жидкости у исследуемых женщин с эндометриозом и в контрольной группе до оперативного вмешательства получены результаты, представленные на рисунке 1.
Различия между группами оценивались по критерию Краскелла–Уоллеса. Различия считали значимыми при р<0,017 .
 Выявлены значимые различия между периферической кровью и перитонеальной жидкостью по содержанию субпопуляций NК-клеток: цитотоксических CD56dimCD16bright- и регуляторных CD56TCRγδ-клеток. В перитонеальной жидкости доля CD56dimCD16bright-клеток была меньше, чем в периферической крови как у женщин с эндометриозом (р<0,001), так и в контрольной группе (р<0,01). Доля CD56TCRγδ-клеток в перитонеальной жидкости женщин с эндометриозом была больше, чем в периферической крови (р=0,005). Различий в содержании субпопуляций NК-клеток в периферической крови женщин с эндометриозом по сравнению с контрольной группой не отмечено.
Выявлены значимые различия между периферической кровью и перитонеальной жидкостью по содержанию субпопуляций NК-клеток: цитотоксических CD56dimCD16bright- и регуляторных CD56TCRγδ-клеток. В перитонеальной жидкости доля CD56dimCD16bright-клеток была меньше, чем в периферической крови как у женщин с эндометриозом (р<0,001), так и в контрольной группе (р<0,01). Доля CD56TCRγδ-клеток в перитонеальной жидкости женщин с эндометриозом была больше, чем в периферической крови (р=0,005). Различий в содержании субпопуляций NК-клеток в периферической крови женщин с эндометриозом по сравнению с контрольной группой не отмечено.
Значимых различий между содержанием субпопуляции TCRγδ-клеток в периферической крови и перитонеальной жидкости у женщин с эндометриозом не обнаружено, но наблюдается уменьшение их доли в перитонеальной жидкости по сравнению с контролем (р=0,005). Между содержанием Т-регуляторных клеток с фенотипом CD4+CD25+CD127low/- также не было различий в периферической крови и перитонеальной жидкости женщин с эндометриозом, но имело место уменьшение содержания в периферической крови по сравнению с контролем (р=0,028).
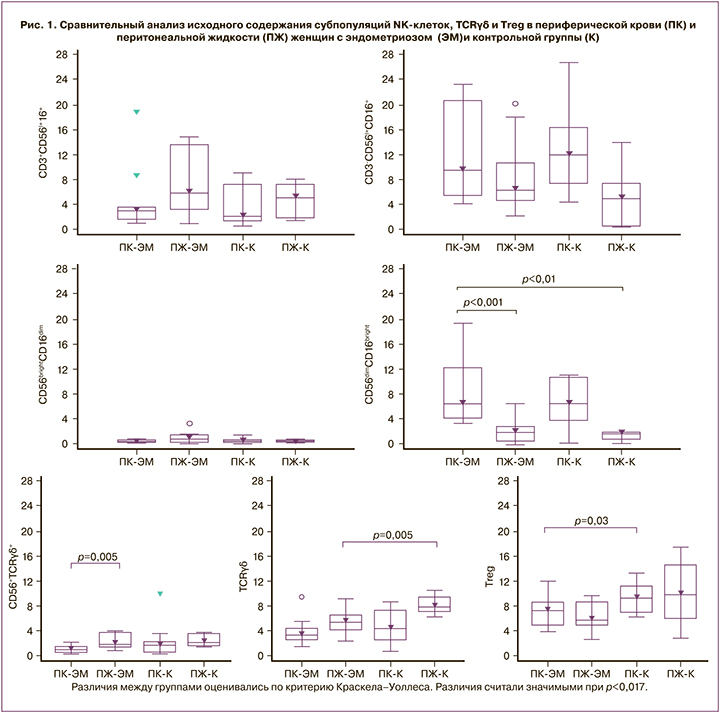
На рисунке 2 представлены результаты сравнительного исследования содержания субпопуляций моноцитов в периферической крови и перитонеальной жидкости исследуемых женщин с эндометриозом и в контрольной группе до оперативного вмешательства.
Различия между группами оценивались по критерию Краскелла–Уоллеса. Различия считали значимыми при р<0,017.
В периферической крови обеих групп женщин наблюдается преобладание субпопуляции классических моноцитов (р<0,001 при эндометриозе и р=0,0001 в контроле), а в перитонеальной жидкости промежуточных (р=0,002 при эндометриозе и р<0,007 в контроле). При этом в периферической крови женщин с эндометриозом наблюдалось снижение содержания субпопуляций классических (р=0,017) и увеличение неклассических (р=0,009) моноцитов, по сравнению с контрольной группой. В перитонеальной жидкости не выявлено значимых различий в субпопуляционном составе моноцитов между основной и контрольной группами.
Через 6 месяцев после хирургической операции, включенной в комплексную терапию, было исследовано содержание популяций лейкоцитов, субпопуляций NK-клеток, регуляторных лимфоцитов и моноцитов периферической крови и проведено сравнение с исходными данными в группе оперированных по поводу эндометриоза женщин, результаты которого представлены в таблице 3.
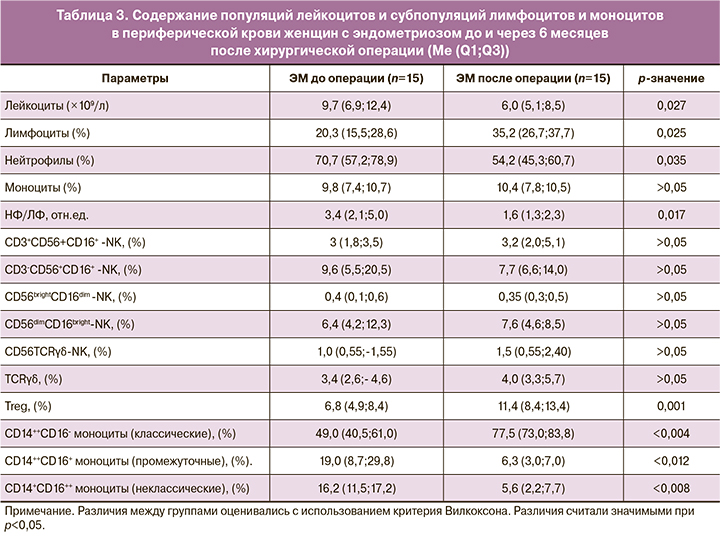
Представленные данные свидетельствуют о значимом снижении количества лейкоцитов, снижении доли нейтрофилов и увеличении доли лимфоцитов по сравнению с исходным содержанием в периферической крови оперированных пациенток.
Анализ показывает, что к этому времени комплексное лечение, включающее оперативное вмешательство, привело к нормализации содержания лейкоцитов и соотношения нейтрофилов и лимфоцитов, поскольку не определялось различий с данными контрольной группы (6,0 (5,1;8,5) и 6,3 (5,1;9,1) р=0,743; 1,6 (1,3;2,3) и 1,8 (1,7;2,3) р=0,303 соответственно, данные из таблиц 1 и 3).
Значимых различий в содержании исследованных субпопуляций NK-клеток и субпопуляции регуляторных TCRγδ-клеток после операции по сравнению с исходным содержанием не выявлено. Однако наблюдается увеличение субпопуляции Тreg-клеток и изменение соотношения субпопуляций моноцитов, поскольку увеличивается доля классических моноцитов при снижении долей промежуточных и неклассических моноцитов, что может свидетельствовать о снижении интенсивности воспалительного процесса.
Обсуждение
Характерными клинико-анамнестическими особенностями для исследованной нами группы женщин с эндометриозом были следующие: не связанные с менструацией тазовые боли у большинства пациенток; болезненные менструации; диспареуния; снижение количества беременностей и родов, бесплодие почти у каждой второй пациентки; болезненность при пальпации придатков матки и крестцово-маточных связок. Значимых различий между группами с менее и более тяжелыми стадиями заболевания по частоте встречаемости большинства этих симптомов не наблюдалось. Это подтверждает устоявшееся мнение, что точность постановки диагноза зависит от оперативного вмешательства и морфологического исследования для подтверждения эндометриоидной структуры выявленных поражений. С желанием избежать оперативного вмешательства для постановки диагноза эндометриоза связаны постоянные поиски неинвазивных диагностических и прогностических маркеров.
Обследование пациенток через полгода после оперативного удаления эндометриоидных очагов, расположенных в брюшной полости, и проведенного послеоперационного комплексного лечения с применением гормональной, антибактериальной, симптоматической терапии и, при необходимости, физиотерапевтических процедур выявило значительное снижение количества жалоб на периодические боли внизу живота, болезненные менструации, нарушение менструального цикла, диспареунию. После проведенного лечения у 22,2% женщин наступила беременность. Однако у 11% пациенток отмечены симптомы рецидива.
В периферической крови женщин исследуемой группы исходно выявлена явная тенденция к увеличению общего содержания лейкоцитов по сравнению с контролем (р=0,058) и значимое увеличение нейтрофильно-лимфоцитарного индекса (р=0,022), что может свидетельствовать о наличии воспалительного процесса при эндометриозе. В литературе имеются неоднозначные сведения о результатах оценки популяций лейкоцитов и различные мнения о возможности использования увеличенного индекса соотношения нейтрофилов и лимфоцитов в качестве диагностического маркера при эндометриозе. Есть данные как об отсутствии изменения содержания популяций лейкоцитов и соотношения их при эндометриозе [20], так и сопоставимые с нашими результатами данные об увеличении количества нейтрофилов и соотношения их с лимфоцитами [21]. По мнению авторов, эти данные позволяют рекомендовать использование нейтрофильно-лимфоцитарного индекса в качестве дополнительного диагностического показателя при эндометриозе III и IV степени распространения.
При исследовании через 6 месяцев после комплексного лечения определялось снижение количества лейкоцитов в периферической крови по сравнению с исходным содержанием (р<0,01, табл. 2). Нормализация содержания лейкоцитов и нейтрофильно-лимфоцитарного индекса происходит, в основном, за счет уменьшения содержания нейтрофилов, что может свидетельствовать в пользу снижения интенсивности воспалительного процесса при эндометриозе.
Анализ содержания субпопуляций NК-клеток показал, что в перитонеальной жидкости и у женщин с эндометриозом и в контрольной группе по сравнению с содержанием в периферической крови определялось меньше цитотоксических CD56dimCD16bright-клеток и больше CD56TCRγδ-клеток, обладающих регуляторной активностью (рис. 1). Различий в относительном содержании субпопуляций NК-клеток в периферической крови женщин с эндометриозом в сравнении с контрольной группой до операции не выявлено. После комплексного лечения изменений не было обнаружено ни в сравнении с контролем, ни в сравнении с исходными значениями. По-видимому, вклад NК-клеток в патогенез эндометриоза объясняется в большей степени нарушением функциональной активности, а не изменением их количества или субпопуляционного состава. Предполагается, что именно нарушение функции этих клеток, в частности, цитотоксической, приводит к облегчению выживания, имплантации и пролиферации клеток эндометрия в брюшной полости [7].
Содержание субпопуляций TCRγδ-клеток и Т-регуляторных клеток с фенотипом CD4+CD25+CD127low/- в периферической крови и перитонеальной жидкости женщин значимо не различалось. При сравнении с контрольной группой наблюдается уменьшение доли TCRγδ-клеток в перитонеальной жидкости, а доля CD4+CD25+CD127low/- Тreg имеет тенденцию к уменьшению в периферической крови, что может свидетельствовать о снижении их регуляторной функции (р=0,028). Наши результаты предполагают важную роль в патогенезе эндометриоза нарушения регуляции иммунного ответа, ассоциированного с Тreg-клетками. После комплексного лечения значимых изменений в содержании субпопуляции TCRγδ-клеток в периферической крови не происходило, тогда как доля Тreg-клеток увеличивалась, достигая уровня контроля (табл. 3).
Полученные данные позволяют сделать вывод о том, что нарушение в соотношении регуляторных и цитотоксических субпопуляций в большей степени проявляется на локальном уровне и значительно меньше отражается на системном уровне (рис. 1). Перитонеальная жидкость представлена комплексом растворимых факторов и клеточных компонентов, обеспечивающих иммуносупрессивное и стимулирующее влияние на эндометриоидные поражения. При эндометриозе в брюшной полости увеличивается количество клеток, продуцирующих факторы, определяющие межклеточные взаимодействия, регуляцию процессов апоптоза и пролиферацию всех типов клеток [10, 22]. Увеличение содержания Тreg-клеток после оперативного лечения может отражать усиление механизмов самоограничения воспаления.
Определение у женщин с эндометриозом относительного количества моноцитов не выявило различий в их содержании ни в периферической крови, ни в перитонеальной жидкости, но наблюдались изменения в соотношении субпопуляций моноцитов, наиболее выраженные в периферической крови (рис. 2). В периферической крови имеет место преобладание субпопуляции классических моноцитов, а в перитонеальной жидкости – промежуточных и неклассических моноцитов. Наблюдаемое снижение содержания классических, увеличение неклассических и явная тенденция к увеличению доли промежуточных моноцитов в периферической крови женщин с эндометриозом, по сравнению с контрольной группой, ассоциируется с наличием воспалительного процесса или опухолевого роста [13, 15, 17, 23, 24]. Последнее представляет интерес в связи с данными о значительном увеличении этих клеток в периферической крови женщин с раком яичников [18].
Снижение количества классических моноцитов происходит вследствие перемещения их в ткани, где они дифференцируются в макрофаги или дендритные клетки, что имеет важное значение для роста, развития и васкуляризации эндометриоидных очагов. Макрофаги, воспринимая скопление эктопических эндометриальных клеток как повреждение ткани, активируют программы, ведущие к выживанию эктопических клеток и васкуляризации тканей [25]. При системных воспалительных процессах происходит перераспределение субпопуляций моноцитов в крови. Уменьшается доля классических моноцитов, и пропорционально увеличивается количество промежуточных и неклассических моноцитов. Изменения в соотношении субпопуляций моноцитов позволяют судить о выраженности воспалительного процесса. По-видимому, выявленное нами изменение соотношения субпопуляций при эндометриозе, связано с хроническим воспалительным процессом, показатели которого при комплексном лечении нормализуются, что наблюдается при исследовании через полгода после хирургического удаления эндометриоидных поражений.
Заключение
Результаты исследования свидетельствуют о том, что у женщин с эндометриозом в периферической крови происходит увеличение общего количества лейкоцитов, доли нейтрофилов и нейтрофильно-лимфоцитарного индекса, снижение доли Т-регуляторных клеток и классических моноцитов. Изменения в содержании регуляторных и цитотоксических субпопуляций натуральных киллерных клеток в большей степени проявляется на локальном уровне и в меньшей степени отражено на системном: в перитонеальной жидкости выше содержание регуляторных субпопуляций и ниже – цитотоксических, а в периферическом кровотоке – наоборот. Сравнительное исследование содержания и соотношения субпопуляций лимфоцитов и моноцитов периферической крови женщин с эндометриозом до и после комплексного лечения, включающего оперативное вмешательство, выявило тенденцию к нормализации исследованных показателей на фоне улучшения клинической картины, в том числе выражающейся в исчезновении болевого синдрома.



