Хронический эндометрит (ХЭ) – это стойкий воспалительный процесс, приводящий к появлению выраженных морфологических и функциональных изменений в ткани с нарушением ее основных функций [1–5].
Распространенность ХЭ в общей популяции составляет 7–11%, среди пациенток с бесплодием она возрастает до 70–87% [4–7]. По данным ряда авторов, у женщин с подтвержденным трубно-перитонеальным фактором бесплодия ХЭ верифицируется в 68% [8, 9], с привычным невынашиванием беременности – в 60%, а при неудачных попытках ЭКО – в 42–86,7% случаев [10, 11]. Заболевание имеет доброкачественное течение, в связи с чем, по мнению Park H.J., его диагностика важна только у пациенток с нарушением репродуктивной функции [6].
По механизму развития ХЭ представляет собой хроническое продуктивное воспаление интерстициальной ткани [1, 12, 13]. Возникающие при этом изменения ткани связаны именно с избыточностью бактериальной флоры [2, 14]. Длительная бессимптомная персистенция возбудителей в ткани приводит к изменению не только ее структуры, но и функции с нарушением пролиферации, циклической трансформации и ангиогенеза [1, 14–16]. Как типовой патологический процесс, ХЭ является самоподдерживающейся системой, в основе которой лежит дисбаланс в продукции иммунокомпетентных клеток и провоспалительных цитокинов [15–17].
Изучение состояния иммунитета эндометрия и возможностей его коррекции путем проведения экзогенной цитокинотерапии явилось областью научного интереса в нашем исследовании.
Материалы и методы
Для достижения поставленной цели работа была спланирована по типу когортного проспективного исследования и соответствовала международным стандартам качественной клинической практики и принципам Хельсинкской декларации. Набор пациенток проводился на базе консультативно-диагностического отделения родильного дома при ГКБ № 40 Департамента здравоохранения города Москвы в период 2018–2020 гг. Были сформированы основная (n=83) и контрольная (n=40) группы.
Критериями включения в основную группу были: возраст 25–40 лет; ранее выявленный ХЭ; отсутствие инфекционного и неинфекционного патологического процесса во влагалище и шейке матки, внутриматочных манипуляций минимум 12 недель, эндокринной патологии и иммунодефицита.
Критериями исключения были: возраст до 25 и более 40 лет; миома матки, аденомиоз, пороки развития матки; наличие соматической и онкологической патологии; инфекции, передающиеся половым путем в настоящее время и в течение предыдущих 2–3 месяцев; наличие внутриматочных вмешательств в течение предыдущих 12 недель; отказ от подписания информированного добровольного согласия.
Критериями включения в контрольную группу явились: возраст 20–35 лет, отсутствие беременностей, инфекционных и неинфекционных гинекологических заболеваний, внутриматочных вмешательств и соматической патологии.
У всех пациенток основной группы до включения в исследование был диагностирован ХЭ и проведен стандартный курс антибиотикотерапии. В ходе работы пациентки основной группы были разделены на две подгруппы. В 1-й подгруппе терапия проводилась в течение 20 дней, во 2-й – 40 дней. С лечебной целью использовали препарат «Суперлимф» (25 ЕД, белково-пептидный комплекс свиных лейкоцитов), зарегистрированный как иммуномодулятор с противовирусным и противомикробным действием, по 1 свече во влагалище.
Возраст пациенток основной группы был в пределах 25–40 лет. В 1-й подгруппе в среднем он составил 33,5±2,7 года, во 2-й подгруппе – 34,2±1,6 года. В контрольной группе средний возраст был 25,2±2,1 года. В структуре экстрагенитальной патологии у всех женщин существенное место занимали заболевания органов желудочно-кишечного тракта (27,9, 30 и 20% соответственно), органов мочевыделительной (13, 10 и 4%) и дыхательной систем (15, 12 и 5%).
Средний возраст менархе в основной группе был 12,7±1,1 года, в контрольной группе – 12,1±2,4 года. Продолжительность менструального цикла была 28,3±2,6 и 27,4±3,3 дня соответственно. Среди гинекологических заболеваний преобладали эктопия шейки матки (32,5, 27,5 и 22,5%) и кандидозный вагинит (48,8, 45 и 50%). У каждой 5-й пациентки из основной группы в анамнезе был полип эндометрия. Внутриматочные вмешательства суммарно отмечались у 39,5% женщин 1-й подгруппы и у 42,5% – 2-й. У всех пациенток с первичным бесплодием отмечены внутриматочные вмешательства (полип эндометрия, гиперпластический процесс эндометрия). Длительность бесплодия составляла от 1,5 до 9 лет, в среднем – 3±0,7 года. В основной группе физиологические роды имели 43,6 и 37,8% женщин. Медицинский аборт до 12 недель проводился 15,4 и 18,9% женщин соответственно подгруппам. Самопроизвольный выкидыш в анамнезе отмечен у 5,1 и 8,1% женщин.
Иммунологическое исследование
Изучение экспрессии генов врожденного иммунитета проводилось на кафедре иммунологии МБФ ФГБОУ ВО РНИМУ им. Н.И. Пирогова (зав. кафедрой – д.м.н., профессор Л.В. Ганковская). Для реакции обратной транскрипции 25 мл смеси содержало 3 мкл РНК-матрицы, 1 мкл random («Синтол», РФ) и 9 мкл ddH2O. Для постановки полимеразной цепной реакции в реальном времени (ПЦР-РТ) были использованы праймеры программного обеспечения Vector NTI Designer («Синтол», РФ). Определялась экспрессия генов TLR4, TLR2, HBD-1 и TNFa. Уровень HNP1-3 оценивался методом иммуноферментного анализа (набор Human HNP1-3, HycultBiotech).
Гистологическое и иммуногистохимическое исследования
Проводились на базе отделения патоморфологии ГБУЗ ГКБ №40 Департамента здравоохранения г. Москвы. Ткань эндометрия фиксировали в 10% растворе нейтрального формалина с последующей спиртовой дегидратацией, заливкой в парафиновые блоки и приготовлением гистологических срезов толщиной 3 мкм. Для иммуногистохимического (ИГХ) исследования препараты депарафинировали в ксилоле, промывали в фосфатно-солевом буфере, обрабатывали 0,3% H2O2. Применялись первичные моноклональные антитела: к вирусу Эпштейна–Барр, клон CS1+CS2+CS3+CS4 (Novocastro), к рецепторам эстрогена, 1D5 (Dako), прогестерона, SP2 (Dako), к CD56, клон 123С3.D5, к CD16, клон 2H, к HLA-DR, клон LN3 (Novocastra), к CD138, клон MI15 (Dako, 1:50), и поликлональные к вирусу простого герпеса (ВПГ) (Dako). Оценку интенсивности ИГХ-реакции проводили при увеличении 400× в одном поле зрения с применением балльной шкалы от 0 до 3 (0 – реакция отсутствует, 1 – слабая, 2 – умеренная, 3 – выраженная реакция). Количество рецепторов оценивалось по H-score и в баллах (0–10 баллов – отсутствие экспрессии, 11–100 баллов – слабая, 101–200 баллов – умеренная, а более 201 – выраженная экспрессия).
Статистический анализ
Использовали пакет программного обеспечения STATISTICA (StatSoft Inc., США, версия 7.0). Количественные показатели и их значимость оценивались с использованием теста Манна–Уитни. Связь между количественными и качественными показателями оценивали с помощью коэффициента корреляции Спирмена. Критический уровень значимости был равным и менее 0,05.
Результаты и обсуждение
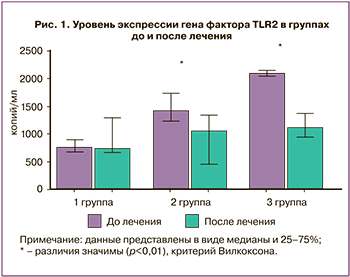 Иммунологическое исследование
Иммунологическое исследование
1-ю подгруппу составили 43 пациентки с продолжительностью терапии 20 дней. Был выявлен значительный разброс данных, поэтому подгруппа была дополнительно ранжирована в зависимости от уровня изначальной экспрессии изучаемого гена. Выделены группа с низкой экспрессией (группа 1), со средним уровнем (группа 2) и с изначально высокой экспрессией гена (группа 3). Для TLR2 разброс показателей составил от 220,12×103 до 2148,65×103 копий/мл до лечения и от 220,01×103 до 1865,13×103 копий/мл после терапии. После лечения выявлено значимое снижение экспрессии гена TLR2 в группе 2 (n=19) в 1,4 раза и в группе 3 (n=11) в 2 раза. В группе 1 (n=13) экспрессия TLR2 не изменилась (рис. 1).
Колебание показателей экспрессии гена TLR4 в эндометрии составило от 49,92×103 до 1524,67×103 копий/мл до лечения и от 35,17×103 до 3283,04×103 копий/мл после терапии. Выявлено увеличение экспрессии TLR4 в 3,6 раза только в группе с изначально его низкой экспрессией (n=13). Экспрессия гена TNFα составила от 730,57×103 до 4360,75×103 копий/мл до терапии и от 645,49×103 до 5211,57×103 копий/мл после. Выявлено значимое увеличение экспрессии TNFα в группе 1 (n=12) в 2,2 раза, в группе 2 (n=21) в 1,2 раза, в группе 3 (n=10) изменений не было (рис. 2).
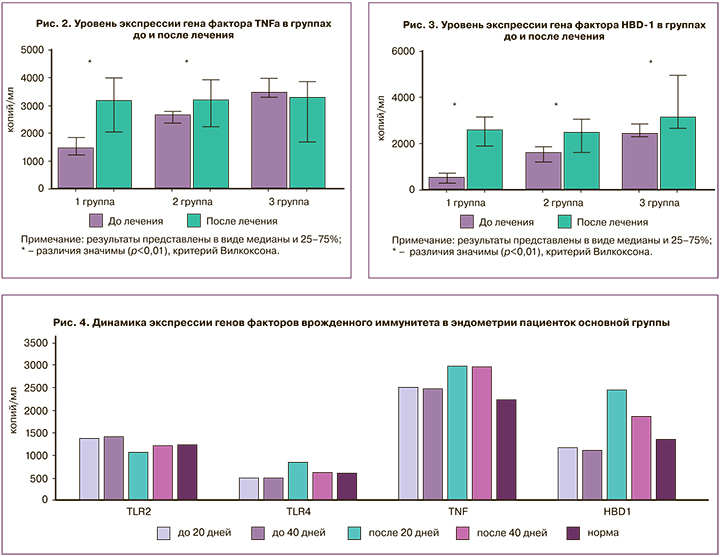
Разброс экспрессии HBD-1 составил от 49,91×103 до 2942,71×103 копий/мл до лечения и от 21,55×103 до 5466,82×103 копий/мл после. Обнаружено увеличение его количества в 5 раз при изначально низком уровне (группа 1, n=21), в 1,6 раза при умеренной экспрессии (группа 2, n=13) (p<0,05) (рис. 3).
Во 2-ю подгруппу были включены 40 пациенток с ХЭ, которым проведен 40-дневный курс экзогенной цитокинотерапии.
Для TLR2 разброс показателей составил от 290,85×103 до 3509,93×103 копий/мл до лечения и от 312,68×103 до 5143,51×103 копий/мл после. Выявлено значимое снижение экспрессии гена TLR2 после лечения в 1,5 раза в группе 2 (n=22) и в 1,8 раза в группе 3 (n=10) (p<0,05). Колебание показателей экспрессии гена TLR4 в эндометрии составило от 112,54×103 до 4045,94×103 копий/мл до лечения и от 123,11×103 до 3853,09×103 копий/мл после терапии. Отмечено значимое увеличение экспрессии TLR4 в группе 1 (n=18) в 2,5 раза и отсутствие изменений в группах 2 (n=11) и 3 (n=11).
Экспрессия гена TNFα в ткани при ХЭ была от 681,65×103 до 4442,99×103 копий/мл до терапии и от 696,92×103 до 4701,08×103 копий/мл после. Статистически значимое увеличение экспрессии TNFα отмечено в группе 1 (n=16) в 2,0 раза, в группе 2 (n=15) – в 1,5 раза (p<0,01). Разброс экспрессии HBD-1 составил от 61,03×103 до 5492,34×103 копий/мл до лечения и от 54,21×103 до 5018,72×103 копий/мл после терапии. После лечения отмечено значимое увеличение экспрессии HBD-1 в 4,2 раза в группе 1 (n=23) и в 1,8 раза в группе 2 (n=11) (p<0,01). При сравнении между подгруппами более выраженные положительные изменения отмечены после 40-дневного курса терапии. Экспрессия генов факторов врожденного иммунитета нормализовалась для TLR2 и TLR4 и возросла в 1,3 раза для TNFα и HBD-1 (рис. 4).
Гистологическое и иммуногистохимическое исследования
Полная гистологическая картина ХЭ была выявлена в 86% случаев. Соответствие зрелости эндометрия средней стадии фазы секреции было выявлено только у 9 (20,9%) пациенток 1-й подгруппы и у 10 (25%) – 2-й. Количество пиноподий было снижено в обеих подгруппах основной группы, составив 29,9 и 28,4% соответственно (р<0,01).
Выявлены значимо низкие показатели экспрессии рецепторов к стероидным гормонам как в клетках стромы, так и в эпителии желез эндометрия. В большей степени снижалось количество эстрогеновых рецепторов: в строме – в 1,5 раза, в железах – в 2,3 раза (р<0,05). Экспрессия рецепторов к прогестерону в строме была ниже нормы в 1,5 раза, а в железах – в 1,7 раза (р<0,05). После проведения 20-дневной терапии отмечено увеличение количества всех рецепторов примерно в 1,3 раза (р<0,05) (рис. 5).
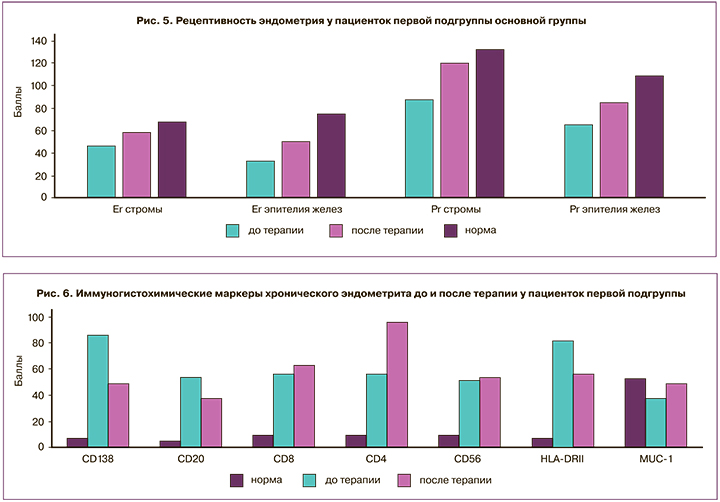
Антигены вирусов присутствовали в ткани у 86% пациенток 1-й подгруппы. ВПГ суммарно выявлялся у 65%, а вирус Эпштейна–Барр – у 55,8% пациенток. После лечения обнаружение ВПГ 1 типа снизилось в 6,6 раза, а вируса Эпштейна–Барр – в 2,2 раза (р<0,01). У 86% пациенток 1-й подгруппы выявлялись CD138. После окончания терапии их качество снизилось в 1,8 раза (р<0,01). CD20, CD8 и CD56 изначально выявлялись у 50% пациенток. После окончания лечения частота положительного мембранного окрашивания на CD20 снизилось в 1,4 раза, HLA-DRII – в 1,5 раза (р<0,05), а для CD8 и NK клеток не менялась (рис. 6).
У пациенток 2-й подгруппы было отмечено сниженное количество пиноподий (в 2 раза), MUC-1 (в 1,5 раза), низкая экспрессии ER в железах (29,7±10,2 балла) и в строме (46,1±13,7 балла). После окончания 40-дневного курса терапии количество пиноподий возросло в 1,6 раза, MUC-1 – в 1,3 раза, количество рецепторов к эстрогенам в железах и строме увеличилось в 1,8 и в 1,3 раза, а к прогестерону – в 1,4 и в 1,6 раза (р<0,05) (рис. 7).
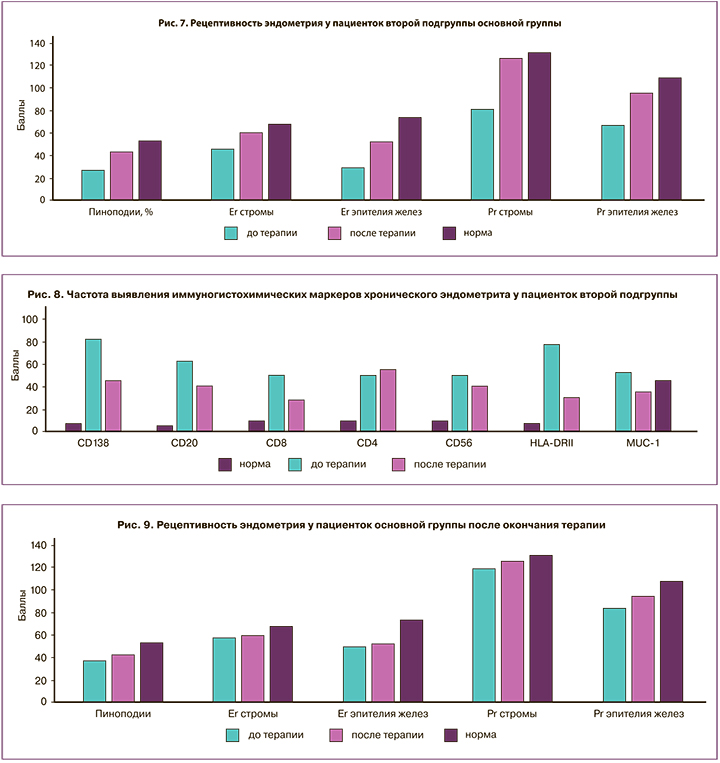
У 55% пациенток 2-й подгруппы были обнаружены антигены вируса Эпштейна–Барр, а у 42,5% – ВПГ 1 типа. После окончания терапии количество клеток уменьшилось в 3,7 раза и в 17 раз соответственно (р<0,01).
Результаты ИГХ выявили скопления плазмоцитов у 82,5% пациенток. После 40 дней терапии частота их выявления снизилась в 1,8 раза, полное излечение отмечено у 55% пациенток. После терапии CD20 выявлялись реже в 1,6 раза, HLA-DRII – в 2,6 раза, а CD8 – в 1,8 раза (р<0,05) (рис. 8).
Проведение сравнительного анализа эффективности двух курсов терапии выявило, что после 40 дней лечения количество пиноподий возросло на 5% от показателей 20-дневного лечения, а число рецепторов к прогестерону приближалось к показателям нормы (рис. 9).
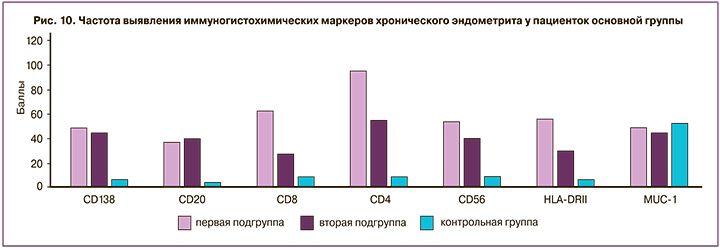
После 40-дневного курса в 1,9 раза снизилось количество клеток с антигеном ВПГ 1 типа, в 1,8 раза – с вирусом Эпштейна–Барр, а также CD8 (в 2,5 раза), CD4 (в 1,9 раза) и CD56 (в 1,4 раза) (р<0,01) (рис. 10).
ХЭ подразумевает продолжающийся, непрерывный патологический воспалительный процесс эндометрия, природа которого лежит в изменении количества воспалительных клеток, присутствующих в ткани. Идея дисбаланса в составе иммунокомпетентных клеток как причины нарушения функции эндометрия рассматривается уже более века и диктует поиск терапевтических возможностей ее коррекции. Широкое распространение эмпирических методов лечения, направленных на улучшение восприимчивости эндометрия, свидетельствует о проблемах, с которыми сталкиваются клиницисты, стремясь помочь пациенткам с ХЭ. Диапазон эмпирических методов достаточно широк и в большинстве случае основан на двух постулатах: первый – увеличение маточного кровотока улучшает функцию эндометрия и, следовательно, его рецептивность, а второй – ХЭ является следствием измененной реакции иммунной системы женщины.
В нашем исследовании были изучены возможности коррекции экспрессии факторов врожденного иммунитета в ткани эндометрия за счет проведения экзогенной цитокинотерапии. Результаты исследования выявили существующий дисбаланс в системе мукозального иммунитета, характеризующийся недостаточностью продукции фактора некроза опухоли и дефенсинов на фоне избытка экспрессии TLR2. Полная гистологическая картина ХЭ была выявлена в 86% случаев. Во всех образцах ткани были снижены экспрессия рецепторов к эстрогенам, прогестерону и обнаружены скопления плазматических клеток. Интересными находками стали внутриклеточные включения ВПГ 1–2 типов и вируса Эпштейна–Барр, подтверждающие роль вирусной этиологии в развитии хронического воспаления.
Проведенный курс цитокинотерапии, вне зависимости от его продолжительности, привел к значительным изменениям. После 20-дневного курса частота обнаружения ВПГ снизилась почти в 7 раз, а вируса Эпштейна–Барр – в 2 раза. После 40-дневного курса детекция вируса Эпштейна–Барр уменьшилась в 4 раза, а ВПГ 1 типа – в 17 раз. Таким образом, отмечено снижение контаминации эндометрия после проведенного курса лечения вне зависимости от его длительности, что свидетельствует о возможности самоизлечения при условии восстановления показателей местного иммунитета. Наши результаты согласуются с работами Кобаидзе Е.Г. [18], Файзуллиной Д.И. [19] и Ходосовой Т.Г. [20], показавшими эффективность комплексного применения различных иммуномодуляторов и физиотерапевтических методов для элиминации бактерий и вирусов при хроническом эндометрите.
Считается, что хронизация процесса развивается в случае неполноценности первоначального ответа на внедрение возбудителя с последующим развитием каскада цитокиновых реакций, приводящих к склерозированию ткани и нарушению в ней образования сосудистой сети.
Проведение самостоятельного курса цитокинотерапии препаратом «Суперлимф» позволяет добиться существенных изменений и в рецептивности. Без применения гормональных средств через 20 дней отмечено увеличение рецептивности за счет увеличения числа пиноподий (в 1,27 раза), повышения экспрессии рецепторов к эстрогенам (в 1,3 раза) и к прогестерону (в 3 раза). Через 40 дней количество рецепторов к эстрогенам увеличилось в железах и строме в 1,8 и в 1,3 раза, а к прогестерону – в 1,4 и в 1,6 раза соответственно. Полученные результаты согласуются с частотой выявления маркеров ХЭ. После окончания 40 дней терапии количество CD8 снизилось в 2,45 раза, CD4 – в 1,86 раза и CD56 – в 1,44 раза, количество CD138 снижалось в среднем в 1,6 раза.
Заключение
В результате проведенного исследования было доказано, что у пациенток с ХЭ имеется дисбаланс в продукции факторов врожденного иммунитета, поддерживающего вялотекущее воспаление. Экзогенная цитокинотерапия снижает выраженность воспалительного процесса в эндометрии, способствует элиминации вирусных агентов, что приводит к восстановлению рецептивности ткани. В наибольшей степени положительные изменения развиваются после 40 дней лечения. Таким образом, проведение комплексной терапии ХЭ с включением цитокинотерапии позволяет улучшить функциональные показатели ткани и восстановить ее рецептивность.



