Миома матки – наиболее распространенная доброкачественная опухоль женской половой системы, которая определяется у 20–50% женщин, при этом частота ее выявления значительно увеличивается в позднем репродуктивном возрасте. Влияние миомы на фертильность – широко дискутируемая проблема, особенно в аспекте применения методов вспомогательных репродуктивных технологий (ВРТ) [1].
Общепризнанно, что само наличие миомы матки далеко не всегда негативно влияет на наступление беременности. Возможными механизмами влияния миом на фертильность считаются механический эффект (сдавление устьев маточных труб, атрофия эндометрия, элонгация и расширение эндометриальных желез в области миомы), нарушение сократимости матки, дисрегуляция ангиогенеза, нарушение продукции провоспалительных цитокинов, изменение экспрессии факторов рецептивности эндометрия.
Попытки найти зависимость между числом, размером, суммарным объемом миоматозных узлов и частотой наступления беременности не привели к желаемым результатам. Большинство клиник придерживается внутренних протоколов подготовки пациенток с миомой матки к программам ВРТ, основанных на личном опыте, тогда как единого мнения до сих пор не сформировано. На сегодняшний день единогласным является мнение о необходимости миомэктомии перед программой ЭКО при наличии субмукозных узлов, независимо от их количества и размеров. В то же время нет убедительных данных, позволяющих сделать вывод о влиянии интрамуральной и субсерозной миом матки на исход программ ВРТ. Результаты отдельных исследований весьма противоречивы. В связи с этим приобретает большое значение определение «рецептивного статуса» эндометрия при миоме различной локализации, что, возможно, поможет прийти к единому мнению относительно тактики лечения бесплодия у женщин с данной патологией.
Цель исследования: изучить результативность программы ЭКО у женщин с миомой матки и перенесших миомэктомию, в зависимости от морфофункционального состояния эндометрия.
Материалы и методы исследования
В зависимости от морфологических и иммуногистохимических особенностей эндометрия нами были изучены исходы программ ВРТ у 158 женщин репродуктивного возраста с простой лейомиомой матки и трубно-перитонеальным фактором бесплодия, проходивших лечение методом ЭКО в отделении вспомогательных технологий в лечении бесплодия ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России.
Женщины были разделены на 3 группы: 52 пациентки с интрамуральной миомой матки (или в сочетании с субсерозной миомой) до 4 см в диаметре без деформации полости матки (1-я группа), 53 пациентки после лапароскопической миомэктомии (по поводу интрамуральной миомы матки) без вскрытия полости матки, произведенной как минимум за 6 месяцев до вступления в программу ЭКО (2-я группа) и 53 женщины с трубно-перитонеальным фактором бесплодия без патологии миометрия (контрольная группа). Существенных и достоверных различий между группами по возрасту, характеру и длительности бесплодия выявлено не было. Сперма супругов была фертильна. Более половины женщин (51,3%) имели 1 и более неудачных попыток ЭКО в анамнезе, 12% пациенток имели 3 и более неудачных циклов лечения.
Всем пациенткам проводилось морфологическое исследование биоптатов эндометрия, полученных с помощью пайпель-биопсии в цикле, предшествующем ЭКО, методом аспирационной биопсии с использованием Paipel de Cornier в среднюю лютеиновую фазу менструального цикла (на 5–6-й день после овуляции). Момент овуляции определялся с помощью мочевого теста и ультразвукового исследования на аппарате «Flex Focus 1202» (фирма «B-K Medical ApS», Дания) с использованием трансвагинального датчика с частотой 7,1 МГц. Полученный материал фиксировался в 10% нейтральном формалине и заливался в парафин. В препаратах, окрашенных гематоксилином и эозином, анализировалась структура эндометрия с подсчетом процента зрелых пиноподий в поверхностном эпителии.
В серийных парафиновых срезах проводились иммуногистохимические реакции с демаскировкой антигенов в ретривере при 100°С и применением антител к leukemia inhibitory factor (LIF), vascular endothelial growth factor A (VEGF-A), клаудина-5 (CLDN-5). Ставился положительный и отрицательный контроль. Анализ результатов иммуногистохимических реакций проводили с учетом количества окрашенных клеток и интенсивности окраски в поверхностном эпителии, железах и строме эндометрия с использованием метода гистологического счета.
Степень выраженности экспрессии LIF, VEGF-A и CLDN-5 оценивали следующим образом: 0 баллов (0% клеток) – отсутствие экспрессии, от 1 до 2 баллов (от 1 до 20% клеток) – слабая экспрессия, от 3 до 4 баллов (от 21 до 40% клеток) – умеренная экспрессия, от 5 до 6 баллов (от 41% клеток и более) – выраженная экспрессия.
Статистическую обработку данных проводили с использованием программы Statistica 10. Помимо описательной статистики (данные представлены в виде: среднее ± стандартное отклонение) для сравнения результатов применяли t-тест для независимых переменных, χ2-тест и тест Манна–Уитни. Для выявления корреляции между количеством клеток, содержащих развитые пиноподии, и остальными маркерами рецептивности проводили корреляционный анализ с вычислением коэффициента Пирсона.
Результаты исследования
Всем женщинам проводилось ЭКО со стимуляцией функции яичников препаратами рекомбинантного фолликулостимулирующего гормона по короткому протоколу с антагонистами гонадотропин-рилизинг гормона. Значимых различий между группами пациенток в отношении средних доз индуктора на стимуляцию, параметров фолликулогенеза, оогенеза и раннего эмбриогенеза выявлено не было. Всем пациенткам производился перенос 1–2 эмбрионов в полость матки. Среднее число перенесенных эмбрионов составило 1,9±0,2; 1,9±0,3 и 1,7±0,4 соответственно.
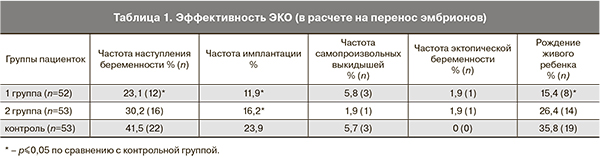
Выявлено статистически достоверное снижение частоты наступления беременности в группе с миомой матки по сравнению с контролем. Частота имплантации в контрольной группе была достоверно выше, чем в группе с миомой матки и после миомэктомии (табл. 1).
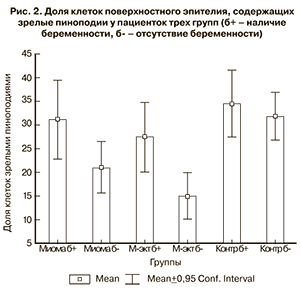
В группе пациенток с миомой матки доля клеток, содержащих развитые пиноподии, составила 23,4±16,6%*; в группе женщин, перенесших миомэктомию – 18,8±15,5%*; в контрольной группе – 32,9±14,6%. Следует отметить, что среднее количество клеток с развитыми пиноподиями в группе женщин с миомой матки и в группе женщин, перенесших миомэктомию, было достоверно ниже, чем в контрольной группе (* – р≤0,05) (рис. 1 см. на вклейке, рис. 2).
 Нами была изучена экспрессия наиболее перспективных молекулярных маркеров рецептивности в эндометрии: LIF в поверхностном эпителии и железах, строме и пиноподиях, VEGF-A в поверхностном эпителии и железах, строме и эндотелии и CLDN-5 в эндотелии сосудов эндометрия.
Нами была изучена экспрессия наиболее перспективных молекулярных маркеров рецептивности в эндометрии: LIF в поверхностном эпителии и железах, строме и пиноподиях, VEGF-A в поверхностном эпителии и железах, строме и эндотелии и CLDN-5 в эндотелии сосудов эндометрия.
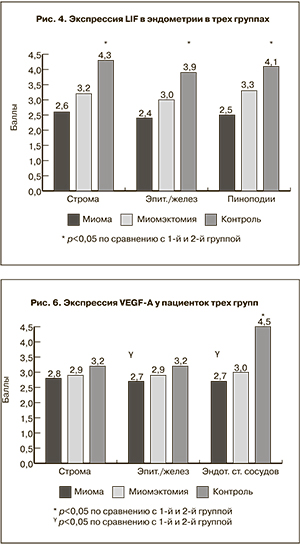
При анализе экспрессии LIF (рис. 3 см. на вклейке, рис. 4) отмечалась тенденция к более высокому его содержанию во 2-й и контрольной группах во всех исследуемых клеточных структурах. При этом в строме эндометрия низкая экспрессия LIF была выявлена у 57,7 и 47,1% пациенток 1-й и 2-й групп, тогда как в контрольной группе – лишь в 20,8% случаев. Средняя экспрессия определялась в 26,9, 32,1 и 43,4% соответственно. Выраженная экспрессия была выявлена у 9,6, 17,0 и 35,8% женщин соответственно. Средний уровень экспрессии LIF в строме эндометрия составил 2,6±1,7 балла в первой группе, 3,2±1,7 балла во второй группе, что было достоверно ниже, чем в контрольной группе, в которой этот показатель соответствовал 4,3±1,5 балла.
Аналогичная картина была характерна для поверхностного эпителия и желез эндометрия. Низкая экспрессия LIF была выявлена более чем у половины женщин 1-й и 2-й групп (65,4 и 56,6% пациенток соответственно), тогда как в контрольной группе – лишь в 28,3% случаев. В 3 случаях (5,8%) в группе пациенток с миомой матки отмечалось отсутствие экспрессии LIF в поверхностном эпителии и железах эндометрия. Средняя экспрессия определялась у 19,2, 34,0 и 47,2% женщин, выраженная – у 9,6, 9,4 и 24,5% женщин соответственно. Таким образом, средний уровень экспрессии LIF в поверхностном эпителии и железах эндометрия составил 2,4±1,6 балла в 1-й группе, 3,0±1,4 балла во 2-й группе, что было также достоверно ниже, чем в контрольной группе (3,9±1,5 балла).
Экспрессия LIF в пиноподиях составила 2,5±1,9 балла в 1-й группе, 3,3±1,5 балла во 2-й группе, что было достоверно ниже, чем в контрольной группе (4,1±1,4 балла).
При оценке экспрессии VEGF-A в эндометрии (рис. 5 см. на вклейке, рис. 6) отмечалось самое низкое его содержание в группе женщин с миомой матки. Так, в строме эндометрия низкая экспрессия VEGF-A была выявлена у 57,7 и 60,4% пациенток 1-й и 2-й групп, в контрольной группе – в 49,0% случаев. Средняя экспрессия определялась у 38,5, 28,3 и 30,2%, выраженная экспрессия была выявлена у 1,9, 9,4 и 18,9% женщин соответственно. Таким образом, средний уровень экспрессии VEGF-A в строме эндометрия составил 2,8±1,2 балла в 1-й группе, 2,9±1,4 балла во 2-й группе и 3,2±1,8 балла в контрольной группе. Средний уровень экспрессии VEGF-A в строме эндометрия у пациенток с миомой матки был достоверно ниже, чем в контрольной группе.
Аналогичная картина наблюдалась в поверхностном эпителии и железах эндометрия (рис. 6): в 1-й и 2-й группах низкая экспрессия VEGF-A была выявлена у 57,7 и 62,3% пациенток соответственно, в контрольной группе – в 58,5% случаев. Средняя экспрессия определялась у 28,9, 18,9 и 16,9% женщин, высокая экспрессия была выявлена у 9,6, 16,9 и 24,5% женщин соответственно. Таким образом, средний уровень экспрессии VEGF-A в поверхностном эпителии и железах эндометрия составил 2,7±1,6 балла в 1-й группе, 2,9±1,7 балла во 2-й группе, в контрольной группе – 3,2±1,8 балла, при этом уровень VEGF-A у пациенток с миомой матки был достоверно ниже, чем в контрольной группе.
Экспрессия VEGF-A в эндотелии (рис. 6) была низкой более чем у половины пациенток 1-й и 2-й групп (у 61,5 и 54,7% соответственно), тогда как в контрольной группе – только в 16,9% случаев. Средняя экспрессия определялась у четверти пациенток 1-й и 2-й групп (23,1 и 28,3%), почти у половины (43,4%) женщин контрольной группы. Выраженная экспрессия была выявлена у 11,5, 15,1 и 39,6% женщин соответственно. Средний уровень экспрессии VEGF-A в эндотелии составил 2,7±1,6 балла в 1-й группе, 3,0±1,6 балла во 2-й группе, в контрольной группе – 4,5±1,5 балла. Средний уровень экспрессии VEGF-A в эндотелии у пациенток с миомой матки и у пациенток после миомэктомии был достоверно ниже, чем в контрольной группе.
Высокая экспрессия CLDN5 (рис. 7, 8 см. на вклейке) в эндотелии в 1-й и 2-й группах (с миомой матки и после миомэктомии) была выявлена у 59,6 и 20,8% пациенток соответственно, в контрольной группе – в 5,7% случаев. Средняя экспрессия определялась у 25,0, 43,4 и 28,3% соответственно. Низкая экспрессия была выявлена у 15,4, 35,8 и 66,0% женщин соответственно. Таким образом, средний уровень экспрессии CLDN5 в эндотелии составил 4,8±1,7 балла в 1-й группе, 3,5±1,7 балла во 2-й группе, в контрольной группе – 2,4±1,5 балла. Средний уровень экспрессии CLDN5 в эндотелии у пациенток с миомой матки и у пациенток после миомэктомии был достоверно выше, чем в контрольной группе.
Обсуждение
Изучению рецептивности эндометрия в циклах ЭКО в последнее время уделяется все большее внимание. Еще в 2005 г. A.A. Arslan и соавт. предположили, что негативное влияние интрамуральных миом на репродуктивную функцию может быть объяснено изменением маточного кровотока и рецептивности эндометрия за счет дисрегуляции экспрессии генов [2].
С тех пор ведется активный поиск наиболее информативных маркеров рецептивности.
Исследование J.A. Horcajadas и соавт. (2008) показало, что около 25 генов, экспрессируемых в эндометрии, связаны с «окном имплантации». При этом при интрамуральной миоме матки была отмечена дисрегуляция лишь 3 из них (GPx,3; placental protein 14 (glycodelin); aldehyde dehydrogenase 3 family, member B2) [3].
 В последнее время внимание репродуктологов приковано к важному цитокину, который опосредует «диалог» между эндометрием и эмбрионом – LIF. LIF и его рецепторы экспрессируются на поверхности бластоцисты перед имплантацией и в цитотрофобласте. Выработка бластоцистой рецепторов LIF способствует установлению взаимодействия между эмбрионом и эндометрием, а также стимулирует ориентацию трофобласта, необходимую для правильной адгезии бластоцисты. LIF является важным модулятором имплантации, оказывая прямое воздействие на дифференцировку трофобласта. Установлено, что максимальная экспрессия LIF в эндометрии отмечается в период «окна имплантации», что позволяет отнести этот фактор к биохимическому маркеру рецептивности эндометрия E. Hasegawa и соавт. (2012) в своем исследовании показали, что у женщин с деформацией полости матки за счет субмукозных миом или полипов значительно снижена экспрессия LIFмРНК в эндометрии в период «окна имплантации» [4]. P.C. Serafini и соавт. показали, что у женщин с более высокой экспрессией LIF во время «окна имплантации» вероятность наступления беременности в программе ЭКО выше. При этом образцы эндометрия также исследовались в цикле, предшествующем стимуляции суперовуляции и хотя имеются данные об отличиях рецептивности эндометрия в стимулированном и естественном циклах, высокая иммунореактивность LIF положительно коррелировала с наступлением беременности в следующем цикле. Авторами было показано, что благоприятный прогноз наступления беременности после ЭКО ассоциируется с высоким содержанием в эндометрии LIF на фоне низкой эспрессии клаудина 4 [5].
В последнее время внимание репродуктологов приковано к важному цитокину, который опосредует «диалог» между эндометрием и эмбрионом – LIF. LIF и его рецепторы экспрессируются на поверхности бластоцисты перед имплантацией и в цитотрофобласте. Выработка бластоцистой рецепторов LIF способствует установлению взаимодействия между эмбрионом и эндометрием, а также стимулирует ориентацию трофобласта, необходимую для правильной адгезии бластоцисты. LIF является важным модулятором имплантации, оказывая прямое воздействие на дифференцировку трофобласта. Установлено, что максимальная экспрессия LIF в эндометрии отмечается в период «окна имплантации», что позволяет отнести этот фактор к биохимическому маркеру рецептивности эндометрия E. Hasegawa и соавт. (2012) в своем исследовании показали, что у женщин с деформацией полости матки за счет субмукозных миом или полипов значительно снижена экспрессия LIFмРНК в эндометрии в период «окна имплантации» [4]. P.C. Serafini и соавт. показали, что у женщин с более высокой экспрессией LIF во время «окна имплантации» вероятность наступления беременности в программе ЭКО выше. При этом образцы эндометрия также исследовались в цикле, предшествующем стимуляции суперовуляции и хотя имеются данные об отличиях рецептивности эндометрия в стимулированном и естественном циклах, высокая иммунореактивность LIF положительно коррелировала с наступлением беременности в следующем цикле. Авторами было показано, что благоприятный прогноз наступления беременности после ЭКО ассоциируется с высоким содержанием в эндометрии LIF на фоне низкой эспрессии клаудина 4 [5].
Клаудины являются ключевыми молекулами плотных контактов эпителиальных и эндотелиальных клеток, регулирующих диффузию ионов и воды, играющие роль в формировании клеточной полярности, адгезии, дифференцировке и пролиферации. Кроме того, клаудины (в основном клаудин-5) экспрессируются в эндотелии сосудов, влияя тем самым на проницаемость сосудистой стенки и изменение функции околоклеточного стромального матрикса. В исследованиях M.M. Collins и соавт., проведенных на куриных эмбрионах, было показано, что клаудин-5 – это единственный эндотелиальный клаудин, эспрессирующийся во время развития куриного эмбриона, с начала васкуляризации. Клаудин-5 экспрессируется в большом количестве в сосудистой сети всего эмбриона [6].
Функциональную подготовку эндометрия и его готовность к имплантации обеспечивает адекватное развитие в нем сосудистой сети. VEGF-А является одним из самых важных ангиогенных факторов роста в регуляции ангиогенеза в организме и доминантным фактором в регуляции ангиогенеза в эндометрии. Взаимосвязь VEGF и семейства клаудинов может играть важную роль в подготовке эндометрия к имплантации [7].
Полученные нами данные свидетельствуют о негативном влиянии интрамуральной миомы матки (или сочетания интрамуральной и субсерозной миомы) на частоту наступления беременности, имплантации и родов в программе ЭКО по сравнению с пациентками без миомы матки. В то же время наличие миомы матки не влияло существенным образом на частоту прерывания беременности и эктопической беременности.
Результаты ЭКО у пациенток, перенесших миомэктомию, были сопоставимы с таковыми у женщин контрольной группы, за исключением частоты имплантации, которая была достоверно ниже. Частота прерывания беременности и эктопической беременности также были сопоставимы с контролем. Отметим, что частота имплантации в группе женщин с миомой матки, также как и в группе женщин после миомэктомии, была достоверно ниже, чем в контрольной группе (11,9, 16,2 и 23,9% соответственно).
Оценка рецепторного потенциала эндометрия в цикле, предшествующем попытке ЭКО, показала, что у женщин с миомой матки, так же как и у женщин, перенесших миомэктомию, имеются существенные различия содержания как морфологических, так и молекулярных маркеров рецептивности по сравнению с контрольной группой без миомы матки.
Так, количество клеток, содержащих зрелые пиноподии у женщин 1-й и 2-й групп, было достоверно ниже, чем у пациенток без патологии миометрия. Экспрессия LIF во всех исследуемых тканевых структурах была достоверно ниже как в группе с миомой матки, так и после миомэктомии.
Наоборот, экспрессия VEGF-A была существенно снижена в строме и поверхностном эпителии/железах эндометрия только в группе женщин с миомой матки, тогда как в группе пациенток после миомэктомии этот показатель был сопоставим с контролем. Определенный интерес представляют данные содержания VEGF-A и CLDN-5 в эндотелии сосудов эндометрия. Была выявлена разнонаправленная экспрессия данных маркеров, при этом более высокому уровню VEGF-A соответствовал более низкий уровень CLDN-5.
У женщин с наступившей беременностью, независимо от группы, отмечалась общая тенденция к более высокому содержанию клеток со зрелыми пиноподиями, более высокой экспрессии как LIF, так и VEGF во всех исследуемых участках эндометрия и в эндотелии. В отношении экспрессии CLDN-5 в эндотелии была выявлена обратная зависимость (экспрессия CLDN-5 была ниже у пациенток с удачной попыткой ЭКО).
Достоверные различия содержания зрелых пиноподий были получены в подгруппе пациенток с наступившей беременностью после миомэктомии (во 2-й группе). У женщин с миомой матки достоверной была разница экспрессии LIF в эпителии, VEGF в строме и CLDN-5 в эндотелии. В группе пациенток после миомэктомии достоверными были изменения экспрессии VEGF и CLDN-5 в эндотелии. В контрольной группе достоверная разница была выявлена в экспрессии LIF в строме и эпителии, VEGF – в эпителии и эндотелии и CLDN-5 в эндотелии. Таким образом, единая тенденция для всех групп была выявлена в отношении более низкой экспрессии CLDN-5 в эндотелии женщин с удачной попыткой ЭКО. Кроме того, для эндотелия также были характерны более высокие концентрации VEGF в группе после миомэктомии и в контрольной группе. Сходная, достоверно более высокая концентрация LIF при удачной попытке ЭКО была определена в эпителии женщин как с миомой матки, так и в контрольной группе.
Таким образом, проведенное нами исследование выявило достоверно более низкие показатели имплантации в группе с миомой матки и в группе после миомэктомии. Также были выявлены значимые различия содержания морфологических и молекулярных маркеров рецептивности эндометрия у пациенток программы ЭКО с миомой матки и без таковой.
Выводы
Интрамуральная миома матки (или сочетание интрамуральной и субсерозной миомы) негативно влияет на частоту наступления беременности, имплантации и родов у женщин в программе ЭКО по сравнению с пациентками без миомы матки.
Эндометрий женщин с трубно-перитонеальным бесплодием и сопутствующей миомой матки, а также женщин, перенесших лапароскопическую миомэктомию, имеет определенный рецептивный профиль, характеризующийся средним содержанием клеток с развитыми пиноподиями, слабой экспрессией LIF в строме эндометрия, его эпителиальном слое и пиноподиях, слабой экспрессией VEGF-A в строме и эпителиальном слое и умеренной экспрессией VEGF-A в эндотелии сосудов эндометрия в сочетании с выраженной экспрессией CLDN-5.
Эндометрий женщин с трубно-перитонеальным фактором бесплодия характеризуется высоким содержанием клеток с развитыми пиноподиями, выраженной экспрессией LIF во всех структурах эндометрия, умеренной экспрессией VEGF-A в строме и эпителии эндометрия, выраженной экспрессией VEGF-A в эндотелии сосудов эндометрия в сочетании с низкой экспрессией CLDN-5.
Для эндометрия пациенток с удачной попыткой ЭКО характерны: более высокий уровень клеток, содержащих зрелые пиноподии, более высокая экспрессия LIF и VEGF-A в строме и эпителиальном слое. Для эндотелия сосудов эндометрия характерно более высокое содержание VEGF-A и более низкое содержание CLDN-5.
У пациенток, перенесших лапароскопическую миомэктомию перед программой ЭКО, частота наступления беременности сопоставима с таковой у пациенток, не имеющих миому матки, что подтверждает необходимость миомэктомии при интрамуральных узлах диаметром 4 см и более.