Имплантация эмбриона в полость матки – это сложный многоуровневый процесс, физиология которого не исследована в полной мере. Успешная имплантация и развитие беременности в эндометрии возможны только в определенный период времени – «окно имплантации» [1]. Описаны случаи имплантации эмбриона в различные ткани организма женщины, за исключением нерецептивного эндометрия [2]. Изучение рецептивности эндометрия остается актуальным вопросом современной репродукции человека. Для того чтобы эндометрий «перешел» в состояние готовности к принятию бластоцисты, необходим гормональный прайминг эстрадиолом (Е2) и прогестероном (П), который осуществляется у женщин с регулярным менструальным циклом. Для повышения результативности в программах вспомогательных репродуктивных технологий (ВРТ) у бесплодных пациенток с повторными неудачными имплантациями зачастую используют дополнительное назначение циклической гормональной терапии (ЦГТ). Развитие технологий ВРТ позволило шагнуть далеко вперед в изучении качества эмбрионов, технологий витрификации, дозревания гамет, оптимизации протоколов стимуляции суперовуляции, подготовки эндометрия к переносу размороженных эмбрионов. Однако причина повторных неудачных имплантаций в ряде случаев кроется в нарушении рецептивности эндометрия.
Морфологические критерии созревания эндометрия не способны дать четкую дифференцировку признаков готовности эндометрия к имплантации эмбриона [3]. Считается, что период «окна фертильности» совпадает со средней стадией фазы секреции. В то же время ряд исследований показывают сомнительную диагностическую ценность данного метода для определения рецептивного статуса эндометрия [4]. Поэтому наиболее пристальное внимание современных исследователей обращено на поиски молекулярно-генетических биомаркеров рецептивности эндометрия [5–9]. Кроме того, молекулярно-генетическое исследование является более перспективным в определении «окна фертильности» в сравнении с [5]. Тест-система ERA (endometrial receptivity array) является одной из первых диагностических систем, разработанной на основании изучения особенности экспрессии 238 генов в эндометрии [9]. Разработчики данной системы установили, что у каждой 3-й женщины с безуспешными попытками ЭКО и переноса эмбриона существует риск сдвига «окна имплантации». На основании результатов данной системы предложен персонифицированный алгоритм лечения пациенток с повторными неудачными имплантациями [10]. Учитывая тот факт, что в нашей стране нет системы для выявления молекулярно-генетических предикторов «окна имплантации», разработка российского аналога является перспективным направлением.
Целью исследования было сопоставить исходы криопротоколов с результатами молекулярно-генетического исследования экспрессии матричной рибонуклеиновой кислоты (мРНК) генов в эндометрии на фоне ЦГТ.
Материалы и методы
В данное пилотное исследование были включены 36 бесплодных женщин, обратившихся для проведения программы переноса размороженных эмбрионов. Всем пациенткам со 2–3-го дня менструального цикла был назначен препарат эстрадиола валерата в дозировке 2 мг с постепенным увеличением дозировки до 6–8 мг в сутки на 10–12-й дни, с последующим добавлением препаратов микронизированного прогестерона (П+0) в дозировке 600 мг в сутки. На 5-й день назначения прогестерона всем пациенткам была произведена пайпель-биопсия эндометрия. Пайпель-биопсию эндометрия производили с помощью аспирационной кюретки Pipele de Corner (Laboratorie C.C.D., Франция). Биоптаты эндометрия были разделены на 2 части: для гистологического и молекулярно-генетического исследования.
Гистологическое исследование. Полученный материал помещали в парафин, после чего производили окрашивание срезов гематоксилин-эозином и исследовали с помощью светового микроскопа.
Молекулярно-генетическое исследование. Для выбора потенциальных биомаркеров «окна имплантации» был проведен биоинформатический анализ имеющихся в свободном доступе результатов данных микроматричного анализа образцов нормального эндометрия ранней и средней фазы стадии секреции [11]. В результате этого анализа было выбрано и проведено исследование экспрессии мРНК 15 генов: GPX3, PAEP, LIF, DPP4, TAGLN, HABP2, IMPA2, AQP3, HLA-DOB, MSX1, POSTN, IGFBP1, IL15, GNLY, NDRG1 методом полимеразной цепной реакции (ПЦР) с обратной транскрипцией (ОТ) в режиме реального времени. Образцы эндометрия были получены с помощью пайпель-биопсии на 5-й день назначения П на фоне ЦГТ, далее биоптаты помещали в пробирки с транспортной средой для стабилизации РНК (Стор-экс, ООО «НПО ДНК-Технология», Россия). Образцы тканей размораживали при комнатной температуре, удаляли транспортную среду и выделяли РНК с использованием QIAzol Lysis Reagent и RNeasy Mini Kit (Qiagen, Германия).
Реакцию ОТ проводили при температуре 40°С в течение 30 минут, с последующей инактивацией обратной транскриптазы при 95°С в течение 5 минут.
Амплификацию осуществляли в режиме реального времени в объеме 12 мкл по программе: 15 циклов – 80°С 5 с, 94°С 5 с; 1 цикл – 94°С 5 мин;50 циклов – 94°С 20 с, 64°С 20 с;10°С – хранение. Измерение уровня флуоресценции проводили в каждом цикле при температуре 64°С по каналу флуоресценции FAM. Для повышения чувствительности и специфичности ПЦР применяли «горячий старт», который обеспечивался полимеразой с антителами (TechnoTaq). Активация фермента происходила только после прогрева амплификационной смеси при 95°С в течение 5 минут. Реакцию ставили в двух повторах для каждой точки.
Обработка результатов осуществлялась с помощью программы Exсel на основании данных индикаторных циклов Сq, полученных по окончанию амплификации. Использован метод сравнения индикаторных циклов (метод ΔCq и метод ΔΔCq). Уровень экспрессии мРНК исследуемых генов измерялся в относительных единицах (о.е.), отражающих представленность транскрипта гена относительно нормировочного фактора, рассчитанного на основе уровня экспрессии мРНК референсных генов TBP, B2M и GUSB.
Транскрипционные профили образцов были отображены при помощи тепловой карты. Проводились log-трансформация и нормировка данных стандартным способом z-оценки. На основании этих показателей был реализован кластерный анализ методом полной связи с использованием евклидова расстояния. Тепловая карта и сопутствующие вычисления были выполнены при помощи программных разработок на языке Python 2.7 и его библиотек: Sklearn, Skipy, Pandas, Matplotlib, Seaborn.
Всем 36 пациенткам был произведен перенос одной бластоцисты в полость матки на 5-й день назначения микронизированного П (П+5) в цикле ЦГТ под контролем ультразвукового исследования с помощью катетера Соок (Австралия). Препараты эстрадиола валерата и микронизированного прогестерона были назначены в течение 14 дней после переноса эмбриона с последующим определением уровня β-хорионического гонадотропина в сыворотке крови.
После получения результатов ультразвукового исследования о наличии жизнеспособного эмбриона в полости матки при сроке 5–6 недель беременности был сделан вывод об успешной имплантации.
Статистический анализ
С помощью таблиц Microsoft Excel и пакета статистической программы IBM SPSS Statistics v22 (США) была произведена статистическая обработка полученных данных с соблюдением рекомендаций для проведения медицинских исследований. Для параметрических данных были проведены оценка среднего значения и среднеквадратичного отклонения, для непараметрических данных – медианы, а также определение межквартильного интервала (верхний (Q1) и нижний квартили (Q3)), для качественных данных были рассчитаны частоты (%). Для оценки различий между группами использовались методы непараметрической статистики (тест Манна–Уитни с поправкой Бонферрони). Кластерный анализ был использован для выделения кластерных подгрупп в зависимости от изменения экспрессии генов. Точный критерий Фишера с применением поправки Бонферрони использовался для попарного сравнения групп кластеров. С учетом поправки Бонферрони статистически значимыми считали различия между полученными данными при р≤0,008.
Результаты
Средний возраст пациенток составил 35 (4,5) лет, все пациентки имели нормальный индекс массы тела – 21,8 (3,4) кг/м2, регулярный менструальный цикл длительностью 28 (3,5) дней. Средняя длительность бесплодия составила 5,0 (2,7) года. Частота первичного бесплодия составила 38,9%, вторичного – 61,1%. На безуспешные попытки ЭКО в анамнезе указали 24 женщины (66,7%). На момент вступления в исследование пациентки имели 2,7 (1,4) криоконсервированных эмбриона хорошего качества. Все пациентки имели сохраненный овариальный резерв, о чем свидетельствует уровень АМГ 2,6 (2,2) МE/л. Уровень Е2 в сыворотке крови в день забора биоптата эндометрия составил 1174,1 (451,3) пмоль/л; уровень прогестерона – 39,4 (16,0) нмоль/л. Толщина эндометрия в день проведения пайпель-биопсии составила 8,9 (1,5) мм.
В результате гистологического исследования ранняя стадия фазы секреции установлена в 66,7% (n=24) образцов, а средняя стадия фазы секреции – в 33,3% (n=12) случаев.
Результаты молекулярно-генетического исследования были изучены с помощью кластерного анализа независимо от гистологического исследования и представлены в виде тепловой карты (рис. 1).
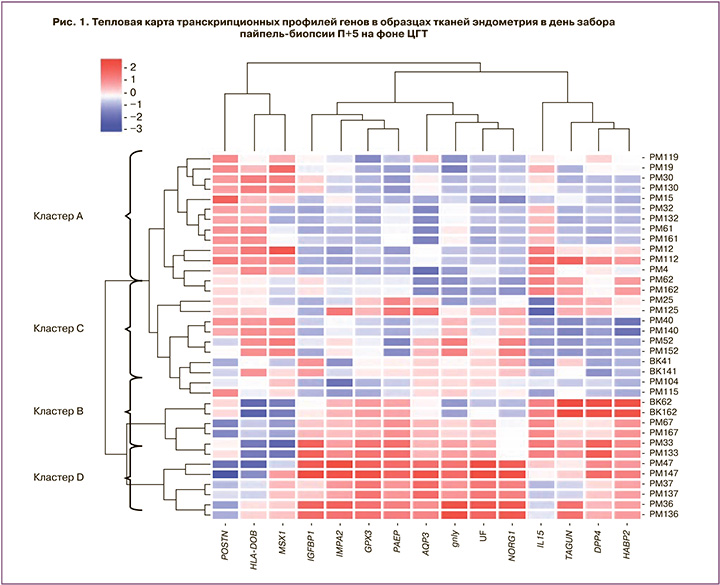
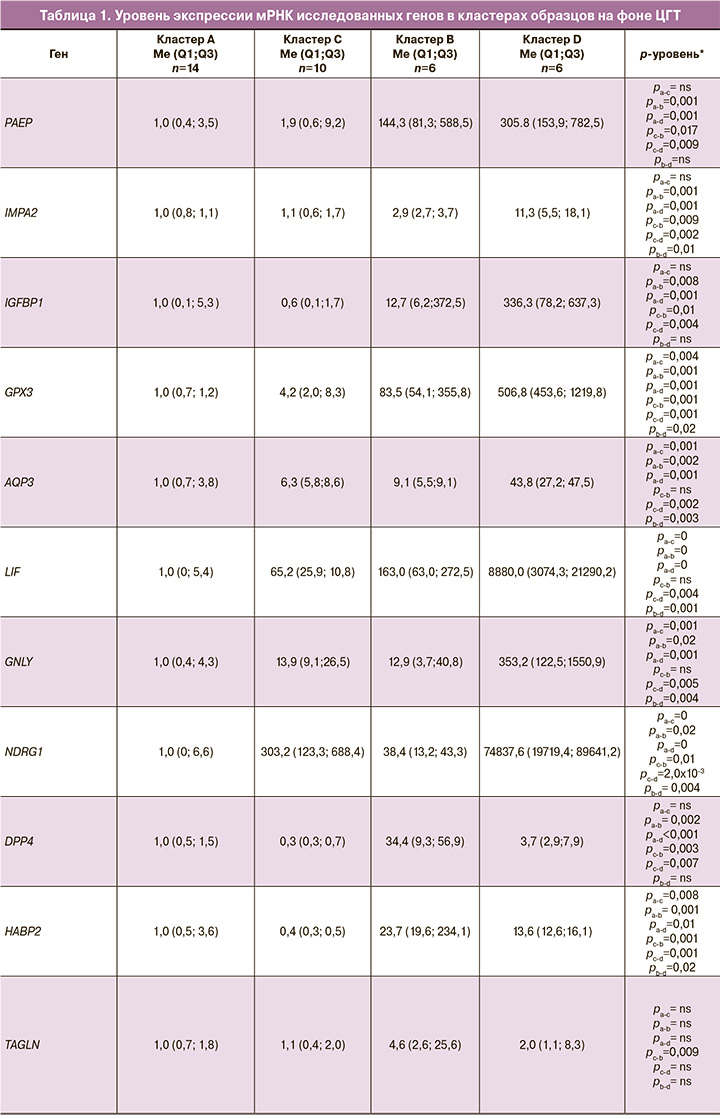
На основании кластерного анализа были выделены 4 стадии развития эндометрия: кластеры А, В, С и D. Так, отличительными особенностями кластера A (n=14) стали высокая экспрессия мРНК генов POSTN, HLA-DOB, MSX1 и низкая экспрессия мРНК генов LIF, GPX3, AQP3, NDRG1, GNLY, IMPA2, PAEP, IGFBP1, HABP2, DPP4 и TAGLN. Кластеры В (n=6) и С (n=10) характеризовались промежуточными уровнями экспрессии исследованных генов. Для кластера D (n=6) установлена высокая экспрессия мРНК генов LIF, GPX3, AQP3, NDRG1, GNLY, IMPA2, PAEP, IGFBP1, HABP2, DPP4 и TAGLN и низкая экспрессия генов POSTN, HLA-DOB, MSX1 (табл. 1).
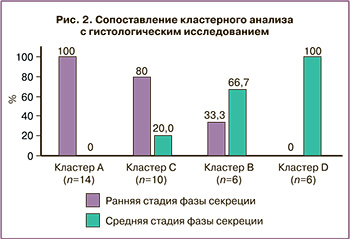 Распределение образцов эндометрия с помощью кластерного анализа хорошо соотносилось с гистологическим созреванием эндометрия. Так, принадлежность 100% образцов кластера А соответствовала стадии ранней фазы секреции (14 образцов), кластер С в 80% случаев (8 образцов) соответствовал ранней стадии фазы секреции, а в 20% – средней стадии фазы секреции, образцы кластера В – в 66,7% (4 образца), а кластера D – в 100% соответствовали средней стадии фазы секреции. Таким образом, кластерное стадирование эндометрия на фоне ЦГТ наглядно отражало гистологическое созревание эндометрия (рис. 2).
Распределение образцов эндометрия с помощью кластерного анализа хорошо соотносилось с гистологическим созреванием эндометрия. Так, принадлежность 100% образцов кластера А соответствовала стадии ранней фазы секреции (14 образцов), кластер С в 80% случаев (8 образцов) соответствовал ранней стадии фазы секреции, а в 20% – средней стадии фазы секреции, образцы кластера В – в 66,7% (4 образца), а кластера D – в 100% соответствовали средней стадии фазы секреции. Таким образом, кластерное стадирование эндометрия на фоне ЦГТ наглядно отражало гистологическое созревание эндометрия (рис. 2).
Частота положительных результатов β-хорионического гонадотропина между кластерами колебалась от 66,7% до 28,6%, однако не было установлено статистически значимой разницы. В то же время установлена статистическая значимая разница в частоте пролонгирования беременностей и родов живым плодом в кластере В. В кластере С также было выявлено более частое пролонгирование беременности и родов, однако результаты не были статистически значимы (ns), вероятно, из-за малочисленности выборки (табл. 2).

Обсуждение
Большинство опубликованных работ посвящены изучению особенностей транскрипционного профиля и влияния на гистологические изменения в эндометрии в естественном цикле [6–8, 11]. Особенностью данного пилотного исследования является изучение транскрипционного профиля генов в период «окна имплантации» на фоне ЦГТ, в ходе которого установлена более выраженная гетерогенность распределения образцов эндометрия при сопоставлении с гистологическим исследованием по сравнению с ранее опубликованной работой [12]. Также получены новые данные о том, что, несмотря на искусственно смоделированный цикл, за счет экзогенного воздействия Е2 и П в период «окна имплантации» в большем количестве образцов (n=24) была диагностирована ранняя стадия фазы секреции, т.е. морфологически «незрелая» структура эндометрия. Наши результаты не согласуются с результатами других исследований, в которых было показано, что гистологические признаки созревания эндометрия не коррелируют с использованием препаратов ЦГТ [13].
Молекулярно-генетическое исследование показало постепенное нарастание уровня экспрессии мРНК генов GPX3, PAEP, LIF, DPP4, TAGLN, HABP2, IMPA2, AQP3, IGFBP1, IL15, GNLY, NDRG1 и снижение уровня экспрессии мРНК генов HLA-DOB, MSX1, POSTN от кластера А к кластеру D. Полученные данные согласуются с проведенной нами ранее работой в естественном цикле, в результате которой было предложено аналогичное кластерное стадирование созревания эндометрия, как и на фоне ЦГТ: А → С → В → D [12].
На основании данной классификации выделены промежуточные стадии созревания эндометрия (кластеры В и С), которые соответствуют «окну имплантации» и оптимальны для переноса эмбриона. Наибольшая частота наступления клинической беременности, а также родов живым плодом была установлена среди женщин, у которых профиль экспрессии мРНК генов в эндометрии соответствовал промежуточным кластерам. Однако статистически значимые различия установлены только для кластера В: 4 из 6 случаев, относящихся к данной группе. В кластере С данный показатель составил порядка 20%. Причем в кластерах А и D были выявлены «попытки имплантации», однако дальнейшей инвазии и формирования цитотрофобласта не произошло, вероятно, ввиду недостаточной зрелости или «перезрелости» эндометрия, т.к. не было диагностировано ни одной клинической беременности. Аналогичные данные были получены испанскими коллегами, у которых была выявлена более высокая частота клинической беременности и родов среди пациенток с рецептивным эндометрием, при отсутствии положительных исходов лечения у пациенток с нерецептивным статусом [14].
Основным недостатком данного исследования является малочисленность выборки. Для более полного понимания диагностической ценности полученных данных необходимо проведение дальнейшего исследования данной методики на большем количестве пациентов.
Для повышения результативности программ ЭКО на основании данной работы предложен алгоритм персонифицированного выбора дня для переноса эмбриона у данной когорты пациенток. В цикле перед переносом эмбриона рекомендуется использовать молекулярно-генетическое исследование уровня экспрессии мРНК изученных в данной работе генов с последующим определением кластерной принадлежности эндометрия. Если транскрипционный профиль в полученном образце эндометрия соответствует кластерам В и С, рекомендовано производить перенос в стандартном протоколе на фоне ЦГТ на П+5 день. Если в результате исследования верифицирована стадия созревания эндометрия, соответствующая кластерам А и D, рекомендовано проведение дополнительной подготовки эндометрия перед переносом эмбриона или может быть рекомендован сдвиг переноса эмбриона на 12–24 ч позже стандартного подхода (для кластера А) в цикле ЦГТ П+5,5–6 или раньше (для кластера D) в цикле ЦГТ П+4,5.
Заключение
Исследование уровня экспрессии мРНК генов LIF, GPX3, AQP3, NDRG1, GNLY, IMPA2, PAEP, IGFBP1, HABP2, DPP4, TAGLN, IL15, POSTN, HLA-DOB, MSX1 на фоне ЦГТ хорошо отражает стадии развития имплантационного эндометрия и в дальнейшем может быть использовано для оптимизации сроков ПЭ.



