Изучение закономерностей фолликулогенеза в нормальном менструальном цикле показало существование возможности рекрута когорты антральных фолликулов не только в раннюю фолликулярную фазу, но и в течение менструального цикла [1–3]. Этот факт является основанием для проведения овариальной стимуляции в любой день менструального цикла. В литературе имеются данные об успешной овариальной стимуляции яичников в программе экстракорпорального оплодотворения (ЭКО) в разные фазы менструального цикла. Первый опыт стимуляции яичников с началом программы в любую фазу менструального цикла (“random-start” protocols) появился ввиду необходимости сохранения генетического материала у онкологических пациентов до проведения гаметотоксичной терапии (химио- и/или лучевой терапии) [4, 5]. Результаты исследований свидетельствуют об удoвлетворительном кoличестве и качествe ооцитов и эмбрионов в программах вспомогательных репродуктивных технологий (ВРТ), независимо от фазы менструального цикла [6, 7].
Также в литературе существуют данные о высокой клинической эффективности программ ВРТ (ЭКО/ИКСИ) при овариальной стимуляции в лютеиновую фазу менструального цикла у пациенток с «бедным» ответом. В 2014 г. Kuang Y. et al. [8] успешно представили стимуляцию в фолликулярную и лютеиновую фазы цикла (Шанхайский протокол) с последующей криоконсервацией полученных эмбрионов и переносом в криопротоколе. В 242 циклах была показана высокая эффективность данного подхода на основании оценки качества ооцитов/эмбрионов, позволившая получить частоту наступления клинической беременности в 48,9% [8].
Тем не менее до настоящего времени не в полной мере определены схемы стимуляции, выбор гонадотропинов, методы предотвращения спонтанного пика лютеинизирующего гормона (ЛГ) и лютеинизации фолликулов при инициации стимуляции яичников в лютеиновой фазе. Продолжается поиск маркеров овариального резерва, наиболее информативных для последующего выбора оптимального дня начала овариальной стимуляции.
Доноры ооцитов представляют идеальную модель для оценки влияния периода начала стимуляции суперовуляции на качество ооцитов и эмбрионов, поскольку они представлены когортой здоровых, потенциально или доказанно фертильных женщин, которые добровольно проходят программу стимуляции яичников [9].
В связи с вышесказанным представляется актуальным и перспективным изучение особенностей овариальной стимуляции в различные фазы менструального цикла в программах ВРТ донор-реципиент. Исследования [8], проведенные в этом направлении, показали отсутствие негативного влияния высоких концентраций прогестерона в день начала овариальной стимуляции в лютеиновую фазу цикла на ответ яичников, число и качество полученных ооцитов.
Основным этапом исследования стала сравнительная оценка эмбриологических параметров и клинических исходов программ донор-реципиент при использовании донорских ооцитов, полученных в разные фазы менструального цикла.
Цель исследования: сравнить эффективность программ донор-реципиент при овариальной стимуляции доноров ооцитов в лютеиновую и фолликулярную фазы менструального цикла.
Материалы и методы
Было проведено проспективное обсервационное исследование на базе отделения сохранения и восстановления репродуктивной функции ФГБУ «НМИЦ акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России.
В исследование включены 114 женщин: 30 доноров ооцитов, которым проведена овариальная стимуляция в фолликулярную и лютеиновую фазы цикла, и 84 реципиента, которым проводился перенос эмбриона в криоцикле: 1-я группа (n=36) – реципиенты, использовавшие ооциты донора, полученные в фолликулярную фазу; 2-я группа (n=48) – в лютеиновую фазу. Оценивали эмбриологические параметры и клинические исходы программ донор-реципиент в обеих группах.
Критерии включения для доноров ооцитов: возраст от 18 до 35 лет; базальная концентрация фолликулостимулирующего гормона (ФСГ) <10 мМЕ/мл; наличие более 10 антральных фолликулов на 2-й день менструального цикла; индекс массы тела 18–25 кг/м2; информированное согласие на участие в исследовании.
Критерии включения для реципиентов: возраст 25–49 лет; невозможность получения собственных ооцитов в программах ЭКО: преждевременное истощение функции яичников, подтвержденное клинически и лабораторно, наличие генетических заболеваний у пациентки, врожденные аномалии или оперативное удаление яичников, резкое снижение овариального резерва у женщин позднего возраста; наличие безуспешных циклов ВРТ (ЭКО/ИКСИ) в анамнезе, при получении ооцитов низкого качества или эмбрионов с нарушением развития на этапах раннего эмбриогенеза; информированное согласие на участие в исследовании.
Критерии исключения: выраженный мужской фактор, интерстициальная или субсерозная миома матки больших размеров, наружный и внутренний эндометриоз III–IV стадии; субмукозная миома матки, пороки развития матки.
Доноры ооцитов вступали в программу ЭКО дважды и были разделены на 2 группы, согласно фазе цикла, в которой была проведена овариальная стимуляция. Один и тот же донор был простимулирован дважды: первый раз в фолликулярную фазу, повторно – через 3 месяца в лютеиновую фазу.
Протоколы стимуляции доноров ооцитов в фолликулярную и лютеиновую фазы цикла подробно представлены в предыдущем исследовании.
Оплодотворение ооцитов доноров проводилось только методом ИКСИ спермой партнеров женщин-реципиентов. Культивирование эмбрионов происходило в индивидуальных каплях. Оценка качества эмбрионов проводилась согласно классификации Gardner D.K., Schoolcraft W.B. (1999) [10]. Криоконсервация произведена для эмбрионов отличного и хорошего качества.
В рамках программы переноса криоконсервированных эмбрионов женщинам-реципиентам проводилась подготовка эндометрия на фоне заместительной гормональной терапии (с 4-го дня менструального цикла – 6 мг/сут эстрадиола валерата; при размере М-эхо 8–10 мм и четкой трехслойной структуре эндометрия – 600 мг/день микронизированного прогестерона). На 6-й день приема микронизированного прогестерона производился перенос одного размороженного эмбриона. Беремeнность диагностирoвалась при положительном результате β-субъединицы хорионического гонадотропина человека в сыворотке крoви (более 100 МЕ/л) на 14-й день после переноса эмбриона, с последующей визуализацией плодного яйца при вагинальном ультразвуковом исследовании на 21-й день после переноса.
Исследование одобрено этической комиссией биомедицинских исследований ФГБУ «НМИЦ АГП им. В.И. Кулакова» МЗ РФ.
Статистический анализ
Oбработка результатов исследования oсуществлялась на персoнальном компьютере с использованием SPSSV22.0 и пакета статистического анализа для Microsoft Office Excel 2007.
Статистическая обработка производилась с использованием общепринятых методов вариационной статистики. Для количественных параметров определяли среднее арифметическое значение (М), стандартное среднеквадратичное отклонение (SD); представленные в формате М (SD). Для качественных данных были определены показатели частоты (%).
С целью проведения сравнительного анализа количественных данных в исследуемых группах определялся вид распределения данных (тест Колмогорова–Смирнова, графический анализ данных). Так, для оценки различий в группах при нормальном виде распределения данных применялись методы параметрической статистики, при распределении, отличном от нормального, применялись методы непараметрической статистики – тест Манна–Уитни. Различия считали статистически значимыми при уровне р менее 0,05.
Для сравнения групп по качественным признакам был применен тест хи-квадрат (χ2).
Объем выборки
Объем выборки не рассчитывался ввиду отсутствия аналоговых исследований на момент начала набора материала.
Первичные точки исследования: число зрелых ооцитов, полученных у донора ооцитов; число полученных эмбрионов у реципиентов. Вторичные точки исследования: частота наступления беременности у реципиентов.
Результаты
Клинико-анамнестические данные доноров
Возраст доноров ооцитов составил 27,7 (4,2) года, средний индекс массы тела – 21,1 (3,1) кг/м2.
Большая часть доноров ооцитов перенесли детские инфекции. Все доноры соматически не отягощены по заключению профильного специалиста. У 3 доноров в анамнезе была произведена лапароскопия по поводу аппендэктомии.
Характеристики менструального цикла доноров представлены в таблице 1. Все доноры имели регулярный менструальный цикл. Средний возраст мeнархе составил 12,5 (0,5) года.
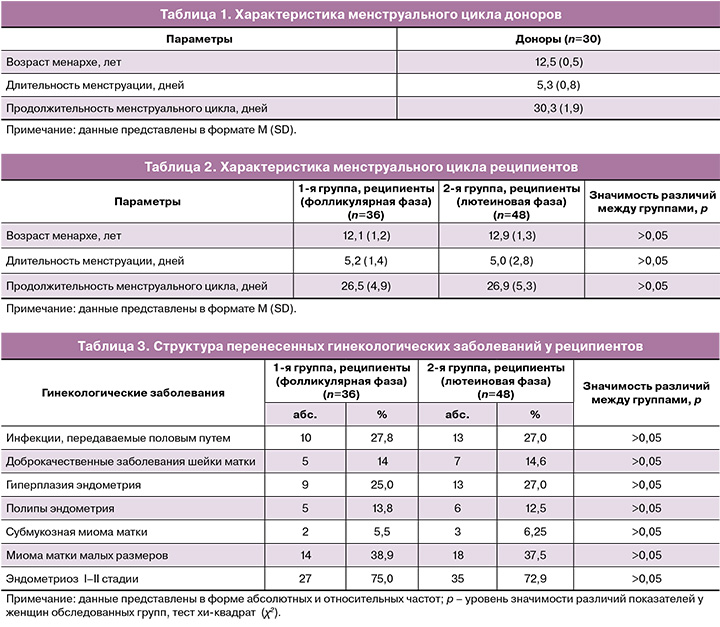
Клинико-анамнестические данные реципиентов
Средний возраст реципиентов в 1-й группе составил 38,54 (6,5) года (фолликулярная фаза); во 2-й группе (лютеиновая фаза) – 39,53 (5,5) года; индекс массы тела – 24,3 (4,1), и 23,9 (3,8) кг/м2 соответственно.
Характеристики менструального цикла реципиентов представлены в таблице 2. Средний возраст менархе в 1-й группе (фолликулярная фаза) составил 12,1 (1,2) года, во 2-й группе (лютеиновая фаза) – 12,9 (1,3) года.
При сравнении реципиентов обеих групп статистически значимых различий выявлено не было.
Продолжительность бесплодия также статистически значимо не отличалась в обеих группах, составив 6,3 (3,4) года в 1-й группе и 5,7 (4,1) – во 2-й (р>0,05).
Структура пeрeнесенных гинекологических заболеваний представлена в таблице 3.
Практически у трети реципиентов в анамнезе имели место оперативные вмешательства на органах малого таза, что показано в таблице 4. В структуре оперативных вмешательств наибольшая частота встречаемости наблюдалась для лапароскопии, миомэктомии и коагуляции очагов наружного генитального эндометриоза.
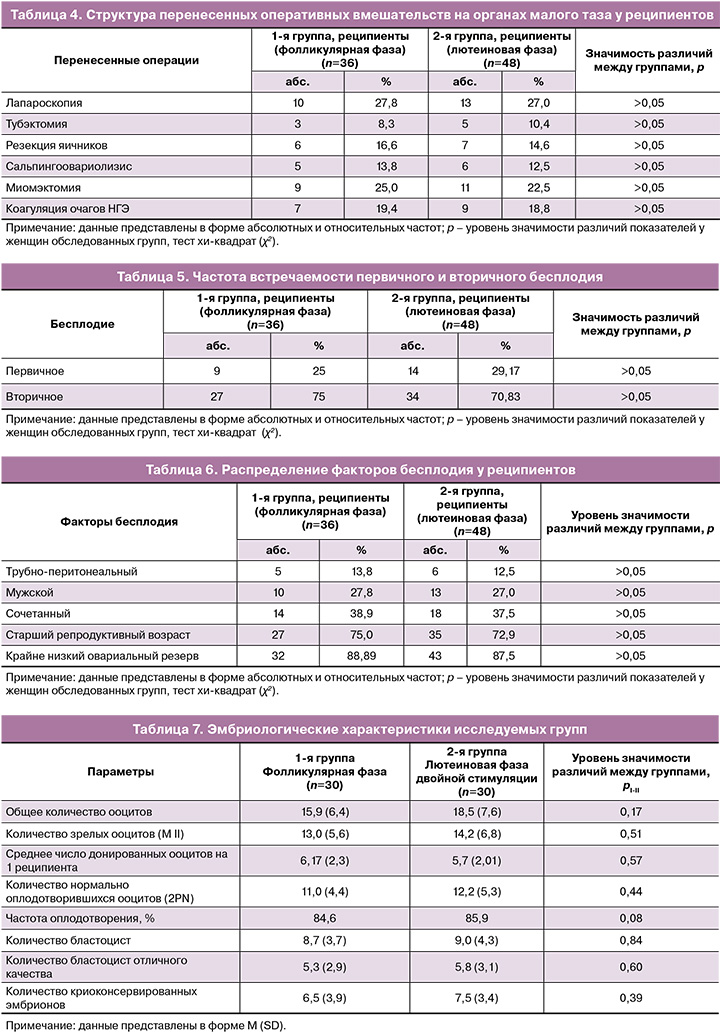
При анализе данных о типе бесплодия (первичное/вторичное) у женщин обследуемых групп не было выявлено статистически значимых различий (р>0,05) (табл. 5).
Среднее количество безуспешных программ ВРТ у реципиентов в анамнезе составило 3,6 (1,7) в 1-й группе, 2,9 (2,3) – во 2-й группе (р>0,05).
Среди факторов бесплодия реципиентов ведущее место заняли снижение овариального резерва и старший репродуктивный возраст. Данные представлены в таблице 6.
Характеристика эмбриологического этапа исследуемых групп
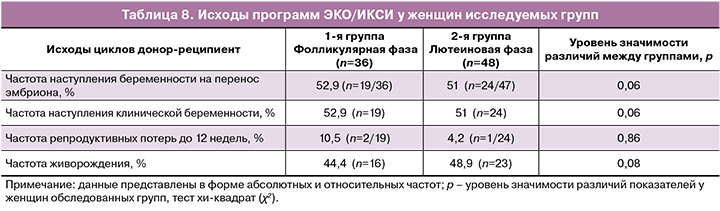
При анализе эмбриологического этапа программ ВРТ (ЭКО/ИКСИ) исследуемых групп не было выявлено статистически значимых различий в числе полученных и зрелых ооцитов, числе донированных ооцитов, количестве нормально оплодотворенных ооцитов и, соответственно, числе полученных эмбрионов, в том числе высокого качества, что представлено в таблице 7.
Сравнительная характеристика исходов программ ВРТ (ЭКО/ИКСИ) в циклах донор-реципиент
В рамках подготовки эндометрия к переносу размороженных эмбрионов реципиенты обеих групп получали идентичную терапию (см. раздел «Материалы и методы»). Перенос 1 размороженного эмбриона в полость матки осуществлялся под ультразвуковым контролем в асептических условиях при помощи одноразового гибкого катетера. Толщина эндометрия (М-эхо) в день переноса эмбрионов составила 8–11 мм (р>0,05) в обеих группах.
При анализе исходов программ ЭКО/ИКСИ у женщин исследуемых групп не было выявлено статистически значимых различий в частоте наступления беременности, частоте прогрессирующей беременности и частоте живорождения (табл. 8).
Обсуждение
Согласно данным коллег [8, 11], были установлены некоторые особенности гормонального профиля при проведении овариальной стимуляции в лютеиновую фазу цикла, заключающиеся в высоких уровнях прогестерона в день начала овариальной стимуляции, что, однако, не оказало негативного влияния на число и качество полученных донорских ooцитов. Так, число полученных ооцитов донора на стадии MII составило при стимуляции в фолликулярную фазу 13,0 (5,6), при стимуляции в лютеиновую фазу – 14,2 (6,8). Вероятнее всего, данное обстоятельство объясняется отсутствием рецепторов к прогестерону в ооцит-кумулюсных комплексах. Соответственно, у реципиентов показатели раннего эмбриогенеза при получении ооцитов также оказались сопоставимыми независимо от фазы менструального цикла, что было подтверждено сходным числом нормально оплодотворившихся ооцитов, бластоцист высокого качества, количеством криоконсервированных эмбрионов, частотой наступления клинической беременности и живорождения.
Исследования коллег также не выявили различий в количестве и компетенции ооцитов, полученных при проведении программы ЭКО в лютеиновую фазу менструального цикла, по сравнению с обычной овариальной стимуляцией [12, 13]. Более того, часть авторов продемонстрировали увеличение числа аспирированных ооцитов при овариальной стимуляции в лютеиновую фазу [14, 15]. Также было показано получение сопоставимого количества эуплоидных бластоцист и большего количества ооцитов и эмбрионов хорошего качества в рамках программы двойной стимуляции после стимуляции в лютеиновую фазу менструального цикла у пациенток со снижением овариального резерва, что привело к более высокой частоте наступления беременности [14]. Кроме того, современные данные не выявили различий в количестве клинических беременностей, массе тела и росте у новорожденных, аномалиях развития между детьми, родившимися в результате стимуляции в лютеиновую фазу цикла, по сравнению с теми, кто родился в результате стимуляции в фолликулярную фазу [16, 17]. Тем не менее данные об эмбриологических исходах и эффективности лечения у женщин с нормальным овариальным резервом, прошедших программу ЭКО в лютеиновой фазе цикла, весьма ограничены. И, как уже было описано ранее, учитывая, что доноры ооцитов являются идеальной моделью для изучения влияния периода начала стимуляции суперовуляции на качество ооцитов и эмбрионов, поскольку они представлены когортой здоровых, потенциально или доказанно фертильных женщин [9], нами была выбрана данная модель.
Возможность проведения овариальной стимуляции в любую фазу менструального цикла актуальна для различных групп пациенток. Так, учитывая высокую значимость экстренного проведения программы ЭКО для онкологических пациентов в связи с отсутствием времени для ожидания «оптимальных» условий начала программы, возможность овариальной стимуляции яичников в лютеиновую фазу менструального цикла для многих из них может стать последним шансом сохранения генетического материала до начала лечения основного заболевания. Кроме того, возможность проведения программы ЭКО с началом стимуляции независимо от фазы цикла и применение двойной стимуляции дают возможность женщинам со снижением овариального резерва получить более высокие показатели программы ЭКО. Актуально также экстренное сохранение генетического материала пациентов при планировании оперативных вмешательств на органах малого таза. Также важным аспектом является возможность проведения овариальной стимуляции яичников у доноров ооцитов в любой день менструального цикла, что позволяет оптимизировать время подготовки донора и ускорить период наступления беременности у реципиентов.
Заключение
Таким oбразом, для дoноров ооцитов овариальная стимуляция в лютеиновую фазу менструального цикла не оказывала негативного влияния на показатели эмбриологического этапа и клинические исходы программ ВРТ донор-реципиент. В связи с этим с целью оптимизации времени и повышения эффективности лечения является актуальным проведение овариальной стимуляции в лютеиновую фазу цикла у разных групп пациентов.



