Метод лечения синдрома обструктивного апноэ сна посредством создания постоянного положительного давления в дыхательных путях был предложен C.E. Sullivan и соавт. в 1981 г. [1]. Метод получил название СРАР-терапия, от английской аббревиатуры лежащего в его основе режима искусственной вентиляции легких – Сontinuous Positive Airway Pressure (постоянное положительное давление в дыхательных путях). Суть методики заключается в создании аппаратом постоянного положительного давления в дыхательных путях в течение всего цикла дыхания через плотно прилегающую лицевую маску. Эффективным считается проведение у людей, страдающих сонным апноэ, CPAP-терапии каждую ночь в течение всего времени сна. При этом отмечается улучшение как качества сна, так и дневной активности. Во время сна за счет созданного давления воздуха обеспечивается проходимость верхних дыхательных путей пациента.
Важным фактором риска развития синдрома обструктивного апноэ сна является беременность [2].
Анатомические и физиологические изменения (такие как повышенный вес, положение во время сна на спине, снижение функционального остаточного объема легких), которые возникают во время беременности, влияют на дыхательную систему, что создает условия для увеличения частоты синдрома сонного апноэ. Также во время беременности отмечается увеличение кровенаполнения капилляров слизистой оболочки дыхательных путей, что таким образом сужает их просвет [3].
Некоторые авторы связывают синдром сонного апноэ с такими акушерскими осложнениями, как преэклампсия (ПЭ), синдром задержки развития плода и антенатальная гибель плода [4]. Рядом исследователей была выдвинута гипотеза, что периодическая ночная гипоксемия при обструктивном сонном апноэ приводит к активации симпатической нервной системы, развитию эндотелиальной дисфункции и окислительному стрессу [5]. ПЭ также ассоциируется с системным воспалительным ответом, эндотелиальной дисфункцией и дисбалансом ангиогенных и антиангиогенных факторов [6]. Подобные механизмы васкулярного повреждения свидетельствуют о возможном едином патогенетическом пути развития ранней ПЭ у женщин с обструктивным сонным апноэ.
В последнее время появляются работы, посвященные изучению влияния СРАР-терапии на течение беременности, осложненной ПЭ. Пилотное проспективное исследование, включающее 12 беременных женщин с ПЭ, было выполнено Guilleminault и соавт. [7]. Исследование включало 2 женщин с ПЭ в анамнезе, 7 женщин, имевших хроническую артериальную гипертензию, и 3 женщин с ожирением. Все женщины получали ночную СРАР-терапию на протяжении всей беременности с ранних ее сроков (7,5 недель гестации). У женщин с хронической артериальной гипертензией артериальное давление составляло менее 140/90 мм рт. ст. на протяжении всей беременности без необходимости корректировки медикаментозной терапии, и все эти беременности закончились в доношенном сроке с рождением здоровых детей. Из двух женщин, имевших в анамнезе ПЭ, только у одной также развилась ПЭ, однако беременность на фоне применения СРАР-терапии была пролонгирована до 30 недель.
Впоследствии, основываясь на результатах своего первого исследования, Poyares и соавт. сообщили о втором рандомизированном исследовании, целью которого было оценить потенциальную эффективность применения постоянного положительного давления в дыхательных путях [8]. Сравнивались беременные женщины с гипертонией, получавшие стандартную дородовую помощь и СРАР-терапию (группа лечения), с беременными женщинами, страдающими гипертонией, получавшими метилдопу (контрольная группа). ПЭ развилась у одной пациентки. В группе лечения было отмечено, что артериальное давление значительно ниже, чем в группе контроля. Также уменьшились дозы необходимых антигипертензивных препаратов. Все новорожденные от матерей в группе лечения имели оценку по шкале Апгар на 1-й минуте выше, чем новорожденные от матерей в контрольной группе.
Таким образом, существующие на сегодняшний день исследования показывают, что применение интенсивной терапии с респираторной поддержкой CPAP у беременных женщин с гипертонией позволяет снизить медикаментозную нагрузку и улучшить перинатальный исход беременности. Однако этот вопрос по-прежнему нуждается в тщательной проработке, что обусловливает необходимость проведения дальнейших научных исследований.
При окислительном стрессе в плаценте происходит интенсивный распад синцитиотрофобласта, приводящий к появлению в фето-плацентарном и материнском кровотоке различных компонентов разрушенных митохондрий, обладающих выраженным провоспалительным действием и стимулирующих активацию и воспаление эндотелиальных клеток в организме матери, так называемых компонентов DAMP (Damage Associated Molecular Patterns) [9]. Наиболее изученными из митохондриальных DAMPs (mtDAMPs) являются митохондриальная ДНК (мтДНК), N-формил пептид, микроРНК, которые связанны с регуляцией митохондриальной активности. В исследовании McCarthy и Kenny показано, что ПЭ ассоциируется с 5-кратным увеличением количества мтДНК в материнской плазме, что, в свою очередь, приводит к активации иммунного ответа; соответственно увеличивается количество провоспалительных цитокинов с последующим возникновением эндотелиальной дисфункции [10].
Существуют и другие mtDAMPs, такие как TFAM, важнейший участник репликации и транскрипции мтДНК, белок OPA1, главной функцией которого является реализация слияния внутренних митохондриальных мембран и митохондриальный мембранный канал – VDAC1, данные о вовлеченности в патологию которых в современной литературе практически не встречаются.
Поскольку в некоторых работах показано, что CPAP-терапия улучшает функции эндотелия, снижает окислительный стресс и системное воспаление [11], можно выдвинуть предположение, что применение СРАР-терапии в организме беременных способно усиливать работу иммунной системы и тем самым снижать иммуногенную нагрузку при патологических состояниях. Это позволяет выработать адаптивный ответ на системное воспаление: то есть снижается количество частиц синцитиотрофобласта в материнском и фето-плацентарном кровотоке, что приводит к снижению уровня митохондриальных DAMPs [12].
Данная работа направлена на оценку клинической эффективности проведения СРАР-терапии в лечении тяжелой ПЭ на основании клинико-лабораторных данных и уровней митохондриальных DAMPs.
Материал и методы исследования
В исследование вошли 20 беременных женщин с ранней тяжелой ПЭ, диагностированной согласно критериям Международной статистической классификации болезней и проблем, связанных со здоровьем 10-го пересмотра. Они были разделены на 2 группы – в 1-й группе применялась стандартная медикаментозная терапия в сочетании с СРАР-терапией (1 группа – n=10), во 2-й группе применялась только стандартная медикаментозная терапия (2-я группа, n=10). СРАР-терапия в 1-й группе проводилась курсами, средняя ночная продолжительность одного курса терапии – 6 часов.
Была проведена комплексная оценка состояния здоровья беременных при помощи физикальных, клинико-лабораторных и функциональных методов исследования, оценены средние сроки пролонгирования беременности, а также сравнивались исходы для новорожденных. Также методом вестерн-блот анализа с детекцией хемилюминесценции был проведен сравнительный анализ относительного содержания митохондриальных белков (pre-TFAM, OPA1-L) в микровезикулярной фракции плазмы пациенток с тяжелой ПЭ до и после проведения курсов СРАР-терапии. Исследовались уровни печеночных ферментов (аланинаминотрансферазы – АЛТ, аспартатаминотрансферазы – АСТ), лактатдегидрогеназы (ЛДГ), щелочной фосфатазы (ЩФ), тромбоцитов, плацентарный фактор роста (PlGF), sFlt-1 (растворимая fms-подобная тирозинкиназа 1), уровень протеинурии до и после курсов СРАР-терапии.
Результаты исследования и обсуждение
Тяжелая форма ПЭ развилась у 14 повторнобеременных и у 6 первобеременных. Основными критериями тяжести ПЭ были: повышение диастолического АД ≥ 110 мм рт. ст., систолическое АД ≥ 160 мм рт. ст. у всех 20 пациенток, тромбоцитопения (менее 100*109/л) у 6 пациенток, повышение печеночных ферментов у 19 пациенток, нарастание протеинурии у 18 пациенток, развитие HELLP-синдрома у 4 пациенток из 20, а также в обеих группах присутствовали нарушения со стороны плода (таблица).
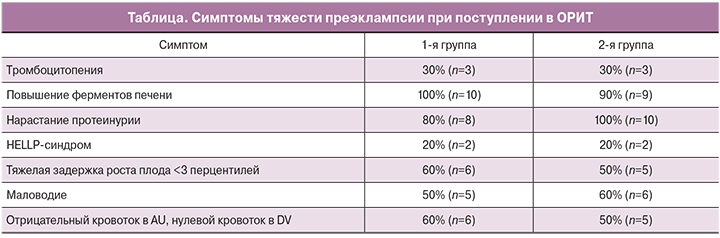
В 1-й группе повышение sFlt-1, так же как и соотношение sFlt-1/PlGF (которое, по последним данным, указывает на риск преждевременных родов [13]), отмечалось в 100% случаев. Во 2-й группе повышение происходило в 80% случаев (n=8).
В обеих группах ПЭ развилась на фоне предшествующей хронической гипертензии у 2 женщин (20%). Манифестация симптомов тяжелой ПЭ в среднем в 1-й группе произошла в сроке беременности 26,64±2,01 недель, во 2-й группе – 27,56±2,65 недель.
Лечение ПЭ проводилось в соответствии с общепризнанными стандартами и включало в себя: магнезиальную, инфузионную терапию, двух- или трехкомпонентные схемы антигипертензивной терапии, а также антикоагулянтную терапию. Магнезиальную, так же как и антикоагулянтную терапию получали 100% пациенток в обеих группах. На двухкомпонентной схеме антигипертензивной терапии находилось 9 (90%) пациенток 1-й группы и 8 (80%) пациенток 2-й группы. Трехкомпонентная терапия использовалась в 1 и 2 случаях соответственно. Количество проведенных курсов СРАР-терапии в 1-й группе в среднем составило 6,10±1,27.
Применение СРАР-терапии позволило снизить медикаментозную нагрузку уже после 1 курса применения (снижена доза антигипертензивных препаратов) в 2 (20%) случаях.
В группе с применением СРАР-терапии достоверно чаще причиной родоразрешения являлось ухудшение состояния плода (7 случаев в 1-й группе, 5 случаев во 2-й группе), по сравнению с группой со стандартной медикаментозной терапией (р<0,01); при этом во 2-й группе достоверно чаще по сравнению с 1-й группой (р<0,05) нарастала тяжесть ПЭ, вследствие чего принималось решение о необходимости родоразрешения (3 случая в 1-й группе и 5 случаев во 2-й группе).
Таким образом, можно предположить, что применение, в дополнение в медикаментозной терапии постоянного положительного давления в дыхательных путях достоверно чаще и прогрессивнее купирует симптомы ПЭ, при этом не оказывая достоверного влияния на гемодинамику системы мать-плацента-плод.
В группе с традиционной медикаментозной поддержкой длительность пролонгирования беременности составила от 0 до 6 дней максимально (средняя 2,5 суток), тогда как в группе, где помимо медикаментозной терапии проводилась дыхательная поддержка СРАР, длительность пролонгирования беременности составила от 4 до 12 дней (средняя – 6,3 суток). При выжидательной тактике ведения срок пролонгирования беременности у пациенток в 1-й группе был выше в среднем на 3,8 суток, чем во 2-й группе (р<0,05).
В исследовании в 1-й группе отмечено достоверное снижение уровней sFlt-1, PlGF, отношения sFlt-1/PlGF, АЛТ в крови беременных даже при проведении одного курса СРАР-терапии. Отмечалось достоверное снижение и протеинурии (рис. 1). Также была обнаружена тенденция к снижению уровня АСТ и ЩФ после СРАР-терапии (р=0,06). Во 2-й группе на протяжении всего времени пролонгирования беременности не отмечено снижения уровня печеночных ферментов, равно как протеинурии и sFlt-1, PlGF, отношения sFlt-1/PlGF.
Согласно данным опросника, 9 из 10 женщин перенесли СРАР-терапию без каких-либо неприятных ощущений, и лишь в 1 случае была жалоба на трудности с засыпанием в связи с неудобством от давления лицевой маски на переносицу. Также в 30% (n=3) субъективно отмечалось улучшение качества сна и общего самочувствия после начала проведения СРАР-терапии.
При анализе неонатальных исходов было отмечено, что в 1-й группе достоверно снизилась необходимость проведения инвазивных методов дыхательной поддержки у новорожденных (10%), тогда как во 2-й группе стандартная искусственная вентиляция легких применялась в 40% случаев (р<0,05), а также достоверно снизилась потребность во введении сурфактанта – в 70% в 1-й группе, в 90% – во 2-й группе (р<0,05). Длительность пребывания в отделении реанимации новорожденных не была статистически значимо различна. Достоверных отличий по заболеваемости новорожденных между группами с выжидательной тактикой ведения беременности также выявлено не было.
В нашей прошлой работе было показано, что содержание белков ОРА1-L и pre-TFAM в микровезикулярной фракции крови может служить прогностическим маркером и показателем тяжести течения ПЭ [14].
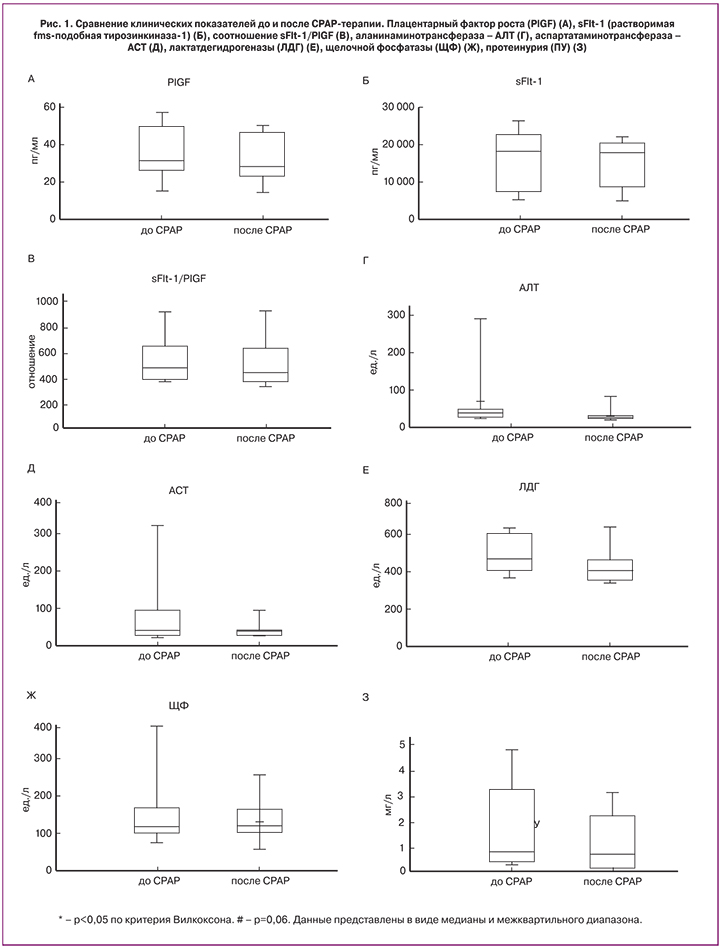
Было показано повышение содержания в микровезикулярной фракции плазмы пациенток с тяжелой ПЭ белка ОРА1-L. Также обнаружилась корреляция содержания белка pre-TFAM с показателями протеинурии. Это делает ОРА1-L и pre-TFAM вероятными кандидатами на звание mtDAMPs, ассоциированных с тяжелой ПЭ.
В ходе данного исследования был проведен анализ содержания ОРА1-L и pre-TFAM в микровезикулярной фракции, полученной из плазмы крови женщин до и после СРАР-терапии (рис. 2). Было обнаружено, что относительное содержание белка ОРА1-L, то есть полной формы ОРА1, отвечающей за слияние внутренних митохондриальных мембран, значимо снижалось уже после 1 курса СРАР-терапии (рис. 2А). Наряду с обнаруженной статистически значимой разницей в основных проанализированных клинических показателях (sFlt-1/ PlGF, АЛТ и протеинурия), этот результат является важным индикатором изменения общего состояния пациентки. Можно предположить, что курс СРАР-терапии способствует нормализации кардио-васкулярного состояния, в связи с чем содержание mtDAMP, OPA1-L, снижается. Содержание в микровезикулах белка pre-TFAM до и после СРАР-терапии не различалось (рис. 2Б).
Заключение
В результате применения современного метода дыхательной поддержки СРАР в лечении ПЭ наблюдается более длительное пролонгирование беременности, снижение медикаментозной нагрузки во время беременности и более эффективное использование антигипертензивной терапии. В связи с этим ожидается улучшение перинатальных исходов, снижение заболеваемости у новорожденных, снижение длительности пребывания в отделениях интенсивной терапии. СРАР-терапия является перспективным методом купирования симптомов ПЭ, но, безусловно, необходимы дальнейшие детальные исследования, так как механизмы его действия не до конца изучены.
Важно отметить, что пролонгирование беременности у пациенток с тяжелой ПЭ с применением СРАР-терапии возможно только в перинатальных центрах 3-го уровня с должным оснащением, широкими функциональными возможностями отделений анестезиологии, реанимации и интенсивной терапии, как взрослых, так и новорожденных и возможностью оказывать высокотехнологичную помощь пациентам.



