Рак шейки матки (РШМ) является одним из наиболее распространенных злокачественных заболеваний у женщин [1, 2]. В мире ежегодно диагностируется более 500 000 случаев РШМ, которые в половине случаев заканчиваются летально.
В последние десятилетия значительные успехи были достигнуты в понимании молекулярных механизмов канцерогенеза и развития РШМ [3, 4]. Однако полное понимание механизмов патогенеза заболевания остается невыясненным. Одной из основных причин заболевания является инфицированность высокоонкогенными типами вируса папилломы человека (ВПЧ) базальных эпителиальных клеток шейки матки, сопровождающееся синтезом ранних вирусных онкопротеинов Е5, Е6 и Е7, нарушающих процессы апоптоза и пролиферации и инициирующие гиперпластические процессы в пораженной ткани вплоть до РШМ [5, 6].
Выявление молекулярных факторов в развитии неопластической трансформации шейки матки имеет важное значение для разработки новых терапевтических мишеней для профилактики и лечения РШМ.
В последние годы была показана важная роль не транслируемых низкомолекулярных РНК – микроРНК в развитии неопластической трансформации и злокачественных опухолей [7]. МикроРНК – кроткие одноцепочечные молекулы длиной 20–25 нуклеотидов, осуществляющие регуляцию экспрессии генов на посттранскрипционном уровне. МикроРНК участвуют в регуляции большинства фундаментальных биологических процессов развития организма: делении клеток, смене фаз клеточного цикла, апоптозе, клеточной миграции и инвазии, ангиогенезе, формировании иммунного ответа [8]. Исследования последних лет свидетельствуют о наличии ассоциации изменений уровней экспрессии микроРНК с неопластическими процессами шейки матки [9]. В настоящее время определены более 50 микроРНК, экспрессия которых при неопластической трансформации эпителия шейки матки меняется в процессе перехода от нормы к цервикальной интраэпителиальной неоплазии (CIN) I и далее к CIN II, CIN III и цервикальному раку [10]. Развитие как предраковых, так и злокачественных процессов сопровождается повышением экспрессии так называемых проонкогенных микроРНК, усиливающих пролиферативную активность клеток, способствующих их метастазированию и инвазии, активирующих локальный ангиогенез. Одновременно снижается синтез противоонкогенных микроРНК, обеспечивающих функцию апоптоза, тормозящих процессы пролиферации, миграции, инвазии и ангиогенеза. Исследование динамики изменения микроРНК на разных стадиях развития цервикальной неоплазии дает перспективу для разработки маркеров ранней диагностики и терапии заболевания.
В связи с этим целью настоящей работы было оценить возможность дифференциальной диагностики степени тяжести неоплазии шейки матки на основании количественной оценки экспрессии противоонкогенных микроРНК: has-mir-143*-3р, has-mir-145*-3р, has-mir-199a-5р и has-mir-122-5р в соскобах шеечного эпителия.
Материал и методы исследования
В исследование вошла 101 женщина в возрасте от 18 до 49 лет (средний возраст 32,7±0,5 года), которые были разделены на 4 группы: без патологии шейки матки (30 пациенток), с плоскоклеточным интраэпителиальным поражением низкой степени (L-SIL, 32 пациентки), с плоскоклеточным интраэпителиальным поражением высокой степени (H-SIL, 26 пациенток) и с РШМ (13 пациенток).
Критерии включения в основную группу: женщины в возрасте от 18 до 49 лет, предраковые заболевания шейки матки и РШМ, подтвержденные морфологическими методами диагностики. Критерии исключения: беременность, отсутствие возможного следования протоколу. Среднее время наблюдения за пациентами составило 15,8 месяца. Комплексное обследование женщин включало сбор жалоб, анамнеза, оценку гинекологического статуса (наличие патологических процессов аногенитальной области, слизистой влагалища и шейки матки, наличие или отсутствие остроконечных кондилом), расширенную кольпоскопию, молекулярно-биологические методы исследования, цитологическое исследование, гистологическое исследование биопсийного материала.
Для исследования экспрессии микроРНК соскобы эпителия шейки матки брали с помощью урогенитальных зондов, собранный материал переносили в пробирки с физиологическим раствором и немедленно центрифугировали при 1600g в течении 10 минут. Надосадок удаляли, осадок растворяли в 100 мкл физиологического раствора. Суммарную РНК выделяли с использованием набора реагентов miRNeasy Mini Kit (Qiagen GmbH, Hilden, Germany) в соответствии с инструкцией к нему. Реакцию обратной транскрипции проводили, используя коммерческие микроРНК-специфические затравки и набор реактивов TaqMan microRNA Reverse Transcription Kit (Life Technologies, Grand Island, NY). Измерение уровня экспрессии микроРНК проводили методом количественной полимеразной цепной реакции в реальном времени с использованием коммерческих праймеров TaqMan miRNA Assay (Life Technologies, Grand Island, NY), набора реагентов TaqMan Universal PCR Master Mix (Life Technologies, Grand Island, NY) и детектирующего амплификатора ДТ-96 (компания ДНК-Технология, Россия). Количественное измерение микроРНК проводили в условных единицах путем оценки ∆∆Сt отношения к количеству ДНК, измеренному в том же объеме (5 мкл).
Для оценки суммарного уровня экспрессии одновременно по нескольким микроРНК данные их экспрессии у каждого пациента суммировали, используя формулы: для двух микроРНК – Аs=αА1+βА2, и для трех микроРНК – Аs=αА1+βА2+gА3, где А1, А2 и А2 – значение уровня экспрессии для каждой микроРНК, α, β и g – коэффициенты регрессии. Для mir-143 – коэффициент выравнивания равен 1, для mir-145 – 27,7, для mir-199 – 129,4.
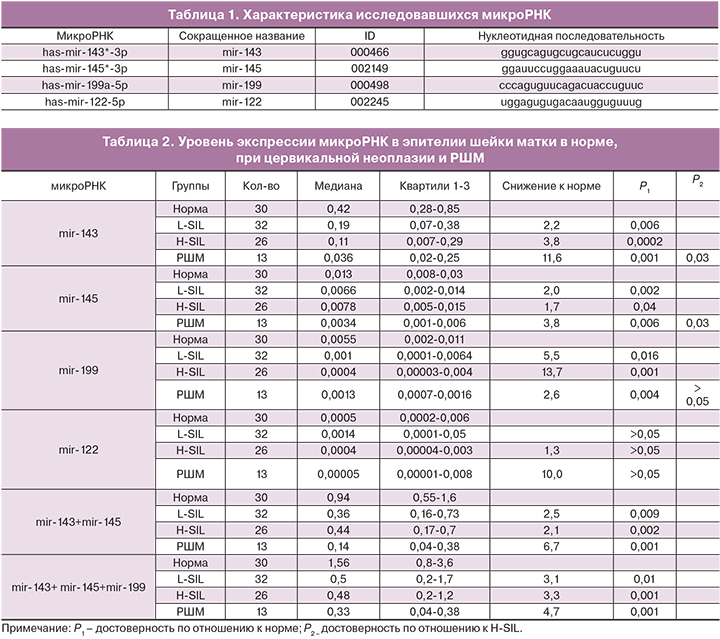
В табл. 1 приведено описание микроРНК, исследовавшихся в данной работе.
Статистическую обработку результатов исследования экспрессии микроРНК проводили методом непараметрического анализа с использованием программы Statistica 10, IBM SPSS Statistics v22. Для сопоставления двух групп по количественным признакам применяли U-критерий Манна–Уитни. Различие между группами полагали статистически значимыми при р<0,05. Для выявления точки отсечки положительных результатов диагностического теста и определения его диагностической точности использовались бинарная логистическая регрессия и ROC-кривая.
Результаты исследования
В табл. 2 приведены результаты оценки уровня экспрессии микроРНК в соскобе эпителия шейки матки при разной тяжести развития неоплазии.
Данные, полученные в работе, показали выраженное прогрессирующее снижение экспрессии mir-143 в шеечных соскобах по мере утяжеления степени неопластического поражения. Наибольшее снижение по сравнению с нормой отмечено при РШМ – в 11,6 раза (р=0,0001), в 3,8 раза – при H-SIL и в 2,2 раза – при L-SIL. При этом экспрессия mir-143 при РШМ в 3,1 раза ниже, чем при H-SIL (р=0,03) и в 5,3 раза ниже, чем при L-SIL (р=0,008). Уровень экспрессии mir-143 у женщин с H-SIL был снижен и по сравнению с L-SIL, хотя это различие было не достоверным.

Аналогичный, хотя и в меньшей степени, характер изменения экспрессии выявлен для mir-145: снижение по сравнению с нормой в 3,8 раза при РШМ (р=0,0006), в 1,7 раза – при H-SIL (р=0,04) и в 2 раза – при L-SIL (р=0,002). У женщин с H-SIL и L-SIL уровень экспрессии mir-145 был практически одинаковым. У женщин с РШМ экспрессия данной микроРНК была в 1,9 раза ниже чем с H-SIL (р=0,03) и в 2,3 раза – чем с L-SIL (р=0,02).
Экспрессия mir-199 в соскобах из шейки матки также была снижена у женщин как с легкой, так и с тяжелой неоплазией, однако зависимости от тяжести поражения не выявилось.
В отношении экспрессии mir-122 не было выявлено достоверных различий между исследуемыми группами.
В табл. 2 приведены также результаты оценки суммарного показателя экспрессии по двум (mir-143+mir-145) и по трем (mir-143+ mir-145+mir-199) микроРНК в исследуемых группах. Они также показывают прогрессивное снижение экспрессии этих показателей пропорционально тяжести неопластического поражения.
С целью оценки возможности применения значений уровня экспрессии микроРНК в соскобах из шейки матки для дифференциальной диагностики степени неопластического поражения был применен ROC-анализ. Результаты представлены в табл. 3, 4 и 5.
Наибольшая диагностическая точность (75,6%) выявления неопластических поражений достигалась по результатам оценки уровня экспрессии mir-143 (табл. 3). При значениях уровня экспрессии ниже 0,32 у.е. (уровень отсечки) чувствительность диагностики неопластического процесса шейки матки (L-SIL, H-SIL или РШМ) составила 73,3%, специфичность – 77,85% (табл. 3). При таком уровне экспрессии шанс неопластического поражения повышен в 9,63 раза (р<0,001). В отношении РШМ при уровне экспрессии mir-143 ниже 0,31 у.е. чувствительность диагностики составила 73,3%, специфичность – 84,6% (табл. 4). Вероятность (OD) наличия РШМ у женщин с уровнем экспрессии ниже 0,31 у.е. повышена в 15,3 раза (р<0,001). Применение ROC-анализа позволяет также дифференцировать РШМ от H-SIL – при уровне отсечки 0,05 у.е. чувствительность дифференциации составляет 80,8%, специфичность – 61,5%, отношение шансов составляет 6,72 (р=0,012) (табл. 5).
Оценка экспрессии mir-145 и mir-199 также показала хорошую точность диагностики неоплазии (L-SIL, H-SIL или РШМ) – 70,2 и 70,5%, соответственно, точность постановки диагноза РШМ по уровню экспрессии mir-145 или mir-199 составили 80,1 и 75,1% соответственно. При значениях экспрессии mir-145 ниже 0,006 чувствительность диагноза РШМ составила 83,3%, специфичность – 76,9% (OD=9,52; 3,13-31,6; р<0,001). В отношении mir-199 эти показатели составили: чувствительность – 73,3% и специфичность – 76,5% (OD=9,17; 1,67–61,53; р<0,006).
ROC-анализ суммарного показателя по двум или трем микроРНК (mir-143, mir-145 и mir-199) не показал существенного повышения чувствительности и специфичности диагностики неопластических поражений шейки матки (табл. 3). В то же время эффективность диагностики отдельно РШМ значительно повысилась при анализе суммарного показателя по сравнению с данными по одиночным микроРНК (табл. 4). Наиболее высокая точность диагностики (85,7%) выявилась по результатам суммирования экспрессии mir-143 и mir-145: при значении суммарного показателя менее 0,46 у.е. чувствительность диагностики РШМ составила 86,7, специфичность – 84,6% (OD=35,75; 4,6–391,60; р<0,001). Хорошая диагностическая точность достигалась и по суммарной оценке экспрессии mir-143+mir-199 и mir-145+mir-199. Также высокая диагностическая точность (82,3%) выявилась при анализе суммарного показателя по трем микроРНК (mir-143+mir-145+mir-199): при уровне отсечки 0,69 у.е. чувствительность диагностики РШМ составила 80,0% и специфичность – 84,6% (OD=22,0; 3,2-232,16; р<0,001).
Суммарный показатель экспрессии mir-143+mir-145 позволяет также дифференцировать H-SIL и РШМ. При уровне отсечки 0,15 у.е. чувствительность диагностики РШМ среди женщин с неопластическими поражениями составляет 80,8%, специфичность – 53,8%. При этом шанс правильности диагноза РШМ повышен в 4,9 раза (р=0,034).
Обсуждение
В настоящей работе исследовали экспрессию четырех противоонкогенных микроРНК – mir-143, mir-145, mir-199 и mir-122, в соскобах из шейки матки при доброкачественной (L-SIL, H-SIL) и злокачественной неоплазии (РШМ). По данным литературы известно, что экспрессия mir-143, mir-145 и mir-199 в гиперплазированных тканях шейки матки снижена [11]. Экспрессия mir-122 в тканях шейки матки не исследовалось, однако было показано значительное снижение ее синтеза в пораженных тканях при гепатоцеллюлярной карциноме и раке молочной железы [12, 13]. В настоящей работе предполагалось оценить возможность дифференциации разной степени поражения шейки матки в зависимости от уровня экспрессии выбранных для исследования микроРНК.
Генетические локусы для mir-143 и mir-145 сформированы в бицистронный кластер и синтезируются в виде единого транскрипта [14]. Уровень экспрессии обеих микроРНК значительно снижен при многих видах злокачественных опухолей [15]. Противоопухолевый механизм действия mir-143 и mir-145 осуществляется путем ингибирования функции генов API5 (apoptosis inhibitor 5), KRAS (Kirsten rat sarcoma viral oncogene homolog), RREB1 (Ras-responsive element-binding protein) и IRS-1 (insulin receptor substrate 1), участвующих в регуляции апоптоза, делении клеток и ангиогенезе [16]. Кроме того, mir-145 тормозит клеточный рост, подавляя функцию генов c-Myc (v-myc avian myelocytomatosis viral oncogene homolog) и IRS-1 и препятствует инвазии и метастазированию опухолевых клеток, ингибируя функцию гена MUC1 (mucin 1) [17].
Проведенные нами исследования показали значительное снижение экспрессии mir-143, mir-145 и mir-199 в соскобах из шейки матки как при доброкачественной, так и при злокачественной неоплазии, что согласуется и с публикациями других исследователей [10, 11]. При этом отмечалось выраженное прогрессивное снижение экспрессии mir-143 и mir-145 в зависимости от тяжести поражения. Экспрессия mir-143 и mir-145 в эпителиальных соскобах шейки матки также достоверно различается при РШМ от H-SIL. В отношении экспрессии mir-199 не было выявлено достоверных различий между РШМ и H-SIL или L-SIL.
Экспрессия mir-122 была практически одинаковой во всех исследуемых группах, что, по-видимому, обусловлено тем, что она синтезируется преимущественно в тканях печени и лишь минимальное ее количество выявляется в других тканях [18]. В данной работе экспрессия mir-122 была на 3 порядка ниже, чем экспрессия mir-143 и на 2 порядка ниже, чем mir-145.
Применение ROC-анализа позволило оценить диагностическую значимость результатов экспрессии микроРНК для дифференциации неоплазии разной степени тяжести. Хорошую эффективность диагностики шеечной неоплазии показали данные экспрессии как отдельных микроРНК (mir-143, mir-145, mir-199), так и суммарный показатель по двум (mir-141+mir-145) или трем (mir-143+mir-145+mir-199) микроРНК. Оценка уровня экспрессии mir-141, mir-145 или суммарный показатель экспрессии mir-141+mir-145 с хорошей точностью позволяет также дифференцировать пациентов с H-SIL и РШМ.
Заключение
Таким образом, проведенные в настоящей работе исследования показали, что при неопластических поражениях шейки матки в эпителии значительно снижается синтез противоонкогенных микроРНК – mir-143, mir-145 и mir-199. При этом уровень экспрессии mir-143 и mir-145 снижается пропорционально степени тяжести поражения – минимальный уровень экспрессии этих молекул отмечен при РШМ. Показатели экспрессии как отдельных микроРНК, так и суммарный показатель экспрессии двух (mir-143 и mir-145) или трех (mir-143, mir-145 и mir-199) микроРНК в соскобах из шейки матки могут быть использованы и для дифференциации женщин с повышенной вероятностью наличия у них неоплазии шейки матки или РШМ.



