В последнее время наблюдается тенденция к увеличению частоты наступления многоплодной беременности в связи с внедрением в практику программ вспомогательных репродуктивных технологий. Известно, что при многоплодной беременности перинатальная заболеваемость и смертность значительно выше, чем при одноплодной.
В связи с этим многоплодную беременность относят к состоянию пограничному между нормой и патологией.
При монохориальной многоплодной беременности возможно развитие специфических осложнений, не характерных для дихориальной, связанных с уникальной ангио-архитектоникой монохориальной плаценты [1]. Неравномерное распределение кровотока со сбросом крови от одного плода к другому является общепринятой причиной синдрома фето-фетальной трансфузии (ФФТС) и синдрома анемии-полицитемии (САП). Причиной возникновения синдрома селективной задержки роста плода (ССЗРП) является неравномерное разделение территории плаценты между близнецами. В основе возникновения синдрома обратной артериальной перфузии (СОАП) лежит несбалансированный кровоток через сосудистые анастомозы. Некоторые из представленных выше осложнений поддаются внутриутробной коррекции, в связи с чем своевременная диагностика позволяет провести необходимые лечебные мероприятия.
Мы приводим клинически значимые диагностические критерии, которые могут и должны быть использованы при ведении монохориальной многоплодной беременности.
Фето-фетальный трансфузионный синдром
Монохориальная плацента имеет сеть сосудистых анастомозов, объединяющих циркуляторные системы обоих плодов, которая обеспечивает трансфузию крови между близнецами. Это состояние является физиологическим до тех пор, пока гемотрансфузия между плодами сбалансирована. Несбалансированная сеть анастомозов может привести к серьезным осложнениям, самым известным из которых является ФФТС, который встречается в 9–15% случаев всех монохориальных двоен [2].
В эпоху до эхографии, ФФТС диагностировался в момент рождения. Основными критериями выступали разница в весе новорожденных более 15–20% и в концентрации гемоглобина более 50 г/л [3]. Последующее исследование Wenstrom и соавт. [4] показало, что различия в весе и концентрации гемоглобина у близнецов не является достоверным признаком ФФТС. Исследователи пришли к выводу, что «исторические» неонатальные признаки не должны использоваться в качестве диагностических критериев данного синдрома. В настоящее время ФФТС диагностируется антенатально с помощью эхографии. Первоначально необходимо подтвердить, что данная беременность является монохориальной (выявление T-признака и четкая визуализация единственного плодного яйца с двумя эмбрионами в первом триместре). Различие фетометрических параметров плодов не является критерием диагностики ФФТС. Несмотря на это, общее убеждение об обязательном отставании роста одного из плодов все еще существует. В исследовании 270 пациенток с ФФТС только у 20% было выявлено отставание веса одного из плодов [5].
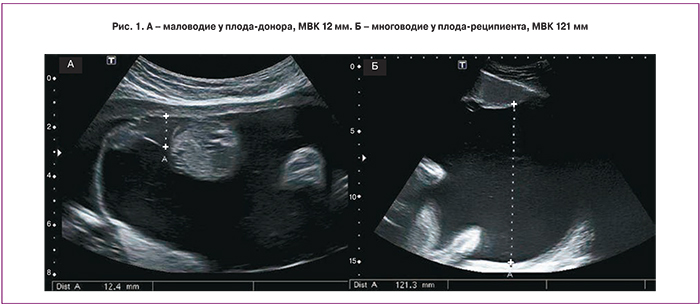
Ключевым диагностическим критерием ФФТС является обнаружение многоводия у одного плода и маловодия у другого. Маловодие устанавливается на основании измерения максимального вертикального кармана (МВК), который не должен превышать 2 см, этот плод является донором. Многоводие, развивающееся у плода реципиента, констатируют при увеличении МВК более 8 см до 20 недель беременности [6] и более 10 см после 20 недель [7]. Выявление многоводия при отсутствии визуализации плодных оболочек между плодами не всегда указывает на моноамниотическую двойню. Хотя ФФТС может развиться и при данном типе беременности, более вероятно, что амниотическая жидкость у донора полностью отсутствует, и плодные оболочки плотно облегают его. Это явление называется плод в «коконе». В большинстве случаев, донор прикреплен к стенке матки или поверхности плаценты.
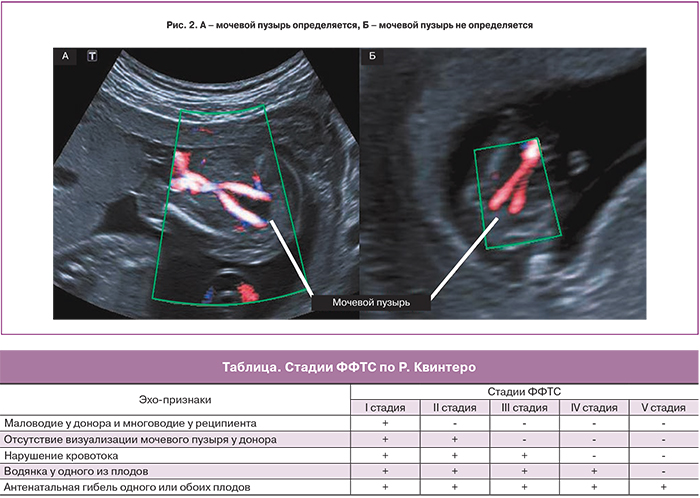
На основании эхографических признаков ФФТС Рубен Квинтеро с соавт. [6], в 1999 году, предложили классификацию (таблица), которая получила широкое распространение и используется во всем мире.
I стадия ФФТС характеризуется наличием маловодия плода донора (МВК менее 2 см) и многоводия реципиента (МВК более 8–10 см) (рис. 1).
II стадия является отражением дальнейшего прогрессирования заболевания. К описанным выше признакам выраженного различия количества амниотической жидкости близнецов присоединяется отсутствие визуализации наполнения мочевого пузыря донора (рис. 2). Некоторые исследователи утверждают, что наличие небольшого мочевого пузыря донора, не наполняющегося на протяжении ультразвукового исследования, также следует расценивать как II стадию ФФТС [8].
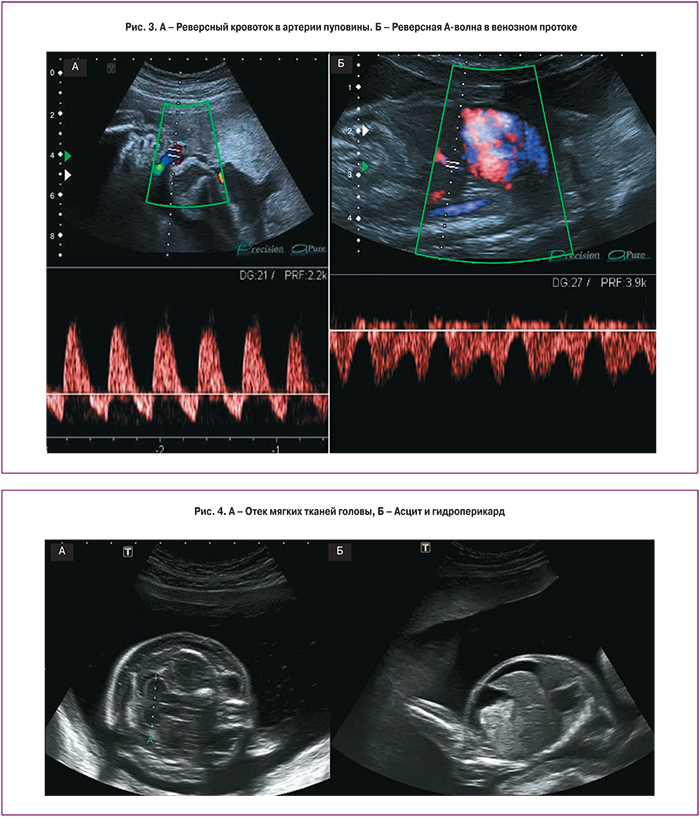
III стадия характеризуется нарушением кровотока одного или обоих плодов. При допплеровском исследовании кровотока в артериях пуповины выявляются нулевой или реверсный диастолический компонент, реверсная А-волна в венозном протоке или пульсирующий спектр в вене пуповины (рис. 3). Таким образом, возможны различные комбинации нарушений кровотока, выявляемые при допплерометрии. Как правило, нарушения кровотока в артериях пуповины чаще выявляются у донора, в то время как у реципиента чаще диагностируют аномальный кровоток в венозном протоке или пульсирующий спектр в вене пуповины, что свидетельствует о развивающейся сердечной недостаточности.
При IV стадии ФФТС у одного из плодов, чаще у реципиента, возникает водянка (асцит, гидроперикард, плевральный выпот и отек подкожно-жировой клетчатки головы и туловища) (рис. 4).
V стадия ФФТС является финальной в прогрессировании данного осложнения и проявляется гибелью одного или обоих плодов.
Ряд исследований показали зависимость перинатального исхода от стадирования тяжести ФФТС по классификации Квинтеро [7, 9, 10]. В случае прогрессирования заболевания прогноз неблагоприятный [11].
Таким образом, для обеспечения благоприятного исхода беременности крайне важны своевременная диагностика ФФТС и выбор правильной тактики ведения. Несмотря на большое количество публикаций, количество беременных с тяжелыми и запущенными случаями ФФТС не сокращается. В связи с чем необходимо придерживаться следующих рекомендаций: ультразвуковое исследование должно проводиться регулярно с интервалом 1 раз в две недели, пациентка должна быть осведомлена о типе беременности и возможных осложнениях [12]. При скриннинговом ультразвуковом исследовании в I триместре необходимо обращать внимание на ранние маркеры ФФТС. К ним относятся: разница копчико-теменного размера плодов более 6 мм, увеличение толщины воротникового пространства и аномальный кровоток в венозном протоке у одного из плодов, разница в количестве амниотической жидкости. В последующем регулярные ультразвуковые исследования должны осуществляться, начиная с 16 недель беременности, и продолжаться до 28 недель, так как ФФТС обычно развивается в этих сроках [13].
В заключение следует отметить, что, несмотря на невозможность антенатальной визуализации анастомозов монохориальной плаценты, современные эхографические технологии и знания ключевых диагностических критериев позволяют своевременно диагностировать и оценить степень тяжести ФФТС. После того как диагноз подтвержден или, по крайней мере, весьма вероятен, следующей задачей становится определение оптимального времени и метода лечения.
Синдром анемии-полицитемии
САП, описанный впервые в 2007 году, характеризуется наличием значительной разницы концентрации гемоглобина между близнецами при отсутствии различия количества амниотической жидкости, которое необходимо для диагностики ФФТС [14]. Данное осложнение монохориальной многоплодной беременности может возникнуть спонтанно или как осложнение лазерной коагуляции сосудистых анастомозов плаценты при ФФТС. Спонтанная форма САП встречается в 3–5% монохориальных многоплодных беременностей, в то время как ятрогенная форма – от 2 до 13% случаев [15, 16].
Для типичной ангио-архитектоники плаценты при САП характерно наличие небольшого количества мелких (менее 1 мм) однонаправленных артерио-венозных анастомозов [17]. Объем кровотока в сосудах малого калибра снижен из-за низкого сосудистого сопротивления (Закон Пуазейля). Предполагается, что гемотрансфузия между близнецами происходит очень медленно, в связи с чем реализуется гемодинамический компенсаторный механизм. Гиповолемия донора и гиперволемия реципиента купируется активацией или инактивацией ренин-ангиотензиновой системы, что объясняет отсутствие классических признаков ФФТС. К тому же артерио-венозные анастомозы, которые обычно равномерно распределены вдоль сосудистого экватора плаценты, локализуются вблизи края плаценты, артерио-артериальные анастомозы крайне редки, а вено-венозные и вовсе отсутствуют в плацентах при САП [18].
САП может быть диагностирован как внутриутробно, так и в послеродовом периоде. Отсутствие эхографических признаков ФФТС является необходимым условием для диагностики САП [19]. Пренатальная диагностика основана на выявлении с помощью допплерометрии увеличения максимальной систолической скорости кровотока в средней мозговой артерии (МСК МСА) более 1,5 МОМ у одного плода, что указывает на анемию, и снижения МСК у другого менее 1,0 МОМ – полицитемия [20].
Для своевременной диагностики САП целесообразно проводить допплерометрическое измерение МСК МСА плодов раз в две недели, особенно после фетоскопической лазерной коагуляции сосудистых анастомозов плаценты.
Послеродовая диагностика САП заключается в определении концентрации гемоглобина и ретикулоцитов у близнецов и детальном патоморфологическом исследовании плаценты. Для диагностики САП новорожденных оценивается разница концентрации гемоглобина у близнецов, а не сравнение с нормативными показателями. Разница в концентрации гемоглобина более 80,0 г/л достоверно указывает на наличие САП [21]. Однако в результате острой фето-фетальной трансфузии в родах или острой плодово-плацентарной трансфузии после извлечения первого близнеца, концентрация гемоглобина у новорожденных может значительно различаться. В связи с чем для дифференциальной диагностики САП и трансфузии в родах проводится определение количества ретикулоцитов. В случаях, когда кровопотеря происходит быстро при острой фето-фетальной трансфузии в родах или острой плодово-плацентарной трансфузии, концентрация ретикулоцитов не увеличивается. Напротив, при САП количество ретикулоцитов у плода с анемией всегда увеличивается. Увеличение соотношения количества ретикулоцитов между близнецами свыше 1,7 является патогномоничным признаком САП [20]. Третий критерий послеродовой диагностики САП основан на выявлении в плаценте небольшого количества артерио-венозных анастомозов малого диаметра (менее 1 мм).
САП может иметь различные проявления – от незначительного повышения МСК МСА до антенатальной гибели плода. В настоящее время разработана система стадирования САП, главной целью которой является определение степени тяжести заболевания. В её основе лежат эхографические критерии, отражающие степень тяжести анемии и полицитемии у близнецов. I стадия характеризуется увеличением MCК МСА донора более 1,5 МОМ и уменьшением MCК МСА реципиента менее 1,0 MОM, для II стадии характерно увеличение MCК МСА донора более 1,7 МОМ и уменьшение MCК МСА реципиента менее 0,8 MОM, при III стадии помимо аномальных скоростей кровотока в МСА плодов, описанных при I и II стадиях, определяются признаки сердечной недостаточности донора (нулевой или реверсный кровоток в артерии пуповины, пульсирующий спектр в пупочной вене, реверсная А-волна в венозном протоке), IV стадия характеризуется водянкой плода, а при V стадии диагностируется внутриутробная гибель одного или обоих плодов.
Определение степени тяжести позволяет прогнозировать исход беременности, осложненной САП, и своевременно начать лечение.
Выводы
Последовательное и тщательное наблюдение за течением монохориальной беременности специалистом, обладающим знаниями патофизиологии возможных осложнений, с использованием соответствующих диагностических инструментов, является неотъемлемой частью надлежащей акушерской тактики ведения и залогом успешного исхода беременности.



