Врастание плаценты (ВП) – сложный процесс, в реализации которого участвуют различные механизмы [1–4]. Понимание определяющих их закономерностей позволит обоснованно разрабатывать программы ранней диагностики для предупреждения осложнений, а в последующем, возможно, и профилактики чрезмерной инвазии хориона [3–6].
Ультразвуковое исследование (УЗИ) занимает ведущую позицию среди методов антенатальной диагностики ВП [7], однако его информативность значительно снижается у пациенток без оперативного анамнеза и при расположении плаценты по задней стенке матки [8]. Дополнение данных визуализирующих методов биохимическими маркерам представляется перспективным для повышения точности диагностики ВП [9–13], особенно в группе высокого риска: у беременных с предлежанием плаценты (ПП) и рубцом на матке. Среди многочисленных биохимических маркеров ВП в последние годы активно изучаются факторы ангиогенеза [14–19]. Известно, что эта группа белков влияет на морфологический фенотип плаценты [14, 20], а нарушение сывороточного баланса проангиогенных факторов (сосудисто-эндотелиальный фактор роста (VEGF), плацентарный фактор роста (PlGF)) и их антагонистов (растворимая fms-подобная тирозинкиназа-1 (sFlt-1)) предшествует клинической манифестации преэклампсии, что обусловливает все более широкое применение оценки их сывороточной концентрации в рутинной клинической практике [21]. Рядом исследований обнаружены изменения уровня факторов ангиогенеза в крови беременных с ВП [18, 19, 22]. Однако остается неясным, являются ли эти изменения ассоциированными либо связанными предикторами патологической инвазии плаценты. Для уточнения наличия прямой связи необходимо сопоставление уровня факторов ангиогенеза в крови с иммуногистохимическим анализом их экспрессии в зоне плацентации.
Цель работы: изучить вклад факторов ангиогенеза в патогенез ВП у женщин с ПП для выявления дополнительных биомаркеров аномальной инвазии плаценты.
Материалы и методы
Исследование «случай-контроль» на базе Перинатального центра (ПЦ) в структуре ГБУЗ «ККБ № 2» г. Краснодара выполнено в соответствии с этическими принципами Хельсинкской декларации. Включены 88 последовательных пациенток с ПП, обращавшихся за специализированной медицинской помощью в ПЦ в период с 01.12.2019 по 01.03.2021 гг.
Всем пациенткам выполнялось УЗИ матки специалистами ультразвуковой диагностики ПЦ при поступлении в стационар для родоразрешения (сканеры Medison AV10, Voluson S8, Voluson Е6, Voluson E8, оснащенные мультичастотными датчиками для абдоминальных и эндокавитальных исследований) трансабдоминальным и трансвагинальным доступами. ПП определяли согласно общепринятым критериям [23] с прицельным поиском ультразвуковых признаков ВП [24].
В последующем ВП верифицировалось при родоразрешении и на основании данных патолого-гистологического исследования (ПГИ) операционного материала.
Исследование одобрено Комитетом по этике ГБУЗ ККБ № 2 (протокол № 90 от 13.11.2019 г.). После информированного согласия на изучение образцов крови и гистологического материала, до введения стероидов и препаратов крови (в случае необходимости их применения), у беременных с ПП проводился забор крови из периферической вены для последующего определения уровня маркеров ангиогенеза (PlGF, VEGF, sFlt-1) в сыворотке.
Критерии включения: антенатальный диагноз О.44.0–О44.1 (МКБ-10) согласно данным УЗИ и/без магнитно-резонансной томографии, срок гестации 26–38 недель, информированное согласие беременной на участие в исследовании.
Критерии исключения: преэклампсия, антенатальная гибель плода, многоплодная беременность, врожденные пороки развития плода, явившиеся показанием к досрочному родоразрешению, отсутствие данных об исходе беременности с гистологической и/или клинической верификацией диагноза.
Клинические группы формировались согласно клиническому диагнозу при родоразрешении и по данным ПГИ операционного материала (при наличии).
Специалисты, выполнявшие иммуноферментный анализ (ИФА) сыворотки крови, не имели данных о клиническом диагнозе пациенток. Также патоморфологи, выполнявшие иммуногистохимическое (ИГХ) исследование операционного материала, не знали результатов ИФА.
Определяли сывороточную концентрацию PlGF, VEGF, sFlt-1 с учетом срока гестации, уточненного по данным комбинированного скрининга I триместра, по методике ИФА, описанной ранее [22].
Гистологическое и ИГХ-исследование
Операционный материал (плацента, фрагменты иссеченного при метропластике миометрия или матка в случаях гистерэктомии) после удаления немедленно фиксировали в 10% нейтральном забуференном формалине. После фиксации материал вырезался с забором необходимого объема для исследования, включая область плацентарной площадки с подлежащей стенкой матки на всю глубину, которые проводились через вакуумный гистологический процессор, заливкой в парафин и последующей гистологической окраской гематоксилин-эозином. Применяли аппарат для гистологической проводки закрытого типа Tissue-Tek VIPтм5Jr, иммуногистостейнер Ventana Bench Mark ХT, прямой светооптический микроскоп Nikon Eclipsе 80i. Гистологические критерии ВП определяли в соответствии с рекомендациями FIGO [25]. Для ИГХ-анализа использовали наборы антител: FLT-1/VEGFR1 (Vascular endothelial growth factor receptor 1) кроличий поликлональный; VEGF (Vascular endothelia growth factor) мышиный моноклональный; CD34 (QB End/10) мышиный моноклональный.
ИГХ-исследование выполнено у 57 пациенток: в 17 препаратах после метропластики в группе с ПП без врастания; в 40 случаях в группе с ВП (глубина инвазии: 1-я степень – у 16; 2-я степень – у 18; 3-я степень – у 6). В качестве внешнего контроля использован гистологический операционный материл после гистерэктомий (в связи с атонией матки при нормальном положении плаценты в 38 недель беременности, n=1; по поводу миомы матки вне беременности, n=2) у пациенток, оперированных в ПЦ ГБУЗ ДККБ МЗ КК и давших информированное письменное согласие на использование обезличенных данных в научных целях.
Методика: ИГХ-исследование проводилось на депарафинированных срезах толщиной 3 мкм после антигенного демаскирования (метод высокотемпературной обработки в кислой среде pH 6.0) с использованием авидино-биотиновых ферментных систем детекции. Использовались хромогенные субстраты двух цветов Ventana Medical Systems набор UltraView Universal DAB Detection Kit и система детекции XT UltraView RED v3 с гистологическим контрастированием гематоксилином Майера. Гистологическая картина и результаты иммунопероксидазного связывания оценивались на прямом светооптическом микроскопе Nikon Eclips 80i.
Flt-1 (Flt-1/VEGFR1 Rabbit Polyclonal Antibody), система детекции OptiView DAB IHC Detection Kit: подготовка образцов включала разведение первичных антител 1:50 (без учета принадлежности образца к клинической группе). Депарафинизация среза; кондиционирование среза (демаскировка антигена) Cell Conditionning 1 увеличенное (72 минуты); первичная инкубация 120 минут при 37°С; контрастное окрашивание Hematoxylin II, 16 минут; последующее окрашивание Bluing Reagent, 8 минут. Ручная микрофотография использовалась для стадирования зон нормальной и избыточной фиксации реактива. Ворсины в исследуемых областях не содержали перивиллезного фибриноида и не имели патологических изменений (например, инфаркта).
VEGF (anti-VEGF Primary Antibody), система детекции UltraView Universal DAB Detection Kit: депарафинизация среза; кондиционирование среза (демаскировка антигена) Cell Conditionning 2 стандартное (60 минут); первичная инкубация 120 минут при 37°С; контрастное окрашивание Hematoxylin II, 20 минут; последующее окрашивание Bluing Reagent, 4 минуты.
CD34 (anti-CD34 (QBEnd/10) Primary Antibody), система детекции UltraView Universal DAB Detection Kit: депарафинизация среза; первичная инкубация 16 минут при 37°С; контрастное окрашивание HematoxylinII, 16 минуты; последующее окрашивание Bluing Reagent, 4 минуты.
Выполнялась полуколичественная оценка интенсивности фиксации Flt-1 ворсинами хориона в зоне инвазии и децидуальными клетками двумя независимыми специалистами. При использовании методики 5-балльной градации интенсивности окраски [14] имело место несовпадение в оценке между специалистами в 18 препаратах из 57. Для повышения воспроизводимости интерпретации данных была разработана оригинальная порядковая трехбалльная шкала, которая включала следующие категории: интенсивная – >70% (3 балла); умеренная – 30–70% (2 балла); слабая – <30% (1 балл), (рис. 1), с которой далее сравнивали каждый образец. Расхождений при интерпретации данных по трехбалльной шкале между специалистами не было. Средние значения для показателей шкалы представлены медианой и межквартильным диапазоном.

Выполнялось сопоставление клинических и демографических характеристик пациенток (раса, возраст, количество беременностей, паритет, число кесаревых сечений, индекс массы тела (ИМТ), соматическая коморбидность (сахарный диабет, хроническая артериальная гипертензия, ожирение), акушерская коморбидность (гестационный сахарный диабет), наличие никотиновой зависимости, срок беременности на момент забора биоматериала для анализа).
Статистический анализ
Исчисляемые данные оценивались медианой с межквартильным размахом, категориальные параметры – пропорциями. Все статистические тесты были двусторонними, статистическая значимость определялась на уровне р<0,05. Сравнение пропорций категориальных переменных производилось с помощью теста Хи-квадрат (χ2), в том числе с поправкой Йейтса в случае наличия ожидаемых явлений n<5. Для проверки распределения количественных данных использован тест Шапиро–Уилка, для сравнения средних между двумя группами (ПП и ВП) – тест Манна–Уитни, между зависимыми выборками – тест Вилкоксона.
Для графического представления различий в группах по глубине инвазии использовалась коробчатая диаграмма с плавающими точками (jitter plot), которая наглядно представляет распределение категориальных данных.
Статистический анализ производился при помощи программы R 4.1.2 (2021-11-01) 2021 The R Foundation for Statistical Computer в приложении R Studio (2021.09.0 2009-2021 R Studio, PBC).
Расчет размера выборки для обеспечения возможности сравнения групп для ИГХ (ПП, pl. accreta, pl. increta, pl. percreta), исходя из предположения о достаточном уровне различий между ними, был основан на публикациях Cohen J. [26] и Кабакова Р.И. [27] (power=0,80; р≤0,05, ANOVA). По результатам расчетов было определено, что в выборку необходимо включить примерно 18 случаев в каждой группе.
Результаты
Согласно клиническому диагнозу при родоразрешении и ПГИ операционного материала из 88 включенных в исследование пациенток в группу с ВП вошли 46 (1-я группа), в группу с ПП без ВП – 42 (2-я группа). Все пациентки относились к европеоидной расе. Сравнительная характеристика клинических и демографических показателей обнаружила однородность групп по сроку беременности на момент забора крови, ИМТ, коморбидной патологии; пациентки группы ВП были достоверно старше, имели более высокий паритет и большее число кесаревых сечений в анамнезе (данные опубликованы ранее) [22].
Анализ сывороточного уровня маркеров ангиогенеза
Выявлено статистически значимое повышение концентрации PlGF, а также снижение отношения sFlt-1/PlGF у беременных с ВП в III триместре. Статистически значимых отличий в абсолютном уровне VEGF и sFlt-1 не найдено (табл. 1).

Анализ ультразвуковых данных
Обнаружено, что каждый из признаков ВП встречался в обеих группах, за исключением «нарушения границы матки и мочевого пузыря», но, учитывая редкость фиксации этого признака при ВП, разница по его встречаемости между группами не достигла уровня статистической значимости (табл. 1). Ни в одном наблюдении не отмечены «экзофитные массы в просвете мочевого пузыря». Самыми распространенными признаками явились: «субплацентарная гиперваскуляризация», «множественные плацентарные лакуны» и «отсутствие визуализируемого миометрия в области плацентации»; реже встречались «асимметрия в толщине плаценты» с утолщением в области врастания [28] и «гиперваскуляризация пузырно-маточной зоны» (табл. 1). В группе с ВП чаще имели место плацентация по передней стенке матки, центральное ПП. Сочетание не менее 3 ультразвуковых признаков имели 67,4% пациенток с ВП против 11,9% без ВП (p<0,001). В целом УЗИ показало высокую чувствительность в антенатальной диагностике ВП, включая локализацию плаценты по задней стенке матки, но низкую специфичность за счет значительного количества ложноположительных заключений у пациенток с ПП и рубцом на матке (табл. 2).

Гистологические данные
Морфология случаев при ВП была типичной для патологической плацентации. В зонах инвазии при микроскопическом исследовании отмечались отсутствие децидуальной ткани в области базальной пластины, недоразвитие фибриноида в зоне плацентарного ложа, прорастание ворсин хориона в миометрий. В большинстве случаев отмечены отек и хроническое воспаление в миометрии, прилегающем к плаценте.
В случаях ВП отмечены более выраженная пролиферация сосудов капиллярного типа и преобладание толстостенных сосудов мышечного типа при pl. percreta, тогда как при pl. increta преобладали сосуды мышечного типа как мелкого, так и крупного калибра с тонкой мышечной стенкой (рис. 2).
ИГХ-данные
При ИГХ-исследовании сосудов миометрия обнаружены зоны избыточной васкуляризации с увеличением плотности сосудистой сети, которые совпадали с описанием наличия «субплацентарной гиперваскуляризации» по данным допплеровского картирования у пациенток с ВП (рис. 2). Интенсивность окраски cосудистым маркером CD34 нарастала с глубиной инвазии.

Балльная оценка экспрессии Flt-1 в децидуальных клетках и в ворсинах хориона у пациенток с ПП не имела статистически значимых отличий (табл. 3, рис. 3). Хотя средние значения интенсивности окраски в децидуальных клетках у пациенток с ВП были ниже, чем в группе с ПП, разница в различиях при сравнении с группой ПП и между группами с различной глубиной инвазии не достигла уровня статистической значимости, за исключением pl. increta (р=0,045) (табл. 3). В то же время в интактных ворсинах хориона уровень экспрессии Flt-1 у пациенток с инвазивными формами ВП (increta/percreta) был ниже, чем при отсутствии ВП (табл. 3, рис. 3, 4). При сравнении уровня экспрессии Flt в ворсинах у пациенток с ПП и в ворсинах зоны врастания у пациенток с ВП обнаружена более низкая экспрессия исследуемого маркера в зоне врастания, независимо от глубины инвазии со статистически значимой разницей в интерпретации интенсивности окраски по данным ИГХ (табл. 3, рис. 3, 4).
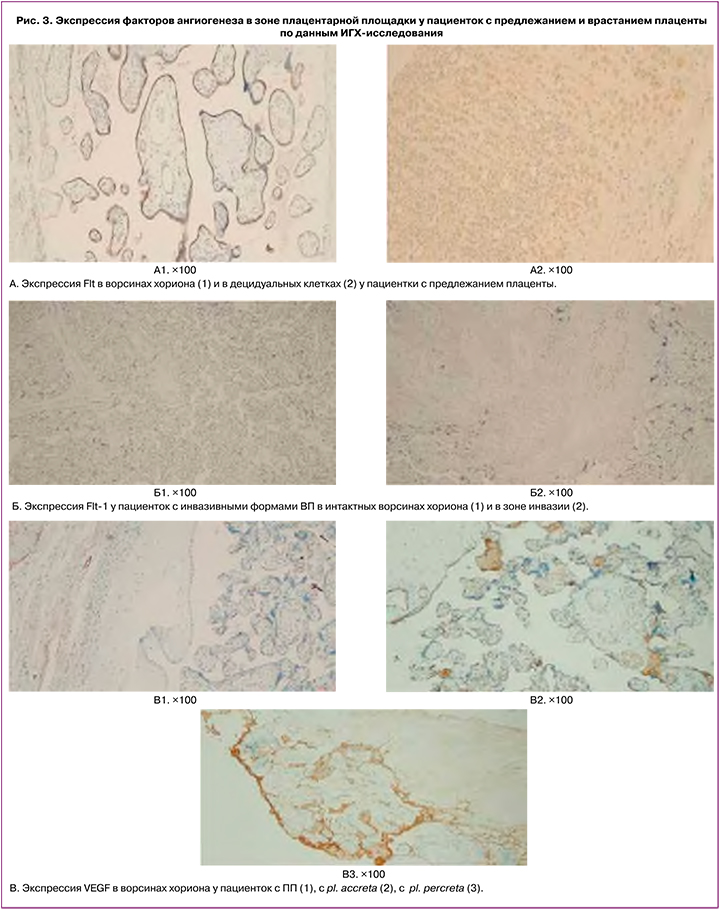
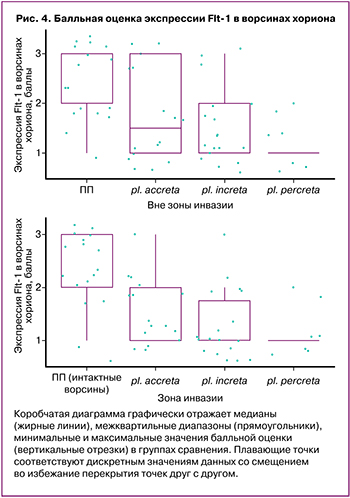
Хотя интенсивность окраски, согласно средним значениям балльной оценки между препаратами с различной глубиной инвазии плаценты в интактных ворсинах хориона, снижалась, уровня статистической значимости эта тенденция не достигла (различия между pl. accreta/pl. percreta; p=0,122). В зоне инвазии отличий в зависимости от глубины врастания не найдено. В то же время выявлены отличия с высокой статистической значимостью при сравнении экспрессии Flt-1 между децидуальными клетками и зоной инвазии для pl. accreta и pl. increta; отсутствие столь выраженных различий для pl. percreta можно объяснить малым числом наблюдений в группе (n=6). Снижение уровня экспрессии Flt-1по данным ИГХ-исследования между интактными ворсинами и зоной инвазии у пациенток с ВП не имело статистически значимых отличий (табл. 3).
Усиление окраски, указывающее на повышенное содержание VEGF в случае ВП, отмечалось в клетках интерстициального трофобласта, эндотелии сосудов, внеклеточном матриксе, децидуальных клетках, а также среди мышечных волокон и в соединительной ткани. При этом количество VEGF -позитивных клеток в миометрии было выше в случаях pl. percreta (рис. 3).
Обсуждение
В последние годы возможности антенатальной инструментальной диагностики ВП пересматриваются. Согласно метаанализу, около 20% инвазивных форм ВП остаются «пропущенными» при условии выполнения всех обязательных скрининговых УЗИ [29]. Диагностическая точность метода выше в случае сочетания нескольких (не менее 3) ультразвуковых признаков, что подтвердил наш анализ. Отсутствие описания широко известных ультразвуковых признаков «утрата гипоэхогенной ретроплацентарной зоны», «сосудистые мостики» в режиме цветового допплеровского картирования, единичные случаи применения признака «утеро-везикальной гиперваскуляризации» может объяснить низкие возможности исключения патологии при наличии риска в нашей выборке.
Факторы ангиогенеза представляются одним из наиболее перспективных направлений для изучения с целью совершенствования антенатальной диагностики ВП, поскольку уже востребованы в клинической практике для ранней предикции преэклампсии. Но к настоящему времени большинство исследований ограничено небольшими выборками, исследования, сопоставлявшие локальный и системный уровень факторов ангиогенеза при ВП, единичны, а результаты неоднозначны. Логично ожидать повышения уровня проангиогенных и соответственного снижения антиангиогенных факторов в крови женщин с данным осложнением беременности в противовес преэклампсии. Однако Biberoglu E. et al. [16] не обнаружили предполагаемых изменений, в то время как другие работы выявили противоположный феномен – снижение VEGF в сыворотке крови при ВП [14, 17, 18].
Faraji А. et al. [19] подтвердили повышение уровня PlGF, но не VEGF у беременных с ВП. Эта работа согласуется с нашими результатами. Определение уровня VEGF в сыворотке крови технически сложно ввиду его низкой концентрации. В нашей выборке у 3 пациенток уровень маркера оказался ниже порогового значения; в работе [14] количество таких неинформативных образцов было выше. Плазменная концентрация белка выше, но в клинической практике общепринят анализ сыворотки крови.
Абсолютный уровень sFlt-1 в нашем исследовании не отличался между группами сравнения, но при анализе соотношения про- и антиангиогенных факторов показал статистически значимые различия со снижением отношения sFlt-1/PlGF у беременных с ВП. Оценка диагностических возможностей отношения представляется наиболее перспективной, поскольку не зависит от абсолютных значений маркеров и применима независимо от особенностей оборудования и диагностических наборов. Однако при интерпретации данных сывороточной концентрации биомаркеров неясно, обусловлено снижение отношения sFlt-1/PlGF изменением уровня обоих маркеров, или показатель «работает» исключительно за счет повышения уровня PlGF? Также нельзя быть уверенным, что возможное изменение уровня sFlt-1 связано с патологической плацентацией, а не является ассоциированным фактором. Только сопоставление данных серологического исследования методом ИФА с ИГХ экспрессии факторов ангиогенеза в зоне плацентации в норме и при ВП может помочь в понимании выявленного феномена.
Опубликованные работы по изучению локальной экспрессии sFlt-1 немногочисленны и имеют существенные отличия в дизайне. Так, McMahon K. et al. [15] исследовали уровень маркера в материале после гистерэктомии в сроке беременности от 20 до 40 недель, в то время как известно, что уровень факторов ангиогенеза существенно меняется от II к концу III триместра беременности. Shainker S.A. et al. [30] в качестве контроля изучали локальную экспрессию sFlt-1 у пациенток c нормальным положением плаценты и с хориоамнионитом. Авторы не сопоставляли локальный уровень Flt-1 с сывороточной концентрацией sFlt-1. McMahon K. et al. [15], как и в нашем исследовании, обнаружили снижение локального уровня экспрессии sFlt-1 с увеличением глубины инвазии плаценты в ворсинах хориона с тенденцией к статистической значимости (р=0,11) между пациентками с pl. accreta и pl. рercreta; обнаружены статистически значимые различия в уровне экспрессии исследуемого фактора антиангиогенеза в ворсинах между пациентками с инвазивными формами ВП и ПП. Однако наше исследование не подтвердило статистически значимых различий в уровне Flt-1 между интактными ворсинами и зоной инвазии у пациенток с ВП. Эти показатели созвучны данным Shainker S.A. et al. [30]. Т.е., согласно полученным нами результатам, даже в интактных ворсинах у пациенток с ВП имеет место снижение концентрации Flt-1, что указывает на системный характер выявленных отличий, не ограничивающихся зоной инвазии.
Этот феномен важен для понимания патогенеза аномальной инвазии плаценты. К настоящему времени сосуществуют две теории развития данного процесса. По мнению Knöfler M. [1], пролиферация и инвазия внеклеточного трофобласта запускаются внутренней программой дифференцировки, независимой от локального окружения. Материнские стромальные децидуальные клетки, макрофаги и децидуальные клетки-киллеры (dNK) модулируют инвазивную активность трофобласта [1]. Согласно данным Jauniaux Е. et al. [31], маточные факторы, приводящие к развитию ВП, первичны, а изменения синцитиотрофобласта и вневорсинчатого трофобласта имеют вторичный характер. Одним из аргументов является отсутствие морфологических изменений в ворсинах хориона при ВП в сравнении с нормальной плацентацией [31]. Но в морфологических исследованиях Tantbirojn P. et al. [32] четкое соответствие зоны врастания области рубцевания определено только в 8% случаев; в остальных – аномальная инвазия распространялась на переднюю стенку матки в зоне предполагаемого рубца после кесарева сечения. Также следует учитывать, что рутинный гистологический анализ связан с множественной систематической ошибкой ввиду неоднородности заключений [33]. Таким образом, выявленные изменения в системном уровне маркеров ангиогенеза, сочетающиеся с нарушением их экспрессии у пациенток с ВП как в зоне аномальной инвазии, так и вне ее указывают на то, что нарушение процессов ангиогенеза не ограничивается локальной зоной влияния материнских факторов в области рубцевания. Следовательно, изменение системного уровня биомаркеров может быть использовано в клинической практике для антенатальной диагностики ВП.
Shainker S.A. et al. [30] предположили, что сниженный уровень sFlt-1 может быть связан с повышенной перфузией инвазивной плаценты. Но усиленная локальная экспрессия VEGF с отсутствием различий на системном уровне (Faraji А. et al. [30], наши данные) либо даже со снижением в периферическом кровотоке [14, 17, 18] противоречит этой гипотезе. Выявленная, согласно ИГХ-исследованию, повышенная локальная экспрессия VEGF полностью совпадает с ранее выполненными работами, указывающими на проангиогенный фенотип плаценты [14, 20, 31].
В нашей выборке данные цветового допплеровского картирования фиксировали «усиление субплацентарной васкуляризации» в соответствии с морфологическими особенностями сосудистого русла в зоне аномальной инвазии. В то же время этот эхографический признак в виде участков локальной гиперваскуляризации достаточно часто (в 40,5% случаев) встречался у беременных в отсутствие инвазии плаценты в стенку матки. При анализе стандартной спектральной допплерометрии нами не найдено различий в маточно-плацентарной гемодинамике между группами с ВП и без ВП (р=0,323) (табл. 1). Таким образом, особенности гемодинамики при ВП требуют дальнейшего изучения, возможно, с помощью более чувствительных методов оценки параметров кровотока на локальном уровне.
Таким образом, повышение сывороточного уровня PlGF и локальной экспрессии VEGF указывают на вклад факторов ангиогенеза в патогенез ВП; снижение отношения sFlt-1/PlGF в III триместре у пациенток с ПП сочетается со снижением локальной экспрессии Flt-1 в ворсинах хориона у пациенток с верифицированным ВП. Хотя субплацентарная васкуляризация при ВП встречается чаще, изолированных данных цветового допплеровского картирования для надежной антенатальной диагностики ВП недостаточно; параметры стандартной спектральной допплерометрии маточно-плацентарного кровотока неинформативны для диагностики ВП. Повысить точность пренатальной диагностики ВП возможно при создании комплексной программы, включающей методы медицинской визуализации и биохимические маркеры. Для разработки такой программы нужны исследования с большей статистической мощностью.
Ограничения исследования: малый объем выборки – мы стремились уменьшить вероятность ошибки за счет формирования пропорций групп с учетом достаточной мощности; определение различных сплайс-вариантов Flt-1 при ИФА и ИГХ, хотя антитела к sFlt-1 распознают оба варианта и не дифференцируют их [15]; в ультразвуковых заключениях фиксировались не все общепринятые признаки ВП, что могло влиять на точность антенатальной диагностики.
Преимущества: совместное исследование данных ультразвукового исследования, допплерометрии, системного и локального уровня маркеров ангиогенеза позволило расширить представления о патогенезе и потенциальных биомаркерах аномальной инвазии плаценты для совершенствования антенатальной диагностики.
Заключение
Данные цветового допплеровского картирования, отражающие особенности васкуляризации зоны патологической инвазии, следует оценивать в комплексе с другими ультразвуковыми признаками ВП. Учет дополнительных признаков ВП может расширить диагностические возможности УЗИ у пациенток группы риска за счет повышения специфичности и прогностичности положительного теста. Снижение отношения sFlt-1/PlGF в сыворотке крови у беременных с ВП в III триместре согласуется со снижением локальной экспрессии Flt-1 в ворсинах хориона и может быть использовано в качестве дополнительного биомаркера аномальной инвазии плаценты у женщин с ПП.



