Проблема терапии урогенитального кандидоза не теряет своей актуальности, что обусловлено высокими показателями заболеваемости в популяции, увеличением количества хронических рецидивирующих форм заболевания и ростом уровня антимикотической резистентности грибов рода Candida. По данным отечественных и зарубежных авторов, в общей видовой структуре урогенитального кандидоза доминирует Candida albicans, которую идентифицируют у 80–90% пациентов [1, 2]. Однако в последние годы наблюдается выраженная тенденция к увеличению выявляемости non-albicans видов Candida при вульвовагинитах грибковой этиологии. Среди non-albicans представителей рода Candida наибольшее клиническое значение имеют C. glabrata, C. krusei и C. parapsilosis, также исследователи обращают внимание на возросшую этиологическую роль и других видов – C. tropicalis, C. kefyr, Cryptococcus neoformans, Sacсharomyces cerevisiae и др. [3–5]. Видовая неоднородность возбудителей урогенитального кандидоза проявляется вариабельностью клинической картины заболевания, что нередко приводит к несвоевременной диагностике и терапии заболевания. Наряду с этим отдельной проблемой является рост уровня антимикотической резистентности грибов рода Candida.
Данные современных исследований демонстрируют высокую чувствительность Candida к амфотерицину В, флуконазолу и кетоконазолу [5, 6], однако результаты ряда работ свидетельствуют о росте устойчивости дрожжеподобных грибов к препаратам азолового ряда, в особенности среди non-albicans представителей рода Candida [7, 8]. Так, по данным Sadeghi G. и соавт. (2018), 96,5% изолятов C. parapsilosis, 88,9% – C. orthopsilosis, 85,7% – C. tropicalis и 50,0% изолятов C. guilliermondii были чувствительны к флуконазолу, а изоляты C. glabrata и C. krusei демонстрировали высокий уровень резистентности (до 100%) [9]. Также многие авторы в последние годы обращают внимание на низкую чувствительность (43,7–48%) грибов рода Candida к итраконазолу [10, 11].
Целью настоящего исследования явилось изучение частоты выявления различных видов грибов рода Candida и анализ показателей их резистентности к антимикотическим препаратам за десятилетний период (2010–2020 гг.).
Материалы и методы
Была проведена культуральная видовая идентификация 1927 изолятов грибов рода Candida, выделенных от пациентов с урогенитальным кандидозом в период с 2010 по 2020 гг.: 92 изолята – в 2010 г., 216 – в 2011 г., 228 – в 2012 г., 225 – в 2013 г., 224 – в 2014 г., 112 – в 2015 г., 169 – в 2016 г., 206 – в 2017 г., 180 – в 2018 г., 167 – в 2019 г. и 108 изолятов – в 2020 г. Для выделения и оценки морфологических особенностей колоний грибов рода Candida использовали агар Сабуро. Идентификация выделенных образцов осуществлялась на основе наблюдаемого роста на субстрате CHROMagar Candida. В сомнительных случаях в качестве подтверждающего теста применяли метод полимеразной цепной реакции в режиме реального времени (ЦНИИ эпидемиологии). Идентифицированная культура возбудителя исследовалась для определения чувствительности выделенных изолятов к антимикотическим препаратам (амфотерицин В, клотримазол, миконазол, кетоконазол, итраконазол, флуконазол) с помощью тест-системы «МИКОТЕСТ-АЧ» (НИИ эпидемиологии и микробиологии им. Пастера).
Статистический анализ полученных результатов проводили с использованием непараметрических методов в программе Statistica 8.0. Сравнение двух рядов данных по их средним величинам и величинам стандартных отклонений проводилось с использованием t-критерия Стьюдента. При уровне p<0,05 различия считались статистически значимыми.
Результаты
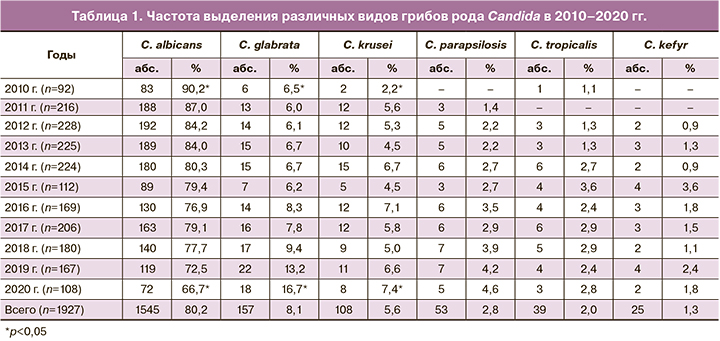
В течение 2010–2020 гг. доминирующим видом грибов рода Candida среди изолятов, выделенных от пациентов с урогенитальным кандидозом, являлась C. albicans, частота обнаружения которой в целом за исследуемый период составила 80,2% (1565 изолятов). При этом обращало на себя внимание снижение удельной доли данного вида в общей структуре выявленных грибов рода Candida: с 90,2% в 2010 г. до 66,7% в 2020 г. На этом фоне в общей видовой структуре наблюдалось возрастание доли non-albicans штаммов Candida – от 9,8% в 2010 г. до 33,3% в 2020 г. Среди non-albicans видов Candida наиболее часто выделялась C. glabrata, частота выявления которой увеличилась с 6,5% в 2010 г. до 16,7% в 2020 г. Реже у обследованных пациентов идентифицировали C. krusei (2,2–7,4%), C. parapsilosis (1,4–4,6%), C. tropicalis (1,1–3,6%), C. kefyr (0,9–3,6%), при этом к 2020 г. частота выявления C. krusei и C. parapsilosis возросла более чем в 3 раза по отношению к 2010 г., а C. tropicalis и C. kefyr – в среднем в 2 раза. Тенденция к увеличению доли non-albicans изолятов Candida была наиболее выражена в последние 5 лет изучаемого периода – с 2015 по 2020 гг. (табл. 1).
Анализ уровня резистентности выделенных изолятов к антимикотическим препаратам позволил установить, что на протяжении всего изучаемого периода C. albicans демонстрировали высокую чувствительность к амфотерицину В (99,2–100%), кетоконазолу (98,6–100%) и клотримазолу (92,7–100%). В отношении флуконазола и миконазола у данного вида дрожжевых грибов регистрировалась высокая чувствительность в период с 2010 до 2015 гг. (87,3–100% и 81,8–98,8% соответственно), однако в дальнейшем наблюдался ежегодный рост количества резистентных изолятов, и чувствительность C. albicans к данным препаратам снизилась к 2020 г. до 73,6% и 79,2% соответственно. Наименьшая чувствительность C. albicans была зарегистрирована к итраконазолу, и если ее показатель в 2010 г. составлял 85,5%, то в последующие годы находился в диапазоне от 44,7% до 59,6% (табл. 2).
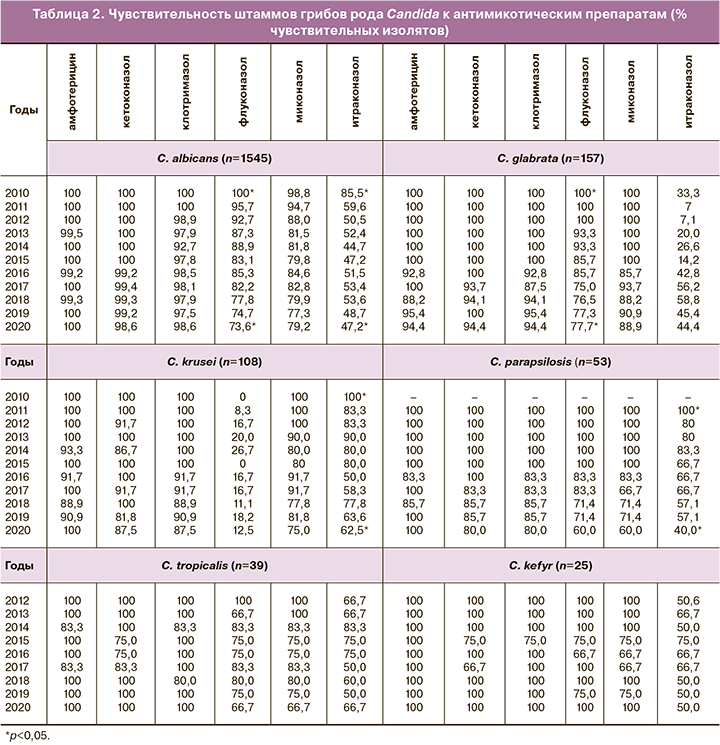
Изоляты C. glabrata также демонстрировали высокий уровень чувствительности к амфотерицину В (88,2–100%), кетоконазолу (93,7–100%) и клотримазолу (87,5–100%), а также к миконазолу (85,7–100%). Показатели чувствительности к флуконазолу оставались высокими с 2010 до 2017 гг. (85,7–100%), однако в дальнейшем снизились и составили в 2020 г. 77,7% выделенных изолятов. К итраконазолу у C. glabrata на протяжении всего изучаемого периода регистрировались низкие уровни чувствительности: более половины выделенных изолятов являлись резистентными к данному препарату, а в 2011 и 2012 гг. чувствительность составляла лишь 7,0% и 7,1% соответственно.
Другие non-albicans виды Candida также были чувствительны к амофотерицину В, кетоконазолу и клотримазолу: количество резистентных штаммов C. krusei к данным препаратам в разные годы варьировало от 0 до 18,2%, C. parapsilosis – от 0 до 16,7%, C. tropicalis – от 0 до 20%, C. kefyr – от 0 до 33,3%, при этом тенденции к увеличению количества устойчивых штаммов за исследованный период установлено не было. К флуконазолу на протяжении изучаемого периода у C. krusei регистрировалась низкая чувствительность, и ее показатели находились в пределах от 0 до 26,7%. К миконазолу все выделенные изоляты C. krusei были чувствительны вплоть до 2016 г., однако в последующем доля резистентных штаммов ежегодно возрастала, и к 2020 г. чувствительность к данным препаратам снизилась до 75,0%. Аналогичная тенденция была установлена и в отношении C. parapsilosis: с 2010 по 2015 гг. 100% изолятов данного вида были чувствительны к флуконазолу и миконазолу, в 2016 г. эти показатели составили 83,3%, а в 2020 г. – 60,0%. Чувствительность C. tropicalis к флуконазолу и миконазолу на протяжении изучаемого периода была вариабельной (66,7%–83,3%), а наибольшее число резистентных штаммов было выявлено в 2020 г. – 33,3%. Показатели чувствительности C. kefyr также варьировали (66,7%–100%), однако выраженной тенденции к росту числа резистентных штаммов к флуконазолу и миконазолу у данного вида установлено не было.
Наиболее низкие показатели чувствительности non-albicans видов Candida наблюдались в отношении итраконазола. По результатам исследования был выявлен ежегодный рост количества резистентных изолятов, и показатели чувствительности к данному препарату в период с 2010 по 2020 гг. существенно снизились: для C. krusei – с 100% до 62,5%, для C. parapsilosis – с 100% до 40,0%; количество устойчивых к итраконазолу штаммов C. tropicalis и C. kefyr также было существенно выше, чем к другим препаратам, и составляло от 25% до 50% выделенных изолятов.
Обсуждение
Анализу видовой структуры и динамики антимикотической резистентности грибов рода Candida посвящены многочисленные научные работы как отечественных, так и зарубежных авторов. Среди них отдельно выделяется многоцентровое международное исследование ARTEMIS Disk, проводившееся с 1997 по 2007 гг., по результатам которого было установлено, что доминирующими видами Candida во всем мире являлись C. albicans, C. parapsilosis, C. glabrata, C. tropicalis и С. krusei (92–99,7%). Анкирская А.С. и соавт., обобщив аналогичные показатели в России, также установили преобладание в видовой структуре грибов C. albicans (83,7–86%) без выраженной тенденции к росту или снижению за изучаемый период. Однако, согласно данным исследований последних лет, наблюдается изменение видовой структуры урогенитального кандидоза. Так, в работе Межевитиновой Е.А. и соавт. (2018) было показано, что non-albicans виды Candida составляют 23,8% от общего числа изолятов, выделенных у пациенток с рецидивирующим урогенитальным кандидозом [6]. Результаты настоящего исследования также позволили установить, что, несмотря на вариабельность видовой структуры урогенитального кандидоза в разные годы последнего десятилетия, заметна выраженная тенденция к увеличению частоты выявляемости non-albicans видов Candida: C. glabrata – с 6,5% в 2010 г. до 16,7% в 2020 г., C. krusei – с 2,2% до 7,4%, C. parapsilosis – с 0 до 4,6%, C. tropicalis – с 1,1% до 2,8%, C. kefyr – с 0% до 1,8% соответственно.
При анализе антимикотической чувствительности выделенных изолятов нами было установлено, что на протяжении 2010–2020 гг. не отмечалось роста резистентности грибов рода Candida к амфотерицину В. Чувствительность к данному препарату в среднем за исследуемый период составила у C. albicans – 99,1%, C. glabrata – 96,8%, С. krusei – 96,3%, C. parapsilosis™– 96,2%, C. tropicalis – 92,3% и C. kefyr – 100%. Это подтверждает данные современных исследований [7, 8, 10] и в большей степени может быть обусловлено отсутствием широкого применения амфотерицина в терапии урогенитального кандидоза.
В отношении кетоконазола также была установлена высокая чувствительность как C. albicans (99,2–100%), так и C. glabrata (93,7–100%). Количество устойчивых изолятов других non-albicans видов за исследуемый период также было небольшим (в среднем для С. krusei – 6,5%, C. parapsilosis – 7,6%, C. tropicalis – 10,3% и C. kefyr – 8,0%) и не имело тенденции к динамике. Кетоконазол в настоящее время не входит в перечень препаратов, включенных в отечественные рекомендации по ведению пациентов с урогенитальным кандидозом, и применяется в клинической практике реже, чем другие препараты группы азолов, с чем также, по мнению авторов, могут быть связаны низкие показатели резистентности к нему грибов рода Candida.
Флуконазол и миконазол являются одними из наиболее часто применяемых препаратов в терапии урогенитального кандидоза. В процессе настоящего исследования было установлено, что уровень чувствительности C. albicans к флуконазолу снизился за исследуемый период со 100% до 73,6%, а к миконазолу – с 98,8% до 79,2%, в среднем составив 85,9% и 84,0% соответственно. Также наблюдалось снижение показателей чувствительности C. glabrata: со 100% в 2010 г. до 77,7% в 2020 г. Полученные данные совпадали с мнением других исследователей, показавших, что C. glabrata занимает промежуточное положение между чувствительными и резистентными к флуконазолу видами [1].
В ряде современных работ обращается внимание на то, что наиболее проблемным видом Candida, с точки зрения резистентности к флуконазолу, является С. krusei, однако частота ее выявления и доля от общей численности дрожжеподобных грибов, колонизирующих мочеполовой тракт, невысока (2,2–2,5%) [1, 5, 7]. В настоящем исследовании мы наблюдали увеличение доли этого вида за изучаемый период – с 2,2% до 7,4% от общего количества выделенных изолятов, а средний уровень чувствительности С. krusei к флуконазолу составил 15,7%.
Небольшая частота выявления других non-albicans видов Candida (2–7 изолятов в год) не позволяет сделать достоверные выводы о динамике их резистентности к противогрибковым препаратам, но обращает на себя внимание снижение чувствительности C. parapsilosis и C. tropicalis к флуконазолу и миконазолу в последние годы исследования (со 100% до 60% и со 100% до 66,7% соответственно).
Наиболее высокий уровень резистентности Candida был установлен к итраконазолу, при этом наблюдалось увеличение количества нечувствительных изолятов у всех видов грибов с 2010 по 2020 гг. Так, количество C. albicans, нечувствительных к итраконазолу, за исследуемый период возросло с 14,5% до 52,8%, C. krusei – с 0% до 37,5%, C. parapsilosis – с 0% до 60,0%, а средние показатели чувствительности выделенных изолятов находились в пределах от 35,0% (C. glabrata) до 73,1% (C. krusei).
На фоне роста показателей резистентности к препаратам азолового ряда интересными представляются результаты изучения чувствительности Candida к еще одному препарату данной группы – клотримазолу, который также широко применяется в терапии урогенитального кандидоза. За весь период исследования показатели чувствительности к клотримазолу не имели тенденции к снижению и составляли в среднем для C. albicans – 97,8% (100% в 2010 г. и 98,6% в 2020 г.), для C. glabrata – 96,2% (100% и 94,4% соответственно), для C. krusei – 95,4% (100% и 87,5% соответственно), для C. parapsilosis – 90,6% (100% и 80,0% соответственно), для C. tropicalis – 92,3% (100% и 100% соответственно) и для C. kefyr – 96,0% (100% в 2010 г. и 100% в 2020 г.). Полученные данные согласуются с результатами исследований отечественных и зарубежных ученых, проведенных в последние годы и свидетельствующих о высокой чувствительности как C. albicans, так и большинства non-albicans видов Candida к клотримазолу (82,0–96,9%) [12–14].
Основными формами клотримазола, доступными для применения в клинической практике в России, являются вагинальные таблетки в дозировке 100 мг и 500 мг, а также крем 2% для интравагинального введения. Последний, в отличие от клотримазола 1% крема для наружного применения, выпускается в комплекте с тремя одноразовыми гигиеническими аппликаторами для точного дозирования препарата и предпочтителен перед другими формами при сочетанном поражении вульвы и влагалища. Высокие концентрации крема клотримазол 2% сохраняются в вагинальном секрете в течение 48–72 ч, что обеспечивает выраженное фунгицидное действие препарата и повышает эффективность его применения. Согласно исследованию Zhou X. и соавт. (2016), клиническая эффективность при терапии тяжелых форм вульвовагинального кандидоза у пациентов, применявших клотримазол 2% крем, регистрировалась в более ранние сроки, чем у пациентов, применявших флуконазол, что было обусловлено высокими концентрациями активного вещества в месте введения [15]. Таким образом, низкие показатели резистентности всех видов грибов рода Candida к клотримазолу, высокая клиническая эффективность препарата при вульвовагинальном кандидозе, а также возможность его применения при одновременном лечении половых партнеров позволяет считать клотримазол 2% крем одним из препаратов выбора в терапии урогенитального кандидоза.
Заключение
За последнее десятилетие наблюдается изменение этиологической структуры возбудителей урогенитального кандидоза, характеризующееся увеличением доли non-albicans видов грибов рода Candida: C. glabrata, C. krusei, C. parapsilosis, C. tropicalis, C. kefyr. Динамика видового спектра заболевания и снижение чувствительности грибов рода Candida к широко применяемым в терапии препаратам азолового ряда (флуконазолу, итраконазолу, миконазолу) обуславливают необходимость проведения мониторинга антимикотической резистентности и при необходимости – оптимизации схем терапии урогенитального кандидоза в зависимости от данных показателей. Низкий уровень резистентности грибов рода Candida к клотримазолу, высокая эффективность и комплаентность препарата в форме 2% крема обусловливают его выбор в терапии вульвовагинального кандидоза.



