Современный комплексный подход к ведению пациенток с наружным генитальным эндометриозом (НГЭ) включает хирургическое лечение и медикаментозную терапию и направлен на снижение интенсивности эндометриоз-ассоциированной боли, улучшение качества жизни, преодоление бесплодия и предотвращение рецидива заболевания [1, 2]. Применение прогестагенов в последние годы рекомендуется в качестве терапии первой линии при НГЭ (уровень А) [3, 4]. С учетом хронического течения заболевания терапия должна быть длительной и продолжаться до наступления беременности, менопаузы или устойчивой ремиссии [5]. Дидрогестерон является хорошо изученным гестагеном и обладает рядом положительных свойств и преимуществ в лечении эндометриоза в сравнении с другими группами препаратов, рекомендуемых после оперативного лечения [6–8].
Дидрогестерон используется в клинической практике более 60 лет [9, 10]. В 1960-х гг. впервые была обнаружена его эффективность при эндометриозе [11]. С тех пор было проведено значительное количество исследований дидрогестерона для лечения эндометриоза [6, 12–14]. Препарат хорошо изучен не только при эндометриозе, но и при нарушениях менструального цикла, а также при беременности – всего терапию дидрогестероном по различным показаниям получали более 113 млн женщин во всем мире [9, 10, 15–17].
Одно из главных стратегических достоинств дидрогестерона – это отсутствие его влияния на гипофизарно-надпочечниковую ось регуляции репродуктивной системы женщины, а концентрации прогестерона в плазме крови при применении в постовуляторном периоде не снижаются [18]. Помимо этого, дидрогестерон не подавляет овуляцию, поэтому может быть препаратом выбора у женщин, которые планируют беременность, при этом повышается шанс наступления беременности у женщин с эндометриоз-ассоциированным бесплодием [6, 19–21]. Кроме того, дидрогестерон способствует полноценной секреторной трансформации эндометрия, тем самым устраняя риск гиперплазии или канцерогенеза в эндометрии, обусловленный влиянием эстрогенов. Его применение показано во всех случаях дефицита эндогенного прогестерона, и фактически препарат не обладает эстрогенной, андрогенной, термогенной, анаболической и кортикостероидной активностью [22].
Доказано, что препарат снижает риск спорадического и привычного самопроизвольного патологического прерывания беременности при недостаточности лютеиновой фазы. Прием дидрогестерона целесообразен во время беременности, так как при эндометриозе риск самопроизвольного патологического прерывания беременности повышен в 1,7–3 раза, в то время как другие гестагены для лечения эндометриоза противопоказаны при беременности [23–28].
Согласно результатам наблюдательного открытого многоцентрового исследования по применению дидрогестерона для лечения эндометриоза в России (исследование «ОРХИДЕЯ»), оба режима терапии дидрогестероном (непрерывный и пролонгированный циклический) в одобренных дозах в течение 6 месяцев продемонстрировали значительное снижение тяжести хронической тазовой боли и дисменореи, а также улучшение всех оцениваемых параметров качества жизни и сексуальной удовлетворенности. Кроме этого, подтвержден благоприятный профиль безопасности дидрогестерона в обоих режимах терапии [8]. Необходимо учитывать, что эндометриоз является хроническим заболеванием, которое в большинстве случаев требует длительной терапии, поэтому необходимо проводить исследования препаратов на протяжении более длительного времени (12 месяцев и более).
Цель исследования: оценить эффективность применения длительной гормональной терапии (на примере дидрогестерона) после хирургического лечения наружного генитального эндометриоза в отношении снижения интенсивности эндометриоз-ассоциированной боли, улучшения качества жизни, преодоления бесплодия и профилактики рецидива болезни в течение 12 месяцев наблюдения.
Материалы и методы
Исследование проведено в период с сентября 2018 по апрель 2020 гг. в отделении онкогинекологии №7 клиники акушерства и гинекологии ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова» Минздрава России на базе кафедры акушерства, гинекологии и неонатологии (заведующий кафедрой, руководитель клиники – д.м.н., профессор В.Ф. Беженарь). Морфологическое и иммуногистохимическое исследования проведены на кафедре патологической анатомии с патологоанатомическим отделением ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова» Минздрава России (заведующая кафедрой – д.м.н., профессор М.Г. Рыбакова).
Исследование было обсервационным продольным (лонгитюдным) проспективным. В исследование была включена 51 пациентка, из них 35 пациенток были также включены в наблюдательную открытую многоцентровую программу по описанию эффектов пероральной гормональной терапии дидрогестероном у женщин с подтвержденным диагнозом эндометриоза в условиях реальной клинической практики («ОРХИДЕЯ»), остальные 16 пациенток были отобраны в группу настоящего исследования согласно критериям включения и невключения.
Критерии включения: возраст 18–45 лет; наличие эндометриоза, подтвержденного при лапароскопии и гистологически; наличие у пациенток жалоб на хроническую тазовую боль, связанную с эндометриозом; назначенная терапия дидрогестероном в послеоперационном периоде; отсутствие в анамнезе онкологических заболеваний и тяжелой соматической патологии; подписанное информированное согласие на участие в исследовании.
Критерии невключения: возраст моложе 18 и старше 45 лет; наличие онкологических заболеваний, тяжелой соматической патологии в настоящее время и в анамнезе; психические заболевания; наличие противопоказаний к оперативному лечению; прием гормональных препаратов менее чем за 3 месяца до даты предполагаемого исследования.
Критерии исключения: отказ от продолжения участия в исследовании; острые воспалительные заболевания органов малого таза во время исследования.
На первом этапе работы, после того, как у пациенток было получено информированное согласие на исследование, проводилось догоспитальное анкетирование: сбор жалоб, анамнеза, оценка интенсивности эндометриоз-ассоциированной боли с использованием шкалы NRS (Numeric Rating Scale for Pain, числовая рейтинговая шкала боли), клинико-инструментальное обследование, лапароскопическое хирургическое лечение. Интраоперационно выполнялось стадирование эндометриоза согласно классификации R-AFS, у всех пациенток диагноз подтвержден гистологически.
На втором этапе исследования выполнялось гистологическое и иммуногистохимическое исследование операционного материала.
На третьем этапе исследователи оценивали течение послеоперационного периода, через 6 и 12 месяцев повторно оценивались жалобы, динамика изменения эндометриоз-ассоциированной боли, изменения качества жизни с использованием шкалы SF-36, удовлетворенность половой жизнью с использованием опросника FSFI, ранние и поздние послеоперационные осложнения, наличие рецидива и наступление беременности у пациенток с бесплодием.
Статистический анализ
Статистический анализ данных выполнялся с использованием пакетов программ Microsoft Office и SAS v9.4. Для описания разных значений категориальных данных рассчитывались абсолютные частоты и проценты от количества наблюдений в группе. Обработка категориальных данных была проведена с использованием таблиц частот, таблиц сопряженности, критерия χ2 или точного критерия Фишера (в случае малого числа наблюдений). Для количественных данных была выполнена проверка распределения на нормальность с помощью критерия Колмогорова–Смирнова. Количественные нормально распределенные переменные описаны через среднее значение и стандартное отклонение, переменные, имеющие распределение отличное от нормального, – при помощи медианы, 25 и 75 квантилей.
Результаты и обсуждение
После отбора пациенток в группу исследования была проведена проверка на однородность и нормальность распределения: пациентки по всем показателям исследования были однородны, распределение выборки было нормальным.
Возраст пациенток, которые были включены в исследование, составил от 21 до 43 лет, медианный возраст составил 32,23±4,0 года. Это говорит о том, что наиболее уязвимыми в отношении эндометриоза являются молодые женщины в самом подходящем для реализации репродуктивной функции возрасте. Основными жалобами у обследованных женщин были: боли – у 51 (100%) пациентки, нарушение менструального цикла (НМЦ) по типу гиперполименореи (обильные менструальные кровотечения (ОМК)) – у 25 (49%) пациенток, бесплодие – у 16 (31%) пациенток (первичное – у 12 (75%) и вторичное у 4 (25%) женщин), жалобы на изменения стула в дни менструации (боль, окрашивание кровью, «карандашевидный стул») и на изменение мочеиспускания в дни менструации у 5 (10%) и 3 (6%) пациенток соответственно.
В структуре болевого синдрома дисменорея присутствовала у всех исследуемых женщин (медианная интенсивность боли по шкале NRS составила 8 (6;9)), диспареуния – у 31 (61%) женщины (медианная интенсивность боли по шкале NRS составила 5 (2;7)), хроническая тазовая боль – у 39 женщин (77%) (медианная интенсивность боли по шкале NRS составила 6 (1;9)). Давность дебюта жалоб составила 4 (2;6) года. Проанализирована консервативная терапия боли у пациенток до лапароскопически диагностированного эндометриоза: из 51 пациентки 10 (20%) принимали нестероидные противовоспалительные средства (НПВС), 7 (14%) – различные комбинированные оральные контрацептивы (КОК), 4 (8%) – дидрогестерон, 4 (8%) – диеногест, 3 (6%) – проходили лечение у психотерапевта, 2 (4%) – получали иглорефлексотерапию, 13 (25%) – использовали прочие препараты, рекомендованные специалистами смежных специальностей (уролог, гастроэнтеролог, невролог), 8 (16%) – лечение не получали. При этом пациентки субъективно оценивали эффект от проводимого консервативного лечения до проведенной операции следующим образом: абсолютно без эффекта – 29 (68%) женщин, незначительное улучшение – 9 (21%) больных, значимое улучшение – 4 (9%) пациентки и лишь 1 (2%) женщина демонстрировала полное купирование болевого синдрома, что подтверждает необходимость выполнения хирургического иссечения эндометриоидных гетеротопий на первом этапе диагностики и лечения эндометриоза.
 Нами было проанализировано количество лапароскопических операций по поводу эндометриоза в анамнезе у обследованных женщин. Основными показаниями для выполненных ранее операций были: УЗ- и МР-признаки наличия эндометриом яичников, инфильтративного эндометриоза, клинические проявления эндометриоза (НМЦ по типу дисменореи, диспареуния, хроническая тазовая боль), диагностика причин бесплодия. Только у 17 (33%) пациенток операций в анамнезе не было, у 24 (47%) больных – 1 операция, у 7 (14%) женщин – 2 операции, а у 3 (6%) – 3 операции в анамнезе. Важно отметить, что треть пациенток не получали гормономодулирующую терапию в послеоперационном периоде ранее, остальным больным была рекомендована терапия различными препаратами в послеоперационном периоде: 9 (27%) – КОК, 8 (24%) – медикаментозное лечение не получали, 4 (12%) – препарат дидрогестерона, 4 (12%) – антагонисты гонадотропин-рилизинг-гормона (а-ГнРГ), 3 (9%) – после операции рекомендовано планирование беременности, 2 (6%) – диеногест 2 мг, 2 (6%) – левоноргестрел-содержащая внутриматочная система (ВМС), 2 (6%) – вспомогательные репродуктивные технологии (ВРТ). Средняя продолжительность гормональной терапии составила 14 месяцев, после чего последовал рецидив эндометриоза. Полученные результаты еще раз подтверждают, что эндометриоз – это хроническое, рецидивирующее, подчас крайне агрессивное заболевание, требующее пролонгированной гормональной терапии после оперативного лечения.
Нами было проанализировано количество лапароскопических операций по поводу эндометриоза в анамнезе у обследованных женщин. Основными показаниями для выполненных ранее операций были: УЗ- и МР-признаки наличия эндометриом яичников, инфильтративного эндометриоза, клинические проявления эндометриоза (НМЦ по типу дисменореи, диспареуния, хроническая тазовая боль), диагностика причин бесплодия. Только у 17 (33%) пациенток операций в анамнезе не было, у 24 (47%) больных – 1 операция, у 7 (14%) женщин – 2 операции, а у 3 (6%) – 3 операции в анамнезе. Важно отметить, что треть пациенток не получали гормономодулирующую терапию в послеоперационном периоде ранее, остальным больным была рекомендована терапия различными препаратами в послеоперационном периоде: 9 (27%) – КОК, 8 (24%) – медикаментозное лечение не получали, 4 (12%) – препарат дидрогестерона, 4 (12%) – антагонисты гонадотропин-рилизинг-гормона (а-ГнРГ), 3 (9%) – после операции рекомендовано планирование беременности, 2 (6%) – диеногест 2 мг, 2 (6%) – левоноргестрел-содержащая внутриматочная система (ВМС), 2 (6%) – вспомогательные репродуктивные технологии (ВРТ). Средняя продолжительность гормональной терапии составила 14 месяцев, после чего последовал рецидив эндометриоза. Полученные результаты еще раз подтверждают, что эндометриоз – это хроническое, рецидивирующее, подчас крайне агрессивное заболевание, требующее пролонгированной гормональной терапии после оперативного лечения.
На втором этапе исследования всем пациенткам выполнялось лапароскопическое оперативное лечение эндометриоза, у одной пациентки лапароскопия была дополнена мини-лапаротомией в связи с необходимостью циркулярной резекции участка толстой кишки, пораженной эндометриозом, с наложением анастомоза. Стадирование эндометриоза было выполнено интраоперационно согласно классификации R-AFS. У 4 (8%) пациенток диагностирована I стадия эндометриоза, у 5 (10%) – II стадия, у 17 (33%) – III стадия и у 25 (49%) – IV стадия. Объем хирургического вмешательства при генитальной и экстрагенитальной формах эндометриоза представлен в таблице 1.

При проведении гистологического и иммуногистохимического исследований эндометриоз подтвержден у 51 (100%) пациентки. Фокусы гетеротопий были представлены преимущественно активными пролиферирующими очагами, состоящими из цитогенной стромы и железистого компонента. Все исследуемые образцы инфильтративных форм имели перивазальный тип роста – 87,3% (рис. 1) и в меньшей степени – периневральный (рис. 1, 2) – 21%, что позволяет говорить о различных путях распространения эндометриоза; ганглии встречались в 6% образцов.
Степень выраженности неоваскулогенеза и признаки воспалительной реакции были разнообразными и варьировали от умеренного до выраженного (рис. 3).
Важной находкой было то, что при гистологическом исследовании макроскопически интактной брюшины в 50% случаев при микроскопическом исследовании выявлялись очаги эндометриоидной гетеротопии размерами от 0,20 до 0,47 мм (рис. 4), что в очередной раз подтверждает необходимость проведения гормонотерапии после хирургического лечения для снижения вероятности рецидива.
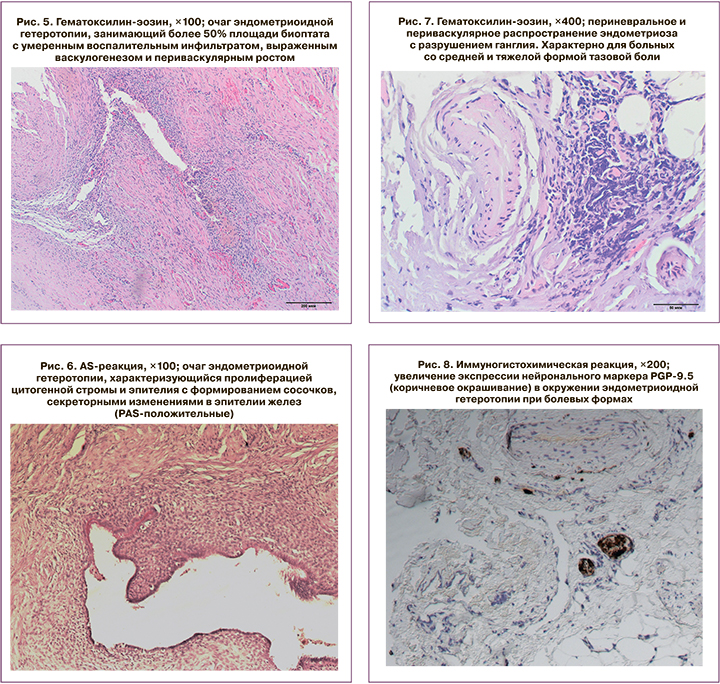
При проведении морфологического исследования нами были отмечены характерные морфологические признаки и различия в морфологической структуре эндометриоидных инфильтратов у пациенток с низкой, средней и тяжелой степенью тазовой боли. Например, особенностями эндометриоидного инфильтрата у женщин с низкой интенсивностью эндометриоз-ассоциированной тазовой боли явились: очаг, занимающий площадь до 30% биоптата; слабовыраженный воспалительный инфильтрат, наличие фиброзной ткани в инфильтрате.
Особенностями инфильтратов у пациенток со средней и тяжелой интенсивностью боли были: очаг, занимающий более 50% площади биоптата (рис. 5); умеренный воспалительный компонент (рис. 5); выраженный васкулогенез, периваскулярный рост (рис. 5); пролиферация цитогенной стромы и формирование сосочков (рис. 6); cекреторные изменения в эпителии желез, положительная PAS-реакция (рис. 6); периневральное, периваскулярное распространение эндометриоза с разрушением ганглиев (рис. 7); увеличение экспрессии нейронального маркера PGP-9,5 в зоне эндометриоза при болевых формах (рис. 8).
В послеоперационном периоде ни у одной из исследуемых пациенток не были отмечены ранние или поздние послеоперационные осложнения. Медианное значение кровопотери составило 100 (50; 100) мл, медианное значение продолжительности операции – 110 (80;120) минут. Далее, после гистологической верификации эндометриоза, в качестве гормономодулирующей терапии после операции все пациентки, включенные в исследование, получали дидрогестерон 20 мг/сут в различных режимах, в зависимости от того, какова была степень выраженности эндометриоз-ассоциированной боли, а также учитывалось наличие репродуктивных планов, клинических и морфологических особенностей. Рандомизация по выбору схемы терапии не проводилась. 31 (61%) пациентка получала терапию дидрогестероном в циклическом режиме: в дозировке 10 мг 2 раза в день с 16-го по 25-й день менструального цикла; 16 (31%) пациенток – в пролонгированном циклическом режиме: в дозировке 10 мг 2 раза в день с 5-го по 25-й день менструального цикла; 4 (8%) пациентки – в непрерывном режиме: в дозировке 10 мг 2 раза в день с 1-го дня менструального цикла непрерывно. Все пациентки, включенные в исследование, получали терапию дидрогестероном минимум 12 месяцев, на фоне которой через 6 и 12 месяцев была проанализирована динамика изменения боли и качества жизни.
Через 6 и 12 месяцев наблюдения за интенсивностью боли отмечалось статистически значимое снижение интенсивности дисменореи, диспареунии и хронической тазовой боли (p<0,0001) (табл. 2).
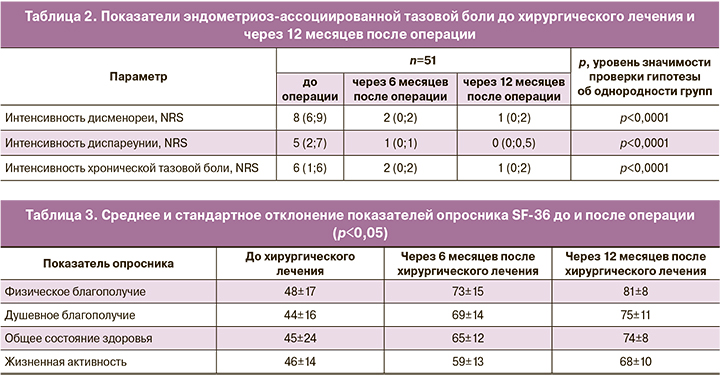
Через 12 месяцев после хирургического лечения на фоне гормономодулирующей терапии было отмечено, что статистически значимо повышалась удовлетворенность качеством половой жизни, оцененная с использованием опросника FSFI. Также через 6 и 12 месяцев после операции, на фоне терапии дидрогестероном отмечено статистически значимое улучшение показателей опросника качества жизни SF-36 по всем параметрам душевного и физического здоровья – динамика изменения показателей опросника отражена в таблице 3, p<0,05 для всех показателей.
Через 12 месяцев после проведенного оперативного вмешательства на фоне терапии дидрогестероном проанализирована частота наступления беременности у 16 пациенток с бесплодием, планирующих беременность (при наличии репродуктивных планов пациентки, принимающие дидрогестерон в непрерывном и пролонгированном режимах, сменили схему приема на циклический режим – с 16-го по 25-й день менструального цикла). У 10 (62%) пациенток наступила спонтанная беременность, у 3 (19%) пациенток беременность наступила с применением ВРТ, у 3 (19%) – беременность не наступила. После наступления беременности 11 (85%) пациенток продолжали прием дидрогестерона в дозировке 10 мг 2 раза в день до срока 16–20 недель беременности, 2 (15%) пациентки сменили дидрогестерон на препараты другой группы гестагенов по рекомендациям репродуктолога. Из 13 пациенток, у которых наступила беременность, у 9 (69%) она закончилась срочными родами, у 2 (15%) – родоразрешением путем операции кесарева сечения при доношенном сроке беременности, у 1 (8%) пациентки – преждевременными родами при сроке беременности 36/37 недель и у 1 (8%) пациентки – самопроизвольным абортом при сроке беременности 5/6 недель.
Заключение
Проведенное исследование доказывает необходимость комбинированной терапии эндометриоза: первым этапом рекомендуется применение лапароскопического хирургического лечения, которое должно быть допустимо радикальным по отношению к пораженным заболеванием тканям и в то же время максимально щадящим по отношению к здоровым тканям. Назначение медикаментозной терапии эндометриоза после оперативного вмешательства является обязательным на срок не менее 6 месяцев при наличии репродуктивных планов и максимально длительным – при их отсутствии.
Полученные результаты показывают эффективность применения дидрогестерона в качестве послеоперационной гормональной терапии: через 12 месяцев после операции на фоне лечения дидрогестероном отмечены статистически значимое снижение эндометриоз-ассоциированной боли, улучшение качества жизни женщин, их удовлетворенность половой жизнью, а также высокая частота реализации репродуктивной функции у пациенток с бесплодием.
Более того, дидрогестерон имеет хорошую переносимость при благоприятном профиле безопасности и позволяет врачам индивидуализировать терапию эндометриоза в зависимости от клинической ситуации, используя удобные режимы: непрерывный и пролонгированный циклический режим с 5-го по 25-й день менструального цикла в дозировке по 20 или 30 мг в день для лечения эндометриоз-ассоциированной боли, а для пациенток с бесплодием на фоне эндометриоза, планирующих беременность, – циклический режим приема препарата во вторую фазу менструального цикла.



