Бисфенол А – это химическое вещество, которое широко используется в производстве различных продуктов на основе поликарбонатного пластика и эпоксидных смол. Наиболее часто контакт с бисфенолом А осуществляется при употреблении пищи из пластиковой посуды и бутылок. Также бисфенол А используется в стоматологии (при производстве материалов для некоторых видов пломб), в консервной промышленности (им выстилают внутреннюю поверхность жестяных консервных банок), для производства термобумаги (кассовые чеки и т.д.). Учитывая широкую распространенность поликарбонатного пластика в повседневной жизни, бисфенол А определяется в организме 95–100% взрослых людей в популяции [1, 2].
Бисфенол А является «эндокринным разрушителем» (англ. – «endocrine disruptor»); данным термином Американское общество эндокринологов характеризует экзогенные химические вещества (или смесь химических веществ), влияющие на какой-либо аспект действия гормонов.
Биохимические исследования показали, что бисфенол А имитирует действие эстрадиола, связываясь как с рецепторами ER-α, так и с ER-β, причем аффинность к ER-β значительно выше [3]. Также бисфенол А обладает антиандрогенной активностью, мутагенностью, может оказывать эпигенетическое воздействие, что потенциально может приводить к трансгенерационной передаче (т.е. вызывать различные патологии у следующих поколений) [4]. Бисфенол А способен проникать через гистогематические барьеры. Показано наличие бисфенола А в фолликулярной жидкости (ФЖ) у пациенток в программах вспомогательных репродуктивных технологий (ВРТ), однако взаимосвязь между уровнем бисфенола А, процессами стероидогенеза в клетках гранулезы и качеством ооцитов остается неясной [5, 6].
Учитывая повсеместную распространенность бисфенола А и его эстрогенные свойства, в научном сообществе возрастает интерес к изучению негативного влияния эндокринных разрушителей на репродуктивную систему.
Цель данного исследования: проанализировать связь между уровнем бисфенола А в организме пациенток с бесплодием и исходами программ ВРТ.
Материалы и методы
Дизайн исследования
В проспективное исследование была включена 301 супружеская пара, обратившаяся для лечения бесплодия с помощью ВРТ в период с 2017 г. по 2018 г., с отсутствием противопоказаний к проведению ВРТ. Исследование было одобрено комиссией по этике биомедицинских исследований ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России (17.10.2016). Все пациенты, включенные в исследование, подписали информированное согласие.
Критериями включения явились: нормальный кариотип обоих супругов, отсутствие выраженной патоспермии (100% тератозооспермия, абсолютная астенозооспермия, все виды азооспермии), возраст женщин от 18 до 39 лет включительно, индекс массы тела (ИМТ) женщин от 19 до 25 кг/м2 включительно. Критериями исключения явились использование донорских гамет или суррогатного материнства, а также получение 3 и менее ооцитов в день трансвагинальной пункции яичников (ТВП).
Все включенные в исследование супружеские пары были обследованы согласно приказу Минздрава России №107н от 30.08.2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [3].
Овариальная стимуляция проводилась по протоколу с антагонистами гонадотропин-рилизинг-гормона, доза гонадотропинов была подобрана индивидуально. Триггер овуляции вводили при наличии в яичниках фолликулов диаметром 17 мм и более. В качестве триггера овуляции использован хорионический гонадотропин человека (ХГЧ) в дозе 8000–10 000 МЕ или агонист гонадотропин-рилизинг-гормона в дозе 0,2 мг. Поддержка лютеиновой фазы и посттрансферного периода у всех пациенток проведена по стандартному протоколу.
Оплодотворение ооцитов осуществляли с помощью инсеминации ооцитов in vitro («классическое» ЭКО, далее ЭКО – метод оплодотворения) или интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ). Во время оплодотворения проводили морфологическую оценку ооцитов с помощью метода световой микроскопии, определяли наличие цитоплазматических дисморфизмов. Культивирование и перенос эмбриона проводили согласно принятым в клинической практике методикам.
Через 14 дней после переноса эмбриона в полость матки определялась концентрация β-ХГЧ в сыворотке крови пациентки. При визуализации сердцебиения эмбриона через 5 недель после переноса эмбриона регистрировали клиническую беременность. Через 40 недель после переноса эмбриона проводили телефонный опрос пациенток для анализа исходов беременности. Под частотой наступления беременности понимали отношение числа клинических беременностей к общему числу нативных циклов с переносом эмбриона. Под частотой живорождения понимали отношение числа родов живым плодом к общему числу нативных циклов с переносом эмбриона. Под кумулятивной частотой живорождения понимали отношение числа живорождений в данном цикле и живорождений после переноса размороженных эмбрионов, полученных в данном цикле ЭКО или ИКСИ, к общему числу циклов.
Сбор и предварительная обработка образцов
Забор венозной крови для проведения исследования осуществляли в день ТВП, после чего образцы подвергали криоконсервации при t= -80°С. Образцы ФЖ отбирали непосредственно после извлечения ооцитов. Образцы ФЖ, контаминированные кровью, исключались из исследования.
Определение уровня бисфенола А проводили методом масс-спектрометрии, при этом лаборатория не имела доступа к клиническим характеристикам пациенток.
Количественный анализ уровня бисфенола А в сыворотке крови методом хромато-масс-спектрометрии (ВЭЖХ-МС/МС)
Бензофенон (Ph2CO, 182,22 г/моль, Sigma-aldrich, 99% чистота) использовался в качестве внутреннего стандарта. Для повышения чувствительности метода проводилась предварительная дериватизация дансил хлоридом (99%, HPLC-grage, Sigma-aldrich). Все сток-растворы готовились посредством растворения требуемого количества бисфенола А (4,4'-isopropyl-idenediphenol, 228,29 г/моль, Sigma-aldrich) или бензофенона в 100% MeOH (99,9%, HPLC Basic, Scharlau). До использования растворы хранились в холодильнике при температуре 40°С не больше 1 недели в стеклянных виалах. Все стеклянные стаканчики промывались гексаном для устранения возможного загрязнения в процессе пробоподготовки.
К 700 мкл сыворотки крови добавлялось 70 мкл IS (10 мкг/мл бензофенон в 100% MeOH) с последующим перемешиванием на вортексе и центрифугированием. После добавления 700 мкл MTBE (≥99,5%, HPLC grade, Fisher Chemical), перемешивания на вортексе в течение 1 минуты, центрифугирования на 13 000 об/мин при комнатной температуре в течение 10 минут проводили забор верхней фазы. Экстракцию проводили еще два раза, затем органическую фазу сушили в потоке N2 при 40°C до полного высыхания раствора. Для дериватизации бисфенола А добавляли 100 мкл свежеприготовленной смеси дансил хлорид (1 мг/мл в ацетонитриле) и Na2CO3 (1 мг/мл в воде) (1:1), термостатированили при 70°C в течение 10 минут, центрифугировали при 13000 об/мин при комнатной температуре в течение 10 минут. Надосадочную жидкость в объеме 90 мкл переносили в стеклянную виалу со вставкой для последующего хромато-масс-спектрометрического анализа.
Пробоподготовка проводилась в пластиковых эппендорфах 2 мл, которые не содержат бисфенол A. Данное утверждение было проверено укороченной пробоподготовкой, в процессе которой 1,8 мл MTBE держали в течение 3 ч в пустых пластиковых эппендорфах, после этого добавляли 70 мкл IS и сушили в токе N2 при температуре 40°C до полного высыхания, после чего продолжалась стандартная пробоподготовка. В полученных смывах с эппендорфов BPA не обнаружено.
Для построения калибровочной кривой в качестве матрицы использовалась вода MS-grade, что позволило достичь порога чувствительности методики от 0,1 нг/мл. К 700 мкл H2O добавлялись 70 мкл IS и 70 мкл сток раствора требуемой концентрации. Калибровочная кривая была построена по 9 точкам (коэффициент корреляции выше 0,99) с концентрациями BPA в получившемся образце в диапазоне от 0,1 до 100 нг. В качестве контроля качества брались 4 QC: QC1=0,2 нг, QC2=0,6 нг, QC3=50 нг и QC4=75 нг бисфенола A. Предел чувствительности LOQ составил 0,2 нг.
Хроматографическое разделение осуществлялось на Agilent Technologies 1260 infinity с масс-спектрометрическим детектированием (QTRAP 5500 ABSciex) в режиме электроспрей (ESI-MS/MS) в положительной моде в режиме MRM. Для анализа использовалась колонка Zorbax Eclipse plus C18, размер 3×50 мм, размер зерна 1,8 мкм. Подвижная фаза A – дистиллированная H2O с 0,1% муравьиной кислотой, подвижная фаза B – ацетонитрил с 0,1% муравьиной кислотой. Измерения проводились в изократическом режиме в течение 5 минут с постоянным соотношением фаз A/B=4/96 при скорости потока 450 мкл/мин, температуре колонки 35°C и объеме пробы 5 мкл. ВЭЖХ-МС/МС-анализ проводился в трех технических повторах. Мертвое время системы в данных условиях не превышало 0,5 мин, время выхода IS – 0,76 мин, а время выхода BPA – 1,48 мин. В таблице 1 приведены параметры используемых MRM-переходов.

Статистический анализ
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Данные с нормальным распределением представлены как среднее значение (стандартное отклонение) или как медианы (интерквартильный размах). Статистический анализ проводился с применением χ2-теста для сравнения категориальных переменных, теста Крускелла–Уоллиса – для сравнения медиан. Для корреляционного анализа использовали критерий Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне р<0,05.
Результаты
Порог определения уровня бисфенола А (как в крови, так и в ФЖ) составил 0,1 нг/мл. Бисфенол А был обнаружен в 92,9% (277/298) образцах крови и в 16,8% (49/292) образцах ФЖ (табл. 2).
При сравнении уровней бисфенола А в крови и в ФЖ одних и тех же пациенток статистической связи не выявлено (r=-0,157, p=0,288).
Далее были проанализированы клинико-анамнестические характеристики в квартильных подгруппах (табл. 3). Не было выявлено статистически значимых различий по возрасту пациенток и ИМТ. Медианы уровней основных гормонов также были сравнимы в квартильных подгруппах. Не было найдено различий при оценке основных параметров фолликулогенеза и оогенеза.
Далее были проанализированы особенности эмбриологического этапа в различных квартилях бисфенола А. Полученные данные представлены в таблице 4.
Медиана числа фолликулов, ооцитов, зрелых ооцитов, морфология ооцитов, частота оплодотворения ооцитов и количество бластоцист не различались в группах сравнения. Частота наступления клинической беременности, родов, кумулятивная частота родов (Σ частота родов) значимо не различались в группах. Наблюдалась тенденция к увеличению частоты потерь беременности в I триместре при повышении уровня бисфенола А, однако различия не достигли статистической значимости.
Не было выявлено статистически значимой связи между уровнем бисфенола А в ФЖ и количеством ооцитов (р=0,323), количеством зрелых ооцитов (р=0,220), числом бластоцист (р=0,503). При разделении пациенток на группы в зависимости от наличия или отсутствия определяемого (т.е. 0,1 нг/мл и выше) уровня бисфенола А в ФЖ не было выявлено статистически значимых различий в эмбриологических параметрах. Частота наступления беременности была несколько выше в подгруппе пациенток, у которых уровень бисфенола А в ФЖ не определялся, однако различия не были статистически значимы (табл. 5).
Затем был проведен подробный анализ подгруппы пациенток, у которых уровень бисфенола А в ФЖ был выше порога определения (т.е. ≥0,1 нг/мл).
Обнаружено, что среди 48 пациенток, у которых имелись результаты уровня бисфенола А как в крови, так и в ФЖ, у 24 пациенток уровень бисфенола А был выше в ФЖ, а у других 24 пациенток – в крови.
В таблице 6 представлены основные параметры оогенеза и раннего эмбриогенеза в зависимости от наличия бисфенола А в ФЖ, а также соотношения между уровнем бисфенола А в крови и в ФЖ.
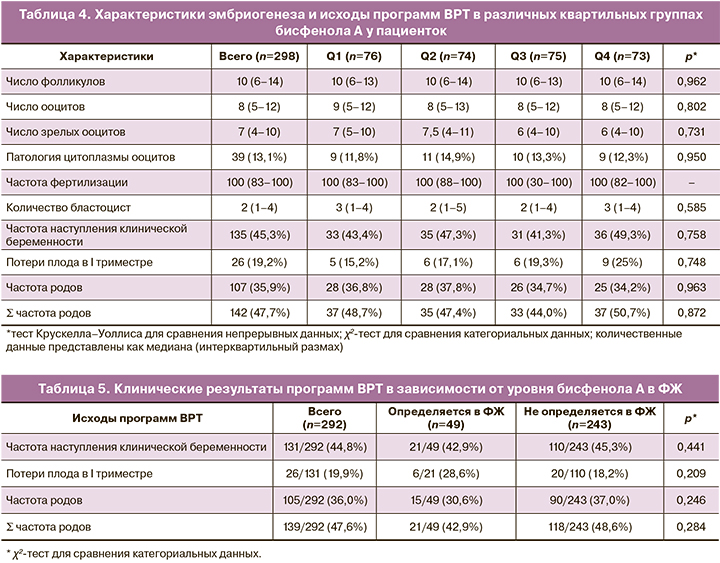
Медиана числа ооцитов в общем и числа зрелых ооцитов была ниже в группе пациенток, у которых уровень бисфенола А в ФЖ превышал аналогичный уровень в крови (рис. 1).
 Также в подгруппе пациенток, у которых уровень бисфенола А в ФЖ превышал уровень бисфенола А в крови, наблюдали снижение соотношения между числом зрелых ооцитов и числом ооцитов в целом. Ни у одной пациентки в данной подгруппе не было получено 100% зрелых ооцитов в общей когорте.
Также в подгруппе пациенток, у которых уровень бисфенола А в ФЖ превышал уровень бисфенола А в крови, наблюдали снижение соотношения между числом зрелых ооцитов и числом ооцитов в целом. Ни у одной пациентки в данной подгруппе не было получено 100% зрелых ооцитов в общей когорте.
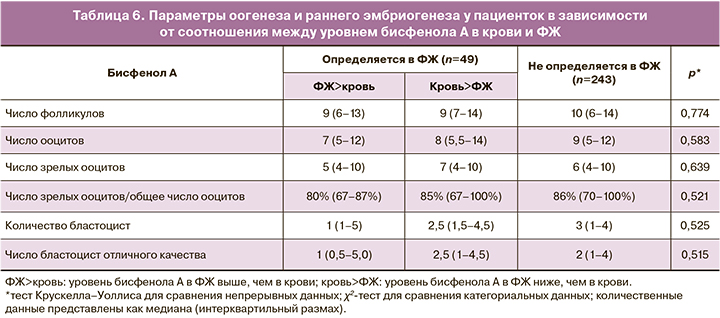
В результате в данной подгруппе пациенток наблюдали снижение общего числа бластоцист и числа бластоцист отличного качества (рис. 2).
Таким образом, несмотря на то, что различия не достигли статистической значимости, наблюдалась тенденция к снижению количества и качества ооцитов и эмбрионов в подгруппе пациенток, у которых уровень бисфенола в ФЖ превышал аналогичный уровень в крови.
С учетом погрешности измерения бисфенола А в биологических жидкостях целесообразно искать значение целевого параметра по формуле (Cfolfluid+0,1 нг/мл)/(Сblood+0,1 нг/мл), где значение 0,1 нг/мл – погрешность измерения. Таким образом, для статистического анализа был введен дополнительный показатель, распределение которого находилось в диапазоне между 0,03 и 15 (коэффициент Бисфенол А ФЖ/кровь).
Проведен корреляционный анализ связи между соотношением бисфенола А в крови и ФЖ, весом и ИМТ пациентки, уровнем антимюллерова гормона, а также числом ооцитов и эмбрионов. Обнаружена статистически значимая слабая положительная связь между указанным показателем и ИМТ пациентки (r=0,14; р=0,0488).
Обсуждение
По данным нашего исследования, бисфенол А в детектируемой концентрации был обнаружен у большинства пациентов, что согласуется с данными, полученными в других странах, при изучении различных категорий пациентов [1, 3, 7].
Бисфенол А был обнаружен в 16,7% образцов ФЖ пациенток с бесплодием, при этом не обнаружено связи между уровнем бисфенола А в крови и ФЖ. Существует ограниченное число исследований, посвященных оценке уровня эндокринных разрушителей в биологических жидкостях пациенток. Результаты подобных исследований противоречивы, так как во всех работах используются разные методы определения эндокринных разрушителей А, объектом исследования являются различные категории пациенток, исследуются различные вещества [8]. Мы предполагаем, что отсутствие связи между уровнем бисфенола А в крови и в ФЖ пациенток может быть связано с различной скоростью метаболизма бисфенола А в ФЖ (возможно, вследствие генетических особенностей пациенток) или различной длительностью экспозиции к эндокринным разрушителям, что является предпосылкой для дальнейших исследований.
При оценке эмбриологического этапа программ ВРТ мы не обнаружили значимого влияния бисфенола А в крови на количество ооцитов, частоту оплодотворения, количество и качество бластоцист. Частота наступления клинической беременности также не различалась в квартильных группах, однако наблюдалась тенденция к повышению частоты ранних репродуктивных потерь при повышении уровня бисфенола А.
Патогенез самопроизвольного прерывания беременности на ранних сроках на фоне негативного влияния бисфенола А не определен. Наиболее частой причиной ранних репродуктивных потерь являются генетические нарушения эмбриона; при этом есть данные о влиянии эндокринных разрушителей на мейоз, полученные на моделях животных [9, 10].
Основным объектом нашего интереса была оценка влияния уровня бисфенола А в ФЖ на параметры оогенеза и раннего эмбриогенеза, так как, вероятно, содержание различных веществ в ФЖ более точно коррелирует с качеством ооцитов по сравнению с содержанием аналогичных веществ в крови. Тем не менее в нашем исследовании не было найдено связи между уровнем бисфенола А в ФЖ, количеством ооцитов и эмбрионов. В аналогичном исследовании Poormoosavi et al. уровень эндокринных разрушителей в ФЖ негативно влияет на количество ооцитов, а также на частоту возникновения морфологических аномалий ооцитов [11]. Также не было найдено различий при сравнении параметров оогенеза и раннего эмбриогенеза у пациенток с определяемой и неопределяемой концентрацией бисфенола А в ФЖ.
Следует отметить, что средние и максимальные уровни бисфенола А в ФЖ значительно ниже по сравнению с содержанием бисфенола А в крови; аналогичные результаты описаны в литературе [11]. Однако при более подробном анализе группы пациенток с определяемым уровнем бисфенола А в ФЖ обнаружено, что в половине случаев (n=24) уровень бисфенола А в ФЖ был выше, чем в крови. В данной подгруппе пациенток наблюдали тенденцию к снижению количества ооцитов и эмбрионов. Негативное влияние эндокринных разрушителей на транскрипционный профиль генов кумулюсных клеток показано в различных исследованиях [12, 13], что может объяснять снижение частоты бластуляции у данных пациенток. Однако остается неясным вопрос, почему подобная тенденция характерна только для тех пациенток, у которых уровень бисфенола А в ФЖ выше, чем в крови. Нужно учитывать, что бисфенол А может попадать в яичник и, соответственно, в ФЖ только через системный кровоток. Вероятно, соотношение между уровнем эндокринных разрушителей в различных биологических тканях определяется индивидуальными особенностями гистогематических барьеров и системы детоксикации.
При дальнейшем анализе выявлена связь между соотношением бисфенола А в ФЖ/крови и ИМТ пациентки. Полученные данные открывают перспективы для дальнейших исследований.
Заключение
По данным нашего исследования, бисфенол А определяется у большинства пациенток с бесплодием в программах ВРТ. Бисфенол А может проникать через гистогематические барьеры и попадать в ФЖ, что ассоциировано со снижением качества ооцитов и эмбрионов.



