Распространенность бесплодия среди супружеских пар репродуктивного возраста растет, достигая 15%. Среди всех доступных методов лечения бесплодия вспомогательные репродуктивные технологии (ВРТ) имеют самые высокие показатели наступления беременности и рождения живых детей. Сегодня, по оценкам экспертов, 2–3% всех родов в развитых странах являются результатом программ ВРТ [1].
Однако, несмотря на широкое применение программ ВРТ для лечения бесплодия и увеличивающееся с каждым годом количество пациентов, проходящих программу ЭКО, процент эффективности лечения остается достаточно низким [2].
Целью стимуляции овуляции при проведении программ ЭКО является получение большого количества ооцитов для снижения риска неудач путем выбора наиболее приемлемого эмбриона для переноса [3, 4].
Выбор эмбриона с высоким имплантационным потенциалом является одним из ведущих факторов успешного лечения бесплодия при использовании ВРТ [5]. В настоящее время оценка эмбрионов в основном основывается на морфологических критериях и скорости дробления клеток. Однако, точность такого метода отбора эмбрионов остается недостаточно высокой, хотя его использование и привело к значительному повышению результативности программ ЭКО [6]. Таким образом, развитие точных и малоинвазивных объективных методов оценки качественных ооцитов и жизнеспособных эмбрионов является одной из наиболее важных направлений репродуктивной медицины.
Достаточно многообещающе выглядят исследования последнего десятилетия, показывающие возможность оценки качества ооцитов по состоянию окружающих его клеток, получаемых при выделении кумулюс- ооцитарного комплекса после пункции фолликула.
Кумулюсные клетки, непосредственно окружающие ооцит, образуются в процессе фолликулогенеза на этапе формирования полости внутри фолликула из низкодифференцированных предшественников – клеток гранулезы [7]. Основным фактором дифференцировки клеток-предшественников кумулюса является изменение соотношения ФСГ/ЛГ в плазме крови[7]. Кумулюсные клетки тесно связанны с ооцитом посредством специальных щелевых контактов, позволяющих осуществлять метаболический обмен и транспорт сигнальных молекул [8]. Ооцит, в свою очередь, продуцирует растворимые факторы роста (ооцит секретируемые факторы (OSF)), необходимые для роста окружающих фолликулярных клеток на разных этапах развития. Эти факторы роста регулируют различные функции гранулезных и кумулюсных клеток, включающие дифференцировку, пролиферацию, апоптоз и лютеинизацию [7]. Таким образом, связь между ооцитом и кумулюсными клетками является двунаправленной: кумулюсные клетки ответственны за развитие и созревание ооцитов, а ооциты, в свою очередь, играют важную роль в пролиферации и развитии окружающих их фолликулярных клеток [9].
 Так как кумулюсные клетки постоянно реагируют на изменения, происходящие в интрафолликулярной среде с целью обеспечения оптимального развития ооцитов, информацию о состоянии ооцита можно получать посредством обнаружения молекулярно-генетических изменений в кумулюсных клетках. Например, модели экспрессии определенных генов отражают процессы, происходящие в клетке в данный момент времени, в том числе и ответ клеток на различные воздействия окружающей среды. Таким образом, анализ экспрессии генов в кумулюсных клетках может выявить данные об условиях внутри фолликула и качестве полученных ооцитов, определяя их способность к дальнейшему созреванию, успешному оплодотворению и последующему эмбриональному развитию.
Так как кумулюсные клетки постоянно реагируют на изменения, происходящие в интрафолликулярной среде с целью обеспечения оптимального развития ооцитов, информацию о состоянии ооцита можно получать посредством обнаружения молекулярно-генетических изменений в кумулюсных клетках. Например, модели экспрессии определенных генов отражают процессы, происходящие в клетке в данный момент времени, в том числе и ответ клеток на различные воздействия окружающей среды. Таким образом, анализ экспрессии генов в кумулюсных клетках может выявить данные об условиях внутри фолликула и качестве полученных ооцитов, определяя их способность к дальнейшему созреванию, успешному оплодотворению и последующему эмбриональному развитию.
Цель исследования: поиск молекулярно-генетический маркеров для оценки качества ооцитов, эмбрионов с высоким потенциалом к развитию с целью повышения эффективности лечения бесплодия с помощью методов ВРТ.
Материал и методы исследования
На базе отделения вспомогательных технологий в лечении бесплодия и лаборатории молекулярно-генетических методов ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России проведено ретроспективное исследование случай-контроль.
Был исследован уровень экспрессии мРНК 7 генов в кумулюсных клетках методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) в режиме реального времени: гены внеклеточного матрикса (гиалуронан-синтетаза 2 (HAS2), версикан (VCAN), молекула клеточной адгезии активированных лейкоцитов (ALCAM или CD166)), а также гены, регулирующие передачу внутриклеточной информации (простагландин синтетаза 2 (PTGS2), гремлин (GREM1), амфирегулин (AREG), инозитол-трифосфат 3 киназы А (ITPKA)) (реактивы ДНК-Технология, Россия).
Во избежание деградации РНК взятие материала (кумулюсные клетки) осуществляли в пробирки с раствором гуанидинтиоционата (лизирующий раствор наборы «Проба НК»). Осаждение РНК проводили изопропанолом в присутствии соосадителя, с последующими отмывками промывочными растворами. В реакции обратной транскрипции использовали смесь специфических олигонуклеотидов всех исследуемых генов. Амплификацию осуществляли в режиме реального времени с измерением уровня флуоресценции по каналу FAM на каждом цикле при температуре отжига праймеров. Реализация «горячего старта» обеспечивалась использованием Taq-полимеразы, активность которой блокирована антителами и восстанавливается при прогреве. Реакцию ставили в двух повторах для каждой точки. Уровень экспрессии измеряли в относительных единицах (о.е.) относительно референсных генов TBP, B2M, GUSB методом сравнения пороговых циклов (∆Cq) .
В исследование было включено 89 образцов кумулюсных клеток от 39 пациенток, соответствовавших критериям включения (возраст 18–36 лет, женское бесплодие трубного происхождения, мужской фактор бесплодия при отсутствии тяжелой патозооспермии, регулярный менструальный цикл, проведение интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ)). Критериями не включения явились эндокринный фактор бесплодия, эндометриоз III–IV степени распространения, генетические аномалии, пороки развития половых органов и другие. Стимуляция суперовуляции проводилась препаратами гонадотропинов по протоколу с антагонистом гонадотропин рилизинг гормона со 2–3-го дня менструального цикла.
Морфологическая оценка качества эмбрионов была произведена согласно классификации, принятой Istanbul consensus workshop on embryo assessment (ESHRE, 2011) («модифицированная» классификация D. Gardner) [10].

Все эмбрионы разделялись на группы в зависимости от качества эмбрионов, согласно морфологической оценке качества. I группа – эмбрионы хорошего качества (51 образец), II группа – эмбрионы удовлетворительного качества (19 образцов), III группа – эмбрионы неудовлетворительного качества (19 образцов). На 5-е сутки развития осуществляли перенос 1 эмбриона в полость матки.
Исследование было одобрено комитетом по этике ФГБУ НЦАГиП им. В.И. Кулакова МЗ РФ. Статистическая обработка данных выполнена с помощью пакета прикладных программ SPSS Statistics 17.0. Для оценки значимости межгрупповых различий применяли тест Стьюдента для 2 независимых выборок. В случае исследования нескольких независимых выборок использовали непараметрический тест Крускала–Уоллиса, при двух выборках – критерий Манна–Уитни для несвязанных совокупностей. Достоверность различий в частоте встречаемости качественных признаков определяли по критерию. Статистически значимыми считались различия при р<0,05.Отношение шансов (ОШ) приведено с 95% доверительным интервалом.
Результаты
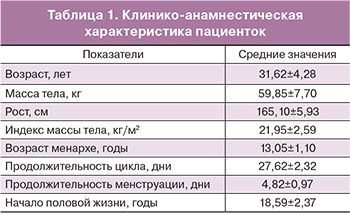
Все женщины, вошедшие в исследование, строго соответствовали критериям включения и не включения. Средний возраст пациенток составил 31,62±4,28 года; средняя масса тела – 59,85±7,70 кг. Клинико-анамнестические данные пациенток представлены в табл. 1.
В ходе проведенного исследования была выявлена взаимосвязь уровня экспрессии мРНК гена СD166 (ALCAM) и показателей качества эмбрионов согласно морфологическим критериям оценки (тест Крускала–Уоллиса, p=0,0271) (табл. 2).
При сравнении эмбрионов хорошего и плохого качества установлена взаимосвязь уровня экспрессии мРНК гена СD166 (ALCAM) и показателей качества эмбрионов согласно морфологическим критериям оценки: наблюдается повышение уровня экспрессии мРНК в кумулюсных клетках эмбрионов хорошего качества в 1,58 раз (тест Манна–Уитни, р=0,008) (табл. 3). Это подтверждает ранее проводимые исследования Аdriaenssens и соавт., показавшие, что снижение уровня экспрессии мРНК гена ALCAM коррелирует с плохим качеством ооцитов [11].
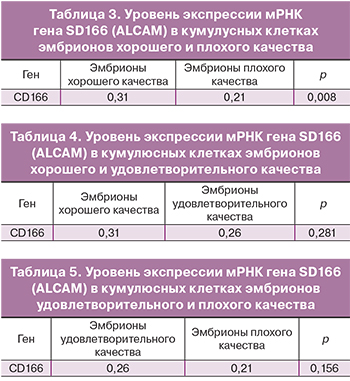 При сравнении эмбрионов хорошего и удовлетворительного качества, а также удовлетворительного и плохого качества, ассоциации с уровнем экспрессии мРНК гена CD166 в ходе нашего исследования выявлено не было (тест Манна–Уитни, р=0,27 и р=0,18 соответственно) (табл. 4 и 5 соответственно).
При сравнении эмбрионов хорошего и удовлетворительного качества, а также удовлетворительного и плохого качества, ассоциации с уровнем экспрессии мРНК гена CD166 в ходе нашего исследования выявлено не было (тест Манна–Уитни, р=0,27 и р=0,18 соответственно) (табл. 4 и 5 соответственно).
В ходе проведенного исследования в I группе осуществляли перенос 25 эмбрионов, при этом клиническая беременность наступила у 9 женщин. Во II и III группах был произведен перенос по 7 эмбрионов, при этом клиническая беременность наступила у 2 женщин во II группе и 3 женщин в III группе. Таким образом, не было выявлено статистически значимых различий между качеством перенесенных эмбрионов согласно морфологическому критерию оценки и показателем наступления клинической беременности (χ2 тест, p=0,856), что можно объяснить небольшой выборкой исследуемых эмбрионов.
Однако в последние годы появляется все больше исследований, демонстрирующих недостатки морфологической оценки эмбрионов и, в связи с этим, необходимость поиска новых критериев, определяющих качество эмбрионов и их потенциал к имплантации [12, 13].
Обсуждение
Доказано, что взаимосвязь между ооцитом и окружающими его фолликулярными клетками является необходимой для нормального функционирования женской репродуктивной системы. Посредством специальных щелевых контактов окружающие ооцит соматические клетки оказывают непосредственное влияние на рост и развитие фолликула, возобновление мейоза, регулируют транскрипционную активность, а также ядерное и цитоплазматическое созревание ооцита за счет активации различных сигнальных путей [14]. Эти сигнальные пути необходимы для производства жизнеспособных гамет, определяют их способность к дальнейшему созреванию, успешному оплодотворению и последующему эмбриональному развитию [15]. В попытке идентифицировать новые методы диагностики качества эмбрионов, которые могли бы использоваться отдельно или совместно с используемой в практике морфологической оценкой, ученые остановили свое внимание на альтернативных малоинвазивных методах исследования, основанных на оценке качества ооцита и/или эмбриона по уровню транскрипционной активности в кумулюсных клетках.
Молекула клеточной адгезии активированных лейкоцитов (ALCAM), также известная как CD 166 (кластер дифференцировки166) – это мембранный белок, участвующий в связывании клеток между собой и внеклеточным матриксом [16]. Данный белок экспрессируется в клетках эндометрия и бластоцистах, а также в кумулюсных и гранулезных клетках в течение овуляции [17]. Известно, что ALCAM участвует в привлечении и миграции лейкоцитов в очаг воспаления и повреждения тканей, способствуя трансэндотелиальной миграции, включающей ряд четко скоординированных взаимодействий между воспаленным эндотелием и активированными лейкоцитами [18]. Считается, что овуляция и имплантация активируют в организме процессы, аналогичные ответу на воспаление и сопровождаются повышением проницаемости маточных сосудов в месте имплантации бластоцисты [19]. Таким образом, следует предположить, что ALCAM принимает участие в процессах овуляции и имплантации.
По данным проведенного нами исследования уровень экспрессии мРНК гена СD166 ассоциирован с качеством эмбрионов согласно морфологическим критериям оценки. При этом взаимосвязь между уровнем экспрессии мРНК гена СD166 и качеством эмбрионов наблюдалась только при сравнении эмбрионов хорошего и плохого качества. При исследовании эмбрионов хорошего и удовлетворительного качества, а также удовлетворительного и плохого качества, ассоциации с уровнем экспрессии CD166 в ходе нашего исследования выявлено не было. При этом не было выявлено статистически значимых различий между качеством перенесенных эмбрионов и показателем наступления клинической беременности. Данные результаты подтверждают ранее проводимые исследования Аdriaenssens и соавт., показавшие, что снижение уровней экспрессии мРНК генов ALCAM коррелирует с плохим качеством ооцитов [11].
Также Wathlet и соавт. продемонстрировал существенную взаимосвязь между уровнем экспрессии мРНК гена ALCAM с морфологическими показателями оценки качества эмбрионов на 3-и и на 5-е сутки развития [20].
Амфирегулин (AREG), относящийся к семейству эпидермального фактора роста, экспрессируется в преовуляторных фолликулах в ответ на выработку ЛГ, необходимого для возобновления мейоза, а также экспансии клеток кумулюса и овуляции [21]. Однако, рецепторы к ЛГ представлены в клетках муральной гранулезы, текальных и кумулюсных клетках, но не в самом ооците [22]. AREG регулирует активацию ЛГ рецепторов, за счет чего и происходит передача ЛГ сигнала в ооцит [23]. По данным проведенных исследований, AREG совместно с ФСГ повышает экспрессию генов, ответственных за формирование внеклеточного матрикса, а также за пролиферацию и миграцию клеток, способствует таким образом экспансии клеток кумулюса, созреванию ооцитов, а также активирует стероидогенез [24, 25].
Ген простагландин-синтетаза-2 (PTGS2) играет важную роль в реализации репродуктивной функции, принимая участие в процессах овуляции, оплодотворения, имплантации и в родах [26]. Экспрессия PTGS2 регулируется ооцит-секретируемым паракринным фактором (GDF9) и наряду с HAS2 принимает участие в передаче внутриклеточной информации и формировании внеклеточного матрикса [20, 27].
По данным исследования Feuerstein и соавт., сфокусировавших свое внимание на оценке генов, экспрессирующихся кумулюсными клетками в ответ на выброс ЛГ, уровень экспрессии мРНК генов AREG и PTGS2 повышался после возобновления мейоза [28].
Таким образом, была выявлена взаимосвязь между повышением уровня экспрессии мРНК генов AREG и PTGS2 и созреванием ооцита [28]. Однако по данным проведенного нами исследования не было выявлено статистически значимых различий между уровнем экспрессии мРНК генов PTGS2 и AREG и качеством развивающихся эмбрионов.
Известно, что HAS2 является главным ферментом, необходимым для синтеза кумулюсными клетками гиалуроновой кислоты, являющейся главным компонентом внеклеточного матрикса, связывающего вместе ооцит и кумулюсные клетки [29]. Гиалуроновая кислота играет важную роль в процессах овуляции, оплодотворения и в эмбриогенезе [29]. HAS2 стимулирует клеточную пролиферацию, индуцирует передачу внутриклеточной информации, а также обладает ангиогенным и иммуностимулирующим действиями [30]. Результаты ранее проведенных исследований продемонстрировали существенную связь между уровнем экспрессии HAS2 в кумулюсных клетках и качеством развивающихся эмбрионов [27, 31].
Ген версикан (VCAN), относящийся к семейству протеогликанов, также является одним из компонентов внеклеточного матрикса [32]. Он вовлечен в процесс клеточной адгезии, а также принимает участие в пролиферации и миграции клеток, ангиогенезе, апоптозе и играет ключевую роль в построении тканей и стабилизации белков внеклеточного матрикса [33].
Ген гремлин (GREM1) - антагонист костного морфологического белка (ВМР), является GDF9-зависимым геном [34]. Считается, что гремлин осуществляет регуляцию функции кумулюсных клеток через ооцит-секретируемые факторы (GDF9 и BMP15) за счет селективного ингибирования костного морфологического белка, но не фактора роста и дифференцировки 9 [34, 35]. Являясь селективным ингибитором BMP15, гремлин предотвращает преждевременную лютеинизацию клеток кумулюса [34].
Инозитол-1,4,5-трифосфат-3-киназа — это ключевой фермент, регулирующий метаболизм инозитол полифосфатов, ответственных за передачу внутриклеточных сигналов. Он активирует ряд процессов, приводящиих к открытию мембранных каналов и высвобождению кальция в цитозоль по градиенту концентрации [36]. Кальций необходим для функционирования клеточных мембран, а также работы ядерного аппарата клетки. В ядре ионы Са2+ участвуют в поддержании структуры хроматина, в митохондриях и хлоропластах они играют важную роль в регуляции активности ферментов.
По данным проведенного нами исследования не было выявлено статистически значимых различий между уровнем экспрессии мРНК генов HAS2, PTGS2, GREM1, VCAN и ITPKA и качеством развивающихся эмбрионов. Однако более ранние исследования Wathlet и соавт. продемонстрировали существенную взаимосвязь генов PTGS2, GREM1 и ITPKA с морфологическими показателями оценки качества эмбрионов на 3-и и на 5-е сутки развития [20].
Также была выявлена ассоциация генов PTGS2 и VCAN с качеством полученных ооцитов: уровень экспрессии мРНК гена PTGS был выше, а VCAN ниже в зрелых ооцитах, находящихся в блоке метафазы второго мейотического деления (MII) [20]. McKenzie и соавт. в своем исследовании показали, что уровень экспрессии мРНК генов PTGS2 и HAS2 был в 6 раз выше, а уровень экспрессии GREM1 в 15 раз выше в кумулюсных клетках ооцитов, развившихся до эмбрионов высокого качества на 3-и сутки по сравнению эмбрионами низкого качества [27]. Последующие исследования подтвердили взаимосвязь экспрессии гена GREM1 и показателями качества эмбрионов на 3 сутки развития [35, 37]. Также более поздние исследования Аdriaenssens и соавт., продемонстрировали, что снижение уровней экспрессии мРНК генов HАS2 и PTGS2, коррелирует с плохим качеством ооцитов [11].
Заключение
Ген ALCAM может являться потенциальным предиктором оценки качества эмбрионов согласно морфологическим критериям оценки. Накопленные на сегодня данные подтверждают перспективность изучения профиля экспрессии генов в кумулюсных клетках для оценки качества ооцитов и эмбрионов. Дальнейшее изучение экспрессии генов в кумулюсных клетках поможет идентифицировать потенциальные биомаркеры для оценки качества ооцитов, эмбрионов и, таким образом, позволит в дальнейшем оптимизировать выбор переносимых эмбрионов и тем самым повысить результативность программ ЭКО в целом.



