В структуре причин перинатальной смертности в России, по данным Росстата, преобладает внутриутробная гипоксия и асфиксия при рождении (51,6%). Среди причин смерти детей первой недели жизни она занимает 3-е место (12,7%) [1]. В соответствии с патоморфологическими исследованиями постгипоксические изменения в организме плода и новорожденного составляют 44,4–56,2%. Несмотря на развитие акушерской помощи, диагностических методов исследования состояния плода, увеличение частоты кесарева сечения, частота постгипоксических поражений у новорожденных не снижается [2].
Самым неблагоприятным осложнением гипоксии плода и асфиксии новорожденного является поражение центральной нервной системы (ЦНС), которое лежит в основе детского церебрального паралича (ДЦП) в 28%. В связи с этим важное значение имеет изыскание оптимальных методов лечения последствий перенесенной асфиксии у новорожденных. Одним из таких методов может стать краниоцеребральная гипотермия (КЦГ). Впервые терапевтическая гипотермия начала широко испытываться на животных в 1950-х гг. Клинические наблюдения описаны в 1980-х гг., но до 1990-х гг. КЦГ широко не применялась в связи с отсутствием аппаратуры и единых протоколов. В России использование данной методики в неонатологии впервые предложено Г.М. Савельевой в 1973 г. Были получены данные об ее эффективности в лечении гипоксически-ишемических поражений ЦНС, однако впоследствии наладить производство необходимой аппаратуры не удалось, что не позволило использовать ее в широкой практике. За рубежом терапевтическая гипотермия для лечения гипоксии применяется с 1999 г. В настоящее время при использовании гипотермии исследователями получены разноречивые данные [3].
По данным результатов канадского мультицентрового рандиомизированного исследования, проведенного в 2003 г., гипотермия не улучшает долгосрочный прогноз, когда применяется как нейропротективная терапия. С учетом заключения исследователей, требуется дальнейшее изучение гипотонии, возникающей в момент согревания после процесса охлаждения [4].
Проведенные в 2007 и 2014 гг. исследования доказали, что как КЦГ, так и тотальная гипотермия всего тела, снижает чистоту ДЦП при асфиксии в родах и смертность на 24% [5, 6]. Однако, по мнению авторов, отдаленные результаты эффективности КЦГ требуют дополнительного изучения.
В ряде исследований (2009) было доказано, что при асфиксии средней тяжести терапевтическая гипотермия более эффективна, чем при тяжелом поражении. При асфиксии средней степени тяжести КЦГ не влияла на артериальное давление и не требовала назначения инфузионной или инотропной терапии [7].
Вышеуказанные рандомизированные исследования не ответили на вопросы, эффективна ли умеренная гипотермия у детей после остановки сердца; какова продолжительность гипотермии, которая не увеличивает количество побочных эффектов; как лучше проводить период согревания [8, 9].
 При проведении терапевтической гипотермии отмечался ряд осложнений (Eicher и соавт.): брадикардия и артериальная гипотония; более длительное использование вазопрессоров; увеличение риска развития судорожного синдрома; удлинение протромбинового времени; снижение уровня тромбоцитов в периферической крови у детей [10].
При проведении терапевтической гипотермии отмечался ряд осложнений (Eicher и соавт.): брадикардия и артериальная гипотония; более длительное использование вазопрессоров; увеличение риска развития судорожного синдрома; удлинение протромбинового времени; снижение уровня тромбоцитов в периферической крови у детей [10].
В США терапевтическая гипотермия в лечении детей с тяжелым поражением ЦНС одобрена в качестве терапии второго ряда при рефрактерной внутричерепной гипертензии [11].
Приведенные данные литературы свидетельствуют о неоднозначности использования КЦГ при асфиксии у новорожденных.
Цель исследования: определение роли КЦГ в комплексной терапии постгипоксических церебральных поражений у детей.
Материал и методы исследования
Обследованы 46 беременных и их детей, родившихся в асфиксии в период с сентября 2009 до мая 2012 г. Степень тяжести асфиксии определялась согласно Международной классификации болезней (МКБ) IX пересмотра (Женева, 1980). Асфиксию средней тяжести (умеренную) определяли при наличии 4–6 баллов по шкале Апгар на 1-й минуте и 8–10 баллов к 5-й; тяжелую асфиксию – 0–3 балла по шкале Апгар на 1-й минуте и менее 7 баллов к 5-й.
У 21 родившегося ребенка была асфиксия средней степени тяжести, у 25 – тяжелая. Анализ состояния детей проведен сразу после рождения и в год жизни в отделении катамнеза Центра планирования семьи и репродукции (ЦПСиР).
Критериями включения в исследование были:
Оценка по шкале Апгар менее 5 баллов на 10-й минуте жизни.
Ацидоз: значение рН крови пуповины менее 7.1; дефицит оснований – 16 ммоль/л и более; лактат 10 ммоль/и более.
Измененное состояние сознания (летаргия, ступор или кома).
Умеренная или резко выраженная патология фоновых биотоков мозга, приступы по данным электроэнцефалографии (aEEG/CFM), проведенной не раньше чем через 30 минут после рождения, в течение не менее 20 минут.
Гестационный возраст 36 и более недель.
Возраст новорожденных менее 6 ч от рождения.
В работе был проведен анализ течения родов и использованы следующие методы исследования: общее клинико-лабораторное обследование матерей и детей; ультразвуковая фетометрия, допплерометрия кровотока в системе мать-плацента-плод; кардиотокография во время родов; бактериологический посев из родовых путей; у детей – анализ газового состава крови, нейросонография, ультразвуковое исследование брюшной полости, рентгенография органов грудной клетки, энцефалография (aEEG/CFM).
Для оценки окраски околоплодных вод, полученных при амниоцентезе, либо после излития вод в родах, мы использовали шкалу, разработанную Е.П. Тищенко (2009) и широко употребляемую в ЦПСиР (табл. 1).
Методы лечения новорожденных соответствовали стандарту оказания реанимационных мероприятий новорожденных в раннем неонатальном периоде, согласно Приказу Министерства здравоохранения и социального развития РФ от 1 июня 2010 г. N 409н «Об утверждении порядка оказания неонатологической медицинской помощи». В дополнение всем детям проводилась КЦГ с использованием аппарата Olympic Cool-Cap. Она начиналась в первые 6 часов жизни. Целевое значение ректальной температуры – 34,5°С. Продолжительность КЦГ составила 72 ч. Согревание проводилось в течение 12 ч. Полный период охлаждения и согревания составил у всех 84 ч.
Результаты исследования
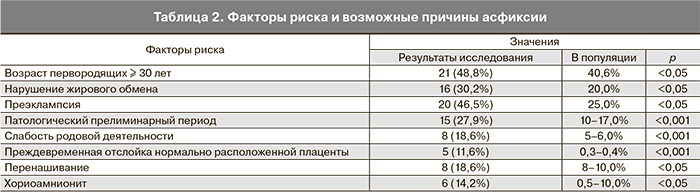
Возраст беременных варьировал от 20 до 39 лет, у половины пациенток он составил более 30 лет. Возраст первородящих колебался от 20 до 37 лет, из них 22 (47,8%) были в возрасте старше 30 лет.
Большинство беременных, родивших детей в асфиксии, были первородящие – 33 (76,7%), из них первобеременные – 28 (84,8%), у 2 в анамнезе был 1 искусственный аборт, у 2 – неразвивающаяся беременность. Среди повторнородящих превалировали вторые роды.
В результате приведенных исследований были выявлены достоверные факторы риска асфиксии (табл. 2).
У большинства пациенток роды были своевременными. Запоздалые роды с рождением детей с признаками перенашивания на 41–42-й неделе гестации отмечались в 1,7 раза чаще, чем в популяции.
У 39 (90,7%) пациенток планировалось ведение родов через естественные родовые пути, из них только у 21 (53,8%) они закончились согласно ранее намеченному плану.
При анализе начала родовой деятельности следует отметить, что частота патологического прелиминарного периода у матерей, родивших детей с явлениями асфиксии, выше в 2–3 раза, чем в популяции.
Из осложнений родов следует отметить слабость родовой деятельности и лихорадящее состояние в родах.
Слабость родовой деятельности с последующей стимуляцией окситоцином в I периоде родов была у 8 (18,6%), что выше, чем в популяции, в 3 раза. Введение окситоцина более 2–3 ч, по данным Е.Н. Кравченко и соавт. (2008) [12], ухудшает перинатальные исходы.
Лихорадящее состояние в родах отмечалось у 6 из 42 (14,2%). Причинами указанного осложнения может быть длительная эпидуральная анестезия (у 2 – более 6 ч) или инфицирование при длительном безводном промежутке (у 2 – более 12 ч). На фоне гипертермии у большинства женщин воды становились мекониальными.
Внутриутробное инфицирование является одной из причин хронической гипоксии и асфиксии новорожденных. При бактериологическом исследовании из шейки матки только у 6 (14,0%) пациенток отсутствовал рост условно-патогенной флоры. Хориоамнионит в процессе родов отмечался у 6 (14,0%). У всех пациенток с хориоамнионитом в послеродовом периоде высеялся стрептококк группы В. У 11 (25,6%) в посеве из цервикального канала выявлена микст-флора. Чаще всего отмечался рост стафилококка и стрептококка группы В.
Следовательно, причинами гипоксии плода и асфиксии новорожденного при рождении через естественные родовые пути следует считать: неподготовленность родовых путей к началу родов – у 14 (32,5%), патологический прелиминарный период – у 12 (27,9%), слабость родовой деятельности – у 8(18,6%), крупный плод – у 8 (18,6%).
Путем операции кесарева сечения в экстренном порядке закончились роды у 24 из 46 (51,2%) пациенток. Показаниями к операции у 4 (18,2%) до развития регулярной родовой деятельности явились: преждевременная отслойка нормально расположенной плаценты, острая гипоксия плода; в I периоде родов у 16 (72,7%): преждевременная отслойка нормально расположенной плаценты, острая гипоксия плода, хроническая гипоксия плода в сочетании со слабостью родовой деятельности; во II периоде родов – у 2 (9,1%): клинический узкий таз, острая гипоксия плода.
Помимо вышеописанных причин асфиксии, у каждой 3-й наблюдалось обвитие пуповины вокруг шеи или туловища, у 2 (4,7%) был обнаружен истинный узел пуповины, у 1 – абсолютная короткость пуповины, у 1 – краевое прикрепление пуповины. В общей сложности патология пуповины была у 18 (41,9%).
При анализе характера околоплодных вод как критерия гипоксии плода, было установлено, что у половины пациенток – 19 (44,2%) воды были светлые на протяжении всех родов. Мекониальные околоплодные воды исходно были у 11 (25,6%): у 8 – густые IIВ и у 3 – зеленые жидкие IIA. У 8 (18,6%) отмечалось изменение околоплодных вод от светлых до мекониальных. При преждевременной отслойке нормально расположенной плаценты воды были окрашены кровью – у 5 (11,6%).
Следовательно, основной причиной асфиксии является патология пуповины (41,9%), хроническая гипоксия плода (25,6%), инфицирование (14,0%), сочетающиеся с нарушениями родовой деятельности. Полученные данные об основных причинах асфиксии совпадают с результатами исследований C.P. Wayock (2014), D.B. Nelson (2014) [13, 14]. Важным фактором является также несвоевременное решение вопроса об экстренном родоразрешении.
Масса рожденных детей варьировала от 2400 до 4400 г. Крупным (более 4000 г) являлся каждый 4-й ребенок (18,6%). У 5 (11,6%) отмечалась задержка роста плода. Соотношение мальчиков и девочек среди рожденных с явлениями асфиксии – 60,5 и 39,5% соответственно, при этом доля мальчиков выше, чем в популяции (53%).
Оценка по шкале Апгар на 1-й минуте жизни составила: 1–2 балла – у 15 детей (30,2%); 3–4 балла – у 21 (48,8%); 5–6 баллов – у 9 (20,9%)
Дети с массой более 4000 г при рождении имели более низкие оценки по шкале Апгар на 1-й минуте жизни вне зависимости от способа родоразрешения.
При анализе газового состава крови у новорожденных отмечались выраженные изменения: значение лактата варьировало от 5,2 до 22 ммоль/л (при норме менее 2,4 ммоль/л): у 20 (46,5%) – от 5,2 до 12 ммоль/л; у 13 (30,2%) – от 12 до 17 ммоль/л; у 10 (23,2%) – от 17 до 22 ммоль/л. В среднем значение pH составило 6,93±0,11 (при норме 7,359±0,001). У большинства детей – 24 (55,8%) значения варьировали от 6,7 до 7,0, у 14 (32,6%) – более 7,0, у 5 (11,6%) – менее 6,7. Наблюдался дефицит оснований от -5 до -26 ммоль/л (при норме -8,55±5,51): у большинства – 26 (60,5%) – от -12 до -19; у 9 (20,9%) – менее -20; у 8 (18,6) – более -12.
При сопоставлении значений лактата, pH, дефицита оснований с оценкой по шкале Апгар достоверной зависимости не выявлено.
Все дети сразу после рождения были переведены на искусственную вентиляцию легких, средняя продолжительность которой составила 5,97±2,1 суток: у 10 (23,2%) – 3–5 суток; у 24 (55,8%) – от 5 до 7 суток; у 9 (20,9%) – более 7 суток. У 26 новорожденных (60,5%) выявлена врожденная пневмония, у 6 (14,0%) – легочное кровотечение на 1-е сутки, купируемое на 2-е сутки жизни.
Всем детям проводилась процедура КЦГ. Следует отметить, что имеет значение время начала КЦГ: если охлаждение начато до 1,5 ч жизни, количество погибших нервных клеток снижается на 70%, от 1,5 до 5,5 ч жизни – на 50%. В нашем исследовании процедура была начата у 18 (41,9%) в течение 1,5 ч жизни; у 14 (32,5%) – от 1,5 до 3 ч жизни; у 11 (25,6%) – от 3 до 5 ч жизни.
В большинстве наблюдений судороги или судорожная готовность сопровождают асфиксию, что может быть ассоциировано с неблагоприятным прогнозом. В нашем исследовании в первые часы жизни у большинства – 39 (90,7%) новорожденных наблюдался судорожный синдром, из них у 14 (32,6%) – генерализованные клинико-тонические судороги, у 10 (23,25) – клонические судороги конечностей. Судороги были купированы у 11 (28,2%) на 3-и сутки; у 14 (35,9%) – на 5-е сутки; у 10 (25,6%) – на 7-е сутки; у 3 (7,7%) – на 9–10-е сутки. У 23 из 39 (59,0%) судорожный синдром развился до процедуры КЦГ. Рецидивы судорог наблюдались у 5 детей (11,6%), у 3 – на 3–5-е сутки жизни, а у 2 – на 8–9-е сутки. У 5 (9,3%) отмечалась повышенная судорожная готовность.
По данным нейросонографии у большинства – 37 новорожденных (86,1%) были умеренные гипоксически-ишемические изменения головного мозга: у 5 (11,6%) – выраженные, из них у 2 – с субкортикальной лейкомаляцией. Только у 1 новорожденного головной мозг был без структурной патологии.
Электроэнцефалография (ЭЭГ) является «золотым стандартом» для оценки тяжести энцефалопатии [15–17]. В нашем исследовании у 10 (23,2%) были выявлены следующие ЭЭГ-детерминанты, характерные для тяжелой формы гипоксического поражения мозга: нулевые линии ЭЭГ, недифференцированная ЭЭГ с депрессией ритма ниже 5 мкВ, моноритмическая дельта-активность в виде высокоамплитудных синхронизированных билатеральных дельта-волн и феномена «вспышка/угнетение». У 33 (76,8%) отмечено усиление пульсации отраженных сигналов, увеличение их амплитуды; смещение срединных структур М-эха на 1,5–2 мм за счет локального отека; патологическая пароксизмальная активность головного мозга. Выявленные изменения характеризуют поражение ЦНС. На фоне КЦГ у всех детей отмечалась нормализация показателей.
При использовании КЦГ потребовалось дополнительное введение препаратов крови, так как охлаждение сопряжено с гипокоагуляцией, что показано и в нашем исследовании. Почти половине новорожденных – 21 (48,8%) вводилось от 1 до 3 доз свежезамороженной плазмы при явлении гипокоагуляции по данным коагулограммы или клинических проявлениях геморрагического синдрома. У 11 (25,6%) применялось комплексное введение свежезамороженной плазмы и эритроцитарной массы. У 2 было проведено частичное заменное переливание крови, показанием к которому послужила анемия тяжелой степени при рождении. Только у 8 (18,6%) дополнительного введения препаратов крови не потребовалось.
Все дети выжили и были переведены на 2-й этап выхаживания в среднем на 9–12-е сутки жизни.
По данным отделения катамнеза к году жизни 23 ребенка (53,5%) на основании данных нейросонографии, осмотра невролога и педиатра неврологически здоровы. У 3 (7,0%) развился ДЦП.
У 5 (11,6%) детей отмечается задержка темпов психологического развития. Следует отметить, что по данным В.Е. Радзинского (2007), A. Johnson (2002), D. Azzopardi (2014) у детей, перенесших тяжелую и умеренную асфиксию, после стандартного лечения частота ДЦП составляет 30% [18–20], что в 2–2,5 раза выше, чем в нашем исследовании.
При сопоставлении состояния детей с осложнениями в раннем неонатальном периоде выявлено, что неблагоприятными факторами развития патологии (в частности, ДЦП) у детей, родившихся в асфиксии, являются: оценка по шкале Апгар на 1-й минуте жизни менее 3 баллов (p<0,05), продолжительность искусственной вентиляции легких более 7 суток (p<0,05), выраженные изменения ЦНС по данным нейросонографии (p<0,05) и ЭЭГ (p<0,05). Важную роль в развитии энцефалопатии играет внутриутробное инфицирование. В нашем исследовании также отмечается достоверная связь между лихорадящим состоянием в родах, внутриутробным инфицированием, аспирационной пневмонией и поражением ЦНС (p<0,05).
Заключение
Таким образом, проведенные исследования показали, что асфиксия новорожденных остается одной из причин не только перинатальной смертности, но и инвалидизации детей с развитием ДЦП, в связи с чем необходима разработка методов, способствующих восстановлению структурных и функциональных свойств ЦНС. К таким методам следует отнести КЦГ. Ее применение способствует повышению числа здоровых детей и снижению частоты ДЦП в 2–2,5 раза по сравнению со стандартной терапией.



