В 1988 г., независимо друг от друга, несколькими группами исследователей был клонирован ген человеческого андрогенного рецептора [1]. Он локализуется на длинном плече Х-хромосомы (рис. 1). Ген андрогенного рецептора имеет 8 экзонов, а андрогенный рецептор состоит из 4 основных структурных доменов [2]. Экзон 1 кодирует N-концевой домен белка, экзоны 2 и 3 – центральный ДНК-связывающий домен, а экзоны 4–8 – карбоксильный конец домена. N-концевой домен андрогенного рецептора является наиболее вариабельным по длине и последовательности [3]. Некоторые исследователи полагают, что N-концевой домен андрогенного рецептора при взаимодействии с определенными белками выступает в роли «якоря» для удержания рецептора в ядре клетки-мишени [4]. В отличие от N-концевого домена, карбоксильный конец (лиганд-связывающий домен) молекулы андрогенного рецептора очень стабилен, так как замена даже одной аминокислоты может приводить к значительному снижению функциональной активности андрогенного рецептора. Клинически это характеризуется частичной или полной андрогенной нечувствительностью, что очень важно при изучении различных форм бесплодия неясного генеза и могло бы приоткрыть завесу при резистентности яичников в циклах ЭКО [5].
ДНК-связывающий домен состоит из двух «цинковых пальцев», которые распознают специфические последовательности ДНК. Было обнаружено, что мутации в этом домене приводят к синдрому андрогенной недостаточности [6]. ДНК-связывающий домен связан шарнирной областью с лиганд-связывающим доменом, который, в свою очередь, кодируется экзоном 4.
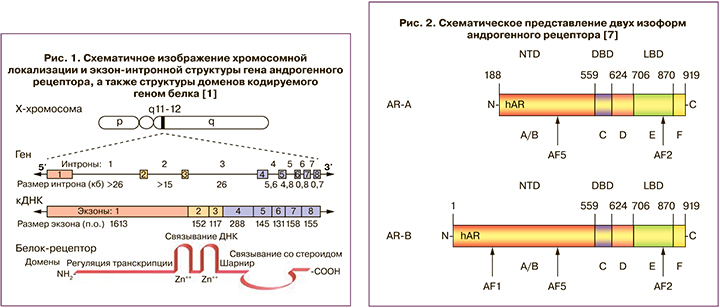
Ute Liegibel впервые обнаружил на фибробластах кожи половых органов человека 2 различные изоформы андрогенного рецептора – андрогенный рецептор-A и андрогенный рецептор-B. Эти изоформы по своей структуре отличаются только по концевому домену: андрогенный рецептор-A имеет укороченный N-концевой домен по сравнению с изоформой андрогенного рецептора-B (рис. 2). Обе изоформы активно экспрессируются в различных тканях как зародыша, так и взрослого человека (мужчин и женщин), однако наибольшая их экспрессия наблюдается в органах репродуктивной системы. Необходимо отметить, что соотношение андрогенный рецептор-B/андрогенный рецептор-A варьирует в разных тканях и на разных стадиях эмбриогенеза [7]. Так, в теменной кости плода количество андрогенного рецептора-B относительно низкое, в то время как экспрессия андрогенного рецептора-A не обнаружена, а на остеобластах человека обнаружены обе изоформы. Однако механизм действия, отличия и роль этих изоформ в различных сигнальных путях до конца не изучены.
После проникновения андрогенов в клетки-мишени при помощи фермента 5α-редуктазы тестостерон (Т) превращается в дигидротестостерон (ДГТ) [8]. Далее происходит связывание андрогенов с определенным сегментом молекулы андрогенного рецептора, находящегося в цитоплазме в составе мультибелкового комплекса, после чего происходят диссоциация андрогенного рецептора из мультибелкового комплекса, гомодимеризация и демаскировка определенных участков рецептора, в результате комплекс рецептор-андроген приобретает более компактную и стабильную форму. Этот каскад последовательных физико-химических преобразований принято называть «активизацией андрогенного рецептора» [9]. Последующий транспорт активированной формы андрогенного рецептора в ядро и его связывание с определенными участками ДНК приводят к изменению экспрессии генов и синтезу специфических белков [10, 11].
Предложенная схема механизма действия андрогенов актуальна, но в последнее время стали более детально изучаться молекулярные основы андрогенного сигнала и его преобразование в клетке. Тем не менее исследователи не смогли достичь консенсуса в вопросе о локализации андрогенных рецепторов: либо он находится в цитоплазме клетки-мишени, откуда перемещается в ядро после связывания с андрогенами, либо стабильно присутствует в ядре, куда транспортируется андроген для активации мультибелкового комплекса.
В исследованиях Roy A.K. et al. на ряде культур клеток было показано перемещение андрогенных рецепторов из цитоплазмы в ядро и из ядра в цитоплазму 4 раза. Возможно, такие перемещения многократны при действии гормонального сигнала in vivo, что имеет большой биологический смысл. В этом процессе участвуют белки теплового шока – шапероны, которые ответственны за стабилизацию конформации андрогенного рецептора и в комплексе с ним препятствуют активации рецептора в отсутствие лиганда. Можно предположить, что это необходимо для непрерывного поддержания открытой функциональной активности андрогенных рецепторов в фолликулогенезе в течение всего репродуктивного периода, и это свойство является генетически детерминированным компенсаторно-приспособительным механизмом в зависимости от возраста женщины. Основным фактором прерывания андрогенного сигнала является инактивация лиганда и его распад из комплекса с андрогенными рецепторами. Этот механизм присущ только андрогенным рецепторам [12].
В настоящее время нет сомнений, что для инициации биологического ответа необходимо наличие комплекса различных регуляторных белков, среди которых есть как активаторы, так и ингибиторы. Исследования in vitro показали, что андрогенные рецепторы могут активироваться при помощи таких факторов, как FGF (фактор роста фибробластов), EGF (эпителиальный фактор роста) [13], однако специфическое воздействие регуляторных белков на андрогенные рецепторы происходит в конкретной среде и в определенных условиях. In vivo эти же модуляторы, возможно, не обладают такими свойствами по отношению к андрогенным рецепторам. Детальное изучение действия модуляторов и их особенностей в последующем помогло бы специалистам открыть завесу для достижения репродуктивных успехов благодаря специфической персонализации протоколов стимуляции.
Известно, что, в отличие от других стероидных гормонов, непосредственно с андрогенным рецептором в физиологических концентрациях связываются только Т и ДГТ, в то время как другие андрогены выступают в роли предшественников этих гормонов [14]; однако сродство ДГТ в несколько раз выше по сравнению с другими андрогенами [15].
Вероятнее всего, относительно низкое сродство Т с андрогенным рецептором по сравнению с ДГТ связано с нестабильной конформацией комплекса андрогенный рецептор-Т, так как его диссоциация происходит стремительнее по сравнению с комплексом андрогенный рецептор-ДГТ. Исходя из вышеизложенного, Т играет роль как гормона-эффектора, так и прегормона. Это уникальное свойство, которое отличает андрогены и их рецепторы от остальных стероидных гормонов, поступающих в клетки-мишени в виде готовых активных молекул.
Для исследования влияния андрогенного рецептора была создана модель мышей с выключенным геном андрогенного рецептора (мыши ARKO). В настоящее время созданы 3 модели самок мышей ARKO: с делецией экзона 1 (ARKO Ex1), экзона 2 (ARKO Ex2) и экзона 3 (ARKO Ex3). Walters K.A. в исследовании на мышах ARKO доказал роль андрогенного рецептора в репродуктивной функции у женщин. Наблюдаемое снижение частоты овуляции у таких мышей указывает на нарушения поздней стадии развития ооцитов/фолликулов, развитие меньшего количества преовуляторных фолликулов и снижение уровней эстрадиола и лютеинизирующего гормона [16]. Таким образом, функции андрогенного рецептора не ограничиваются связыванием со специфическими участками ДНК в ядре.
Экспрессия андрогенного рецептора обнаружена в 3 видах клеток яичника: ооцитах, тека-клетках, клетках гранулезы мелких растущих фолликулов, преантральной и ранней антральной стадий, где Т конвертируется в эстрогены. Андрогены моделируют клеточные процессы путем взаимодействия с андрогенными рецепторами: контролируют рост, дифференцировку, пролиферацию и апоптоз клеток-мишеней не только у мужчин, но и у женщин. Один из ярких представителей андрогенов – андростендион (А), который является дирижером фолликулогенеза в яичниках. По мере созревания фолликула и приближения к преовуляторной стадии количество рецепторов снижается.
Основными циркулирующими андрогенами в организме женщины являются: дегидроэпиандростерон (ДГЭА), ДГЭА-сульфат (ДГЭАС), А, Т и ДГТ [17]. В настоящее время хорошо известно, что исходным соединением для биосинтеза андрогенов считается холестерин, который при помощи цитохрома P450 преобразуется в прегненолон. Последующее превращение прегненолона обеспечивает образование 17α-гидроксипрегненолона, являющегося непосредственным предшественником ДГЭА. Под действием сульфотрансферазы, представленной в стероид-секретирующих железах, печени и, в меньшей степени, в мышечной ткани и центральной нервной системе, ДГЭА сульфатируется до нейростероида ДГЭАС. Обратное превращение ДГЭАС в ДГЭА обеспечивает фермент стероидсульфатаза. Под действием фермента P450 ДГЭА метаболизируется в А, который и является непосредственным предшественником Т и может быть ароматизирован в эстрадиол или под действием 5α-редуктазы – в ДГТ [18]. Основным источником синтеза ДГЭА и ДГЭАС в организме человека являются надпочечники, и лишь 8–10% гормонов синтезируется гонадами [19].
В отличие от других андрогенов, ДГЭА не имеет собственного транспортного белка, его большая фракция связана с альбумином и меньшая часть циркулирует в связанном с глобулином состоянии. Биологически активна как свободная фракция ДГЭА, так и связанная с альбумином. Такая же закономерность характерна для Т [20].
Исследования Davison et al. показывают постепенное снижение уровней циркулирующего Т, ДГЭА и А в крови у женщин в возрасте от 20 до 45 лет. При дефиците андрогенов формируется снижение чувствительности яичников к фолликулостимулирующему гормону (ФСГ), как к эндогенному, так и к экзогенному, при стимуляции овуляции, что реализуется в «бедном» ответе на применение больших доз гонадотропинов и при длительном моногенном воздействии высоких уровней ФСГ [21]. Гипоандрогения наблюдается у женщин со сниженным овариальным резервом, первичной и преждевременной недостаточностью яичников [22].
Работы последних 10 лет особенно сфокусированы на применении ДГЭА и Т у женщин с «бедным» ответом [23]. По данным Barad D.H. et al., в последние годы около 30% всех репродуктивных центров применяют ДГЭА в качестве предварительной терапии у женщин с «бедным» ответом. При этом наблюдалось увеличение количества ооцитов, эмбрионов и, как следствие, увеличение частоты наступления клинических беременностей. Эти данные подтверждают положительное влияние андрогенов на репродуктивную функцию [24].
Заключение
Таким образом, на основании вышеперечисленных фактов детали механизма действия андрогенных рецепторов можно считать действительно уникальными. Эта уникальность обусловлена наличием в организме 2 андрогенов, выступающих в роли эффекторов андрогенного рецептора, – Т и ДГТ. Наличие в организме 2 активных лигандов необходимо для поддержания баланса половых стероидов в клетках с разным распределением и концентрацией андрогенных рецепторов. Вопрос о специфичности действия андрогенов в женском организме остается открытым. На данный момент остается много неясного также в роли регуляторных белков и шаперонов в инициации активизации или ингибирования биологического ответа. Ясно одно: они однозначно являются обязательными участниками в процессах активизации андрогенного рецептора и ответа клетки-мишени на этот сигнал. Их роль еще предстоит изучить, вероятно, это позволит выявить новые маркеры для диагностики и коррекции гипоандрогении и гипоандрогенных состояний.
У женщин с «бедным» ответом и гипоандрогенией формируется дефицит андрогенных рецепторов из-за измененного синтеза андрогенов, низкой концентрации и, соответственно, функциональной активности на клеточном уровне. В связи с чем с позиции физиологической эффективности клетки именно в случае андрогенов, их рецепторов и механизма взаимосвязи, вероятно, имеет смысл задуматься о применении вспомогательной комбинированной гормональной терапии в рамках коррекции дефицита андрогенов у женщин с гипоандрогенией и «бедным» ответом. Это обусловлено необходимостью поддержания функциональной активности рецепторов не только для достижения репродуктивных успехов у молодых женщин, но и для повышения качества жизни в постменопаузальном периоде.



