Специалисты относят бесплодие неясного генеза (БНГ) к так называемым диагнозам исключения, потому что в процессе обследования супружеской пары причины бесплодия не устанавливаются [1–3].
По данным разных источников, частота БНГ значительно варьирует и составляет от 10 до 30% в структуре бесплодного брака, от 10 до 17% – в структуре женского бесплодия [4–6].
Специалисты по-разному оценивают состояние овариального резерва у женщин из супружеских пар с БНГ: некоторые указывают на снижение основных показателей резерва по сравнению с пациентками аналогичного возраста, имеющими трубно-перитонеальный фактор бесплодия (ТПБ), другие – на отсутствие таких различий [7–9].
Разногласия в определении термина «бесплодие неясного генеза» могут быть отчасти обусловлены поздним обращением пациентов в клиники экстракорпорального оплодотворения (ЭКО), длительной выжидательной тактикой и длительным эмпирическим лечением, которые используются из-за отсутствия явных причин бесплодия [10, 11]. В то же время достоверно известно, что основным лимитирующим фактором эффективности программ ЭКО является возраст женщины [1, 7].
Отсутствие явных нарушений анатомии и физиологии репродуктивной системы у партнеров, состоящих в бесплодном браке, подвигло исследователей обратиться к анализу эмбриологических характеристик программ ЭКО у пациентов с БНГ. Однако скрупулезных работ, представляющих объективную информацию о качестве ооцитов, их способности к оплодотворению, особенностях эмбриогенеза у пациентов с диагнозом БНГ, практически нет, что определило необходимость проведения настоящего исследования.
Цель исследования: провести анализ эмбриологического этапа программ ЭКО у пациентов с БНГ в сравнении с пациентами, имеющими ТПБ.
Материалы и методы
Собрана и проанализирована информация об эмбриологическом этапе программ ЭКО у пациентов с БНГ (группа исследования) – 80 женщин, которым было проведено 113 программ ЭКО, и пациентов с ТПБ (группа контроля) – 30 пациенток, которым была проведена 41 программа ЭКО в отделениях Института репродуктивной медицины ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации («НМИЦ АГП им. В.И. Кулакова» МЗ РФ) с 2019 по 2021 гг. Сравниваемые группы пациентов были качественно и количественно репрезентативны соответствующим генеральным совокупностям, сопоставимы между собой по возрасту пациенток (до 35 лет на момент установления диагноза бесплодия; средний возраст: БНГ – 31,69 года и ТПБ – 32,46 года), продолжительности бесплодия (не менее 3 лет), состоянию овариального резерва (средние уровни антимюллерова гормона: БНГ – 2,44 нг/мл и ТПБ – 2,34 нг/мл), протоколам стимуляции яичников (протокол с антагонистом гонадотропин-рилизинг-гормона: БНГ – 98,05% и ТПБ – 97,09%; протокол с агонистом гонадотропин-рилизинг-гормона: БНГ – 1,95% и ТПБ – 2,91%), количеству программ ЭКО на женщину (БНГ – 1,41 и ТПБ – 1,37) [9].
Критериями исключения были: возраст старше 35 лет; наличие очевидных причин бесплодия (отсутствие маточных труб, яичников, синдром Рокитанского–Кюстнера, синдром Шерешевского–Тернера, азооспермия, олигоастенотератозооспермия 3–4 степени); наличие хромосомной патологии; наследственные синдромы, врожденные аномалии, в том числе матки; преждевременная недостаточность яичников; эндокринно-метаболический синдром, синдром поликистозных яичников, ановуляция, гипогонадотропный гипогонадизм; онкологические заболевания, атипичная гиперплазия эндометрия; эндометриоидная киста, аспространенный эндометриоз, множественная миома матки, хронический эндометрит; ВИЧ, вирусные гепатиты; наличие социальных причин (отсутствие полового партнера, сохранение репродуктивного материала перед лечением онкологического заболевания и т.д.).
В Научно-клиническом отделении ВРТ им.Ф. Паулсена ФГБУ «НМИЦ АГП им. В.И. Кулакова» МЗ РФ на основании клинических рекомендаций проводились обследование и лечение пациентов [12]. Работа врачей-эмбриологов, условия в лаборатории ЭКО были одинаковыми и отработанными на протяжении более 5 лет. Интрацитоплазматическая инъекция сперматозоида в ооцит (ИКСИ) проводилось по показаниям: отсутствие или низкая частота (<20%) оплодотворения в предыдущей попытке ЭКО, множество попыток ЭКО в анамнезе [13]. Культивирование проводилось с использованием одношаговой культуральной среды в условиях пониженной концентрации кислорода (5% O2, 6% CO2, 89% N2). В матку переносили не более двух эмбрионов [12]. Среднее количество перенесенных эмбрионов в группе БНГ составило 1,0 эмбрион на женщину, в группе ТПБ – 1,2 эмбриона на женщину.
Морфологическая оценка качества бластоцист производилась по классификации Гарднера, которая, согласно Стамбульскому (2011) и Венскому (2017) консенсусам, в настоящее время является основным эмбриологическим критерием качества эмбрионов, так как обладает наибольшей прогностической значимостью [14–17]. Оценка бластоцист базируется на анализе клеток трофэктодермы, внутренней клеточной массы и размера полости. При оценке степени экспансии бластоцисты или формирования полости бластоцисты используется шкала от 1 до 6. Для оценки клеток внутренней клеточной массы и клеток трофэктодермы используются буквенные обозначения А, В, С. Данная система оценки подразумевает однозначное разделение бластоцисты на трофэктодерму и внутреннюю клеточную массу и их независимую оценку, которые невозможны для стадии 1 и могут быть затруднительны для стадии 2.
Статистический анализ
Статистическая обработка данных проводилась с использованием: абсолютных величин, относительных величин, средних величин, критериев разнообразия вариационного ряда, метода стандартизации, параметрических методов оценки достоверности результатов исследования: определения ошибки репрезентативности, оценки статистической значимости разности результатов исследования (критерий t), определения доверительных границ средних и относительных величин [18]. Для сравнения количественных переменных использовался t-критерий Стьюдента с определением критического уровня по таблице критических значений t-критерия Стьюдента. Различия считались статистически значимыми при p<0,05.
Результаты
Проведены анализ средних значений, групповой анализ и индивидуальный анализ эмбриологических данных программ ЭКО у пациентов с БНГ и ТПБ.
Согласно полученным средним значениям, группы статистически значимо не различались по среднему количеству полученных зрелых ооцитов (см. таблицу). Несмотря на то что ИКСИ в качестве метода оплодотворения использовалась в группе БНГ статистически значимо чаще (80,3%) по сравнению с ТПБ (58,3%) группы статистически значимо не различались по среднему проценту оплодотворения (таблица). Наиболее важным является то, что средний процент бластуляции в программах ЭКО был статистически значимо ниже в группе БНГ (таблица).
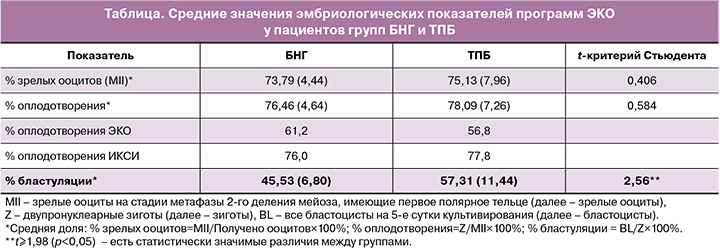
Снижение частоты бластуляции в группе БНГ происходило преимущественно за счет остановок развития эмбрионов до 3-х суток культивирования включительно (% остановок до 3-х суток=100%-% дробления, где % дробления=количество E3/Z ×100%, E3 – эмбрион 3-х суток культивирования), которые происходили в 13,8% (ТПБ – 9%).
Частота остановок развития эмбрионов от 3 до 5-х суток культивирования (% остановок от 3 до 5-х суток=количество остановившихся E4–5/количество E3×100%, E4–5 – эмбрионы 4–5-х суток культивирования) не различалась между группами БНГ (44,7%) и ТПБ (44,3%), что подтверждает снижение бластуляции при БНГ за счет остановок развития эмбрионов до 3-х суток культивирования включительно.
При более низкой частоте бластуляции в группе БНГ частота развития бластоцист из эмбрионов 3-х суток культивирования (% бластоцист=BL/количество E3×100%) не различалась между группами БНГ (55,3%) и ТПБ (55,7%), что также подтверждает остановку развития эмбрионов до 3-х суток культивирования включительно при БНГ.
В группе БНГ (66,7%) отмечалось более высокое качество бластоцист (хорошие бластоцисты: >3, AA, AB, BA; % хороших BL=количество хороших BL/BL×100%) при сравнении с ТПБ (45,8%) и больше программ ЭКО с получением хороших бластоцист при сравнении с ТПБ (65,5 и 43,9% соответственно).
При БНГ значительно реже переносили эмбрионы до 3-х суток культивирования включительно по сравнению с ТПБ (23,75% [на 1-е сутки – 8,75%, на 3-и сутки – 15%) и 30,6% (на 1-е сутки – 5,6%, на 3-и сутки – 25%) соответственно] и значительно чаще переносили бластоцисты по сравнению с ТПБ [68,75% (на 5-е сутки – 68,75%) и 58,3% (на 5-е сутки – 58,3%) соответственно], что может косвенно отражать тенденцию развития эмбрионов при БНГ: после преодоления 3-х суток эмбрионы с нормальной частотой развиваются в бластоцисты, причем часто хорошего качества.
Преимплантационное генетическое тестирование на анеуплоидии (ПГТ-А) при БНГ (62,7%) проводилось в более чем половине случаев и чаще, чем при ТПБ (14,3%), что закономерно при неустановленной этиологии бесплодия и безуспешных попытках забеременеть самостоятельно и с использованием методов вспомогательных репродуктивных технологий. Однако, по данным ПГТ-А, частота выявления эуплоидных эмбрионов не различалась между группами БНГ (41,7%) и ТПБ (40%), то есть анеуплоидия эмбрионов не является фактором, обуславливающим развитие БНГ.
В группе БНГ (57,5%) отмечалось больше программ ЭКО с отменой переноса эмбрионов, чем в группе ТПБ (34,1%), в основном из-за назначения ПГТ-А (47,7%).
Несмотря на то что в группе БНГ (68,1%) отмечалось значительно больше программ ЭКО с криоконсервацией эмбрионов, чем в группе ТПБ (53,7%), не было обнаружено различий в количестве криоконсервированных эмбрионов на программу ЭКО (БНГ – 3,66 и ТПБ – 3,36) и доле криоконсервированных бластоцист (% криоBL=криоBL/BL; БНГ – 70% и ТПБ – 66,4%) между двумя группами.
Интегральный показатель используемости бластоцист (Utilization rate=(перенесенные BL+криоBL)/Z×100%) при БНГ (40%) был ниже, чем при ТПБ (44%), что является отражением сниженной бластуляции в группе БНГ при прочих равных условиях [17].
Обсуждение
Сниженная частота бластуляции и большая частота остановок развития эмбрионов до 3-х суток культивирования в программах ЭКО свидетельствуют о нарушении ранних этапов эмбриогенеза и отражают закономерность этого процесса при БНГ. Это можно расценивать как возможную причину инфертильности при БНГ, и, следовательно, дополнительные методы исследования, часто назначаемые супружеским парам, и длительное эмпирическое лечение не очень оправданы. Как было показано ранее, в группе БНГ статистически значимо больше средняя продолжительность половой жизни без предохранения с целью наступления беременности – 5,65 года, чем в группе ТБП – 4,75 года [9].
Считается, что активация эмбрионального генома (embryonic genome activation, EGA) начинается во время 4-клеточной стадии, поэтому остановка развития эмбриона на стадии дробления, то есть на 1–3-и сутки, вероятно, обусловлена ооцитарным фактором, а нарушение его развития между стадиями компактизации морулы и формирования бластоцисты, то есть на 4–6-е сутки, – с геномом эмбриона [19].
Нормальная частота оплодотворения, сниженная частота бластуляции за счет большей частоты остановок развития эмбрионов до 3-х суток культивирования и в то же время более высокое качество получаемых бластоцист объясняют патогенез БНГ: зачатие у этих супружеских пар происходит с нормальной частотой, эмбрионы чаще останавливаются в развитии до 3-х суток, бластоцисты образуются реже, но часто они хорошего качества, поэтому беременность может наступать, но время до ее достижения увеличивается; при этом возраст и увеличивающаяся с возрастом коморбидность пациентов с БНГ приводят к дополнительному ограничению реализации их репродуктивной функции. ЭКО сокращает время до получения бластоцисты хорошего качества и, соответственно, наступления беременности, то есть является методом патогенетического лечения БНГ. Вышеизложенное является обоснованием целесообразности раннего проведения ЭКО с переносом эмбриона хорошего качества (>3, AA, AB, BA) на 5-е сутки культивирования пациентам с БНГ.
Отсутствие различий между группами БНГ и ТПБ в частоте выявления эуплоидных эмбрионов при ПГТ-А свидетельствует о нецелесообразности рутинного проведения ПГТ-А при БНГ. Это увеличивает время до переноса эмбриона и, соответственно, достижения беременности. Кроме того, биопсия трофэктодермы может приводить к снижению частоты имплантации из-за возможного влияния инвазивного вмешательства на правильное формирование и функционирование плаценты [20, 21].
Заключение
В настоящей работе представлены данные о сниженной частоте бластуляции в программах ЭКО у пациентов с БНГ. Углубленный анализ эмбриологического этапа программ ЭКО показал, что снижение частоты бластуляции при БНГ происходит преимущественно за счет остановок развития эмбрионов до 3-х суток культивирования. В то же время в группе БНГ отмечается более высокое качество бластоцист на основании их морфологической оценки по сравнению с группой ТПБ при одинаковой частоте выявления эуплоидных эмбрионов по данным ПГТ-А.
Полученные данные свидетельствуют о нецелесообразности назначения дополнительного, расширенного диагностического обследования и эмпирического лечения супружеским парам с БНГ и необходимости раннего проведения ЭКО с переносом эмбриона хорошего качества (>3, AA, AB, BA) на 5-е сутки культивирования и диктуют необходимость дальнейшего научного поиска молекулярных механизмов, обуславливающих нарушение ранних этапов эмбриогенеза у пациентов с БНГ.



