Во время беременности на рост и развитие плода влияют множество факторов. Помимо таких общепопуляционных рисков, как стресс, вредные привычки, экологические факторы, соматическая патология матери непосредственное негативное воздействие на процесс роста и развития плода оказывают лекарственные препараты, принимаемые беременными женщинами. Особый интерес в последнее время проявляется к изучению влияния на состояние беременной и ее плода химиотерапевтических препаратов. Это обусловлено тем, что число женщин, у которых онкологические заболевания диагностируются во время беременности, с каждым годом увеличивается [1, 2]. Среди онкологических заболеваний во время беременности лидирующую позицию занимает рак молочной железы (РМЖ) – 39%, второе место приходится на рак шейки матки (РШМ) – 13%, далее – лимфомы – 10% и опухоли яичников – 7% [1, 2].
До недавнего времени пациенткам с онкологическими заболеваниями было рекомендовано немедленное прерывание беременности. В последние годы тактика ведения беременности женщин со злокачественными заболеваниями была пересмотрена. В настоящее время считается, что при адекватном выборе тактики противоопухолевого лечения можно сохранить беременность, не ухудшая прогноз онкологического заболевания [1, 3].
Однако степень тератогенного воздействия химиопрепаратов на развитие ребенка детально не исследована.
По нашему опыту лидирующие позиции в онкологической заболеваемости у беременных занимают РМЖ и лимфомы. Цель данного исследования – изучить и проанализировать состояние здоровья детей у матерей с лимфомами и РМЖ, получавших химиотерапию (ХТ) во время беременности.
Материалы и методы
Нами был проведен анализ медицинской документации 160 детей, рожденных у матерей с диагностированными во время беременности лимфомами (лимфома Ходжкина и неходжкинские лимфомы) и РМЖ. Анализ состояния здоровья детей проводили в два этапа.
На первом этапе для оценки влияния ХТ на здоровье новорожденных были выделены 3 группы: 1А подгруппу составили 108 детей (в том числе две двойни), матери которых получали противоопухолевое лечение во время беременности (по схемам: AC, ЕС, FAC, таксаны, VACOP-B, ABVD, BEACOPP-14, COPP CHOP, EPOCH/DA-EPOCH, ритуксимаб); 1Б подгруппу –52 ребенка (из них три двойни), матери которых не получали лечение во время беременности и во 2-ю (контрольную) группу были включены 63 ребенка, рожденных у соматически здоровых матерей с неотягощенным акушерско-гинекологическим анамнезом. Кроме того, мы сформировали 2-ю группу так, чтобы количество недоношенных детей в ней по частоте было сопоставимо с количеством недоношенных детей в 1А и 1Б группах. Это было необходимо для того, чтобы иметь возможность сравнить состояние здоровья детей (как доношенных, так и недоношенных) в основной и контрольной группах.
Во всех группах оценивали состояние детей по шкале Апгар на 1-й и 5-й минутах, проводили анализ массо-ростовых показателей, структуры заболеваемости детей при рождении, врожденных пороков развития, длительности пребывания в отделении реанимации и интенсивной терапии новорожденных (ОРИТН). Кроме того, проанализированы показатели клинического анализа крови (эритроциты, гемоглобин, тромбоциты, лейкоциты, нейтрофилы).
На втором этапе с целью изучения отдаленных последствий ХТ на здоровье детей, родившихся у пациенток с онкологическими заболеваниями, было проведено анкетирование матерей. Дети были в возрасте от 1 года до 15 лет. Оценивали их состояние здоровья на 1-м году жизни и на момент опроса. При этом у недоношенных детей параметры оценивали с учетом их постконцептуального возраста. Основными пунктами анкеты (табл. 1.) были: перенесенные и хронические заболевания, наличие профилактических прививок, оценка физического и психического развития ребенка, успеваемость в школе, использование антибактериальной и иммунотерапии, данные эхокардиографии (ЭКГ) и клинико-лабораторных исследований, оценка здоровья детей специалистами (педиатр, невролог, стоматолог, окулист, хирург, ортопед). Был прослежен катамнез 71 ребенка из 1А и 29 детей из 1Б подгрупп.
Статистическую обработку данных выполняли при помощи программного пакета «IBM SPSS Statistics 21». Количественные данные представлены в виде средних значений со стандартным отклонением М (SD). Для сравнения этих показателей в 1А, 1Б подгруппах и во 2-й группе применяли метод ANOVA (при нормальном виде распределения данных). Качественные показатели представлены в абсолютных и относительных величинах. Для их сравнения в группах использовались χ2-тест и точный тест Фишера. Различия считали статистически значимыми при p<0,05.
Результаты
В нашем исследовании в 67,7% случаев злокачественное заболевание у матерей было диагностировано во II триместре беременности, в 19,4% – в I и лишь в 12,9% – в III. На момент выявления злокачественного заболевания средний возраст пациенток составил 31,8 (5,7) года, при этом каждая вторая (51% от общего числа беременных) пациентка была первородящей, у каждой третей (33,5%) женщины был только один ребенок. Следует отметить, что все пациентки, вне зависимости от типа и стадии заболеваний, были мотивированы на пролонгирование беременности и рождение ребенка. В общей сложности проведено 435 курсов ХТ 106 беременным женщинам. Основным осложнением при проведении ХТ во время беременности была анемия различной степени тяжести (p<0,05).
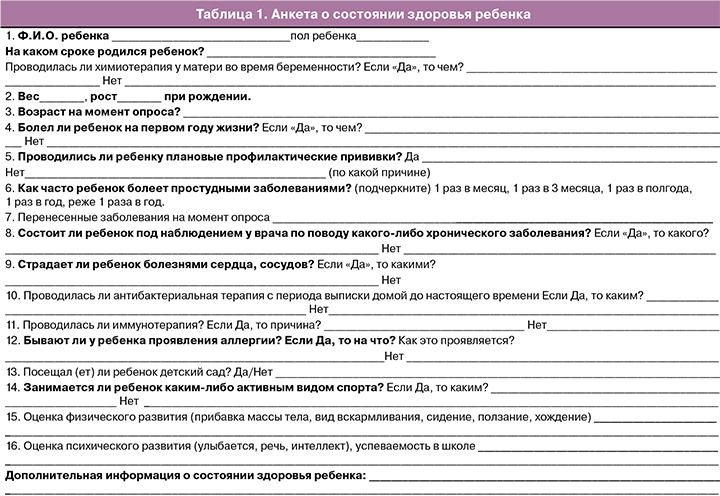
Состояние здоровья новорожденных в группах наблюдения представлено в табл. 2. Оценка по шкале Апгар на 1-й и 5-й минутах во всех трех группах статистически значимо не различалась. Частота рождения детей в состоянии асфиксии различной степени тяжести также не различалась в группах исследования (p=0,19). Частота рождения недоношенных детей в подгруппе 1A составила 44,4%, в 1Б – 59,6% (p=0,07). В группах исследования распределение преждевременно родившихся детей по степени недоношенности статистически значимо не различалось. Высокий процент недоношенных детей в 1A и 1Б подгруппах был обусловлен активностью заболевания матери и, как следствие, необходимостью в кратчайшие сроки начать/продолжить противоопухолевое лечение. Во 2-й группе дети рождались преждевременно в связи со спонтанным развитием регулярной родовой деятельности и/или преждевременным излитием околоплодных вод. Досрочное родоразрешение привело к увеличению числа случаев абдоминального родоразрешения (кесарево сечение – КС). Путем операции КС дети в 1Б подгруппе рождались статистически значимо чаще (73,1%), чем в 1А (51,8%) подгруппе и во 2-й (47,6%) группе (p=0,01 и p=0,006).
При изучении влияния ХТ, проводимой во время беременности, на рост плода мы обнаружили, что массо-ростовые показатели новорожденных в группах с лечением и без лечения статистически значимо не различались (p=0,83и p=1,00 соответственно). Частота рождения детей с массой ниже 10-го процентиля в группах не отличалась (p=0,20). Однако в группе с лечением наблюдалась тенденция к снижению веса детей. Так, в диапазоне ниже 20-го и выше 10-го процентиля находилось 12,9% детей из 1A подгруппы, 4,8% – из 2-й группы и ни одного ребенка из 1Б подгруппы (p=0,01).
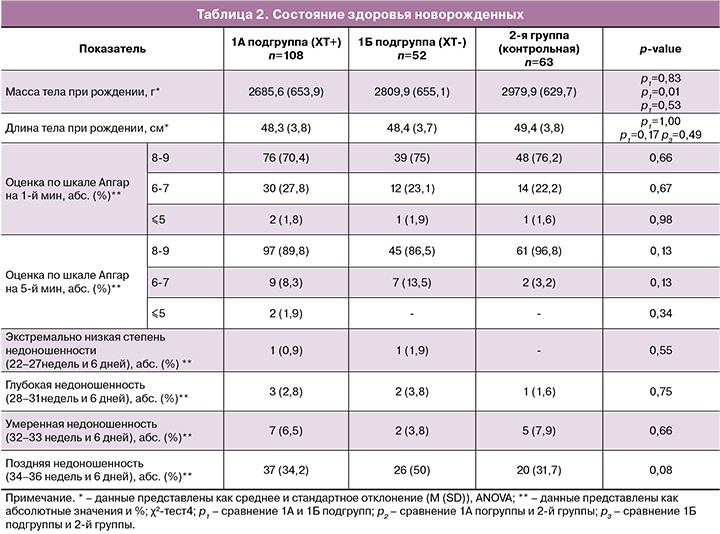
Структура заболеваемости новорожденных приведена в табл. 3. Обращает на себя внимание наличие высокой частоты заболеваний бронхолегочной системы, что связано главным образом с недоношенностью детей. Наиболее частым осложнением в 1А подгруппе была врожденная пневмония – 19,4% случаев. Респираторный дистресс-синдром (РДС) встречался у 10,2% детей, а транзиторное тахипноэ – у 5,6%. В 1Б подгруппе чаще всего диагностировали РДС – 17,3% случаев, врожденная пневмония и транзиторное тахипноэ – в 15,4% и 9,6% случаев соответственно. Во 2-й группе и врожденная пневмония и тахипноэ встречались в 12,7% случаев, РДС – в 6,3%. Частота указанных выше заболеваний во всех группах статистически значимо не различалась.
Среди инфекционных осложнений неонатальный сепсис развился у 2,8% детей в 1А подгруппе. У 2 детей сепсис был обусловлен стрептококком группы В и в 1 случае – Klebsiella oxytoca. В 1А подгруппе также были выявлены инфекции мочевыводящих путей (2,8%), кандидоз (0,9%), врожденный конъюнктивит (0,9%). На фоне инфекционного процесса (сепсис, врожденная пневмония) у 5,6% детей в 1А подгруппе развился синдром диссеминированного внутрисосудистого свертывания (ДВС), в 1Б подгруппе – у 1,9%, в контрольной группе – у 3,2% детей (p=0,50). Важно отметить, что в 1А подгруппе среди 23 детей с инфекционно-воспалительными заболеваниями (пневмония, сепсис и т.д.) 65,2% детей родились у матерей, которые получали ХТ менее чем за 3 недели до родов.
При оценке перинатальных поражений центральной нервной системы (ЦНС) были отмечены проявления церебральной ишемии во всех трех группах (в 1А подгруппе – 9,2%, в 1Б – 7,7%, во 2-й группе – 4,8%). При сравнении церебральной ишемии в группах не были обнаружены статистически значимые различия по частоте (p=0,79). Внутрижелудочковые кровоизлияния (ВЖК) I степени несколько чаще встречались у детей в 1А подгруппе (12%), но их частота статистически значимо не отличалась от таковой во 1Б подгруппе и 2-й группе (p=0,05). Врожденные церебральные кисты сосудистого сплетения, вентрикуломегалия и апноэ новорожденных были зафиксированы с одинаковой частотой во всех трех группах (p=0,73, p=0,86 и p=0,29 соответственно).
Анализ заболеваний сердечно-сосудистой системы детей показал, что врожденный порок сердца (ВПС) был диагностирован в 1А подгруппе у 3,7% детей: в 3 случаях – дефект межжелудочковой перегородки (ДМЖП) и в 1 – дисплазия клапана легочной артерии; во 2-й группе у 3,2% детей был выявлен ДМЖП. Малые аномалии развития сердца (МАРС) были зафиксированы у 3,7% детей из 1А подгруппы (у 3– множественные межпредсердные сообщения (МПС) и у 1 – сочетание множественных МПС и аорто-легочных коллатералей до 1 мм). Множественные МПС также были диагностированы у 1,9% детей из 1Б подгруппы и у 6,3% – из 2-й группы. Неполная блокада пучка Гиса выявлена у 1,8% и 1,6% детей в 1А подгруппе и во 2-й группе соответственно. Нарушение сердечного ритма выявлено у 1,6% детей во 2-й группе. Межгрупповой анализ не показал статистически значимые различия в частоте развития ВПС и МАРС у детей в 1А, 1Б подгруппах и во 2-й группе (p=0,38 и p=0,47). Отметим, что МАРС, неполная блокада пучка Гиса и нарушение сердечного ритма наблюдали только у недоношенных детей.
Малые аномалии развития других органов были выявлены в 1А подгруппе – в 7,4% случаев (врожденная мышечная косолапость, гипоспадия головчатой формы, врожденный гидроцеле, пиелоэктазия, неполное удвоение почки, эпителиальный копчиковый ход, врожденный стридор), в 1Б – в 5,8% (пиелоэктазия), во 2-й группе – в 1,6% (синдактилия). Частота развития МАР в группах статистически значимо не различалась (p=0,26). Крипторхизм, который относится к врожденным порокам развития (ВПР), был диагностирован по 1 случаю в каждой из групп. Частота ВПР в группах также не различалась (p=0,86).
Частота неонатальной желтухи и гемолитической болезни новорожденных в обследованных группах статистически значимо не различалась (p=0,65 и p=0,21).
Частота пребывания детей в ОРИТН в 1A подгруппе составила 31,5%, в 1Б подгруппе – 30,8% и во 2-й группе – 28,6%. Этот показатель во всех группах статистически значимо не различался (p=0,92). Следует отметить, что из 1A, 1Б подгрупп и 2-й группы детей, поступивших в ОРИТН, недоношенными были 91,2, 100 и 100% соответственно. Частота применения респираторной поддержки различными методами в трех группах также не отличалась (p=0,95). Все дети на втором этапе выхаживания были переведены в отделение патологии новорожденных (ОПБ), за исключением 1 ребенка (умер на 2-е сутки). Длительность пребывания детей всех трех групп в ОРИТН и ОПБ была сопоставима (p=0,56 и p=0,48).
Ранняя неонатальная смертность была зарегистрирована в 1А подгруппе в 1 (0,9%) случае у ребенка, рожденного на 26-й неделе беременности весом 490 г у матери с привычным невынашиванием и впервые выявленной лимфомой. Пациентке было проведено 5 курсов ХТ по схеме BEACOPP-14. Течение беременности осложнилось развитием плацентарной недостаточности, задержкой роста плода (ЗРП), выраженным маловодием и анемией тяжелой степени. Ребенок умер на 2-е сутки жизни. Смерть мальчика была обусловлена тяжелым течением инфекционного процесса, полиорганной недостаточностью на фоне его глубокой недоношенности и экстремально малого веса при рождении.
Особое внимание уделили изучению системы кроветворения у детей, рожденных у матерей, получавших ХТ во время беременности. Показатели периферической крови (количество эритроцитов, тромбоцитов, лейкоцитов и уровень гемоглобина) на 2-е сутки жизни у детей во всех группах исследования находились в пределах нормы и не имели статистически значимых различий (p=0,41–p=0,96). Отметим, что анемия была у 10,2% детей в 1А, у 9,6% – в 1Б подгруппах и у 11,1% – во 2-й группе. Частота возникновения данного состояния в 1А, 1Б подгруппах и 2-й группе статистически значимо не отличалась (p=0,96). Переливание эритроцитарной массы потребовалось в 1А подгруппе в 2,8% случаев, в 1Б – в 1,9%. В 1А подгруппе у 0,9% детей была отмечена геморрагическая болезнь новорожденных, у 2,8% – преходящая неонатальная тромбоцитопения и у 0,9% – полицитемия.
После выписки детей из стационара удалось проанализировать катамнез 71 ребенка из 1А подгруппы и 29 детей – из 1Б. Это позволило оценить состояние здоровья 62,5% детей, рожденных у матерей с лимфомами и РМЖ. В исследование вошло 47 детей в возрасте до 3-х лет, 38 детей – от 3 до 7 лет и 11 детей – от 7 до 16 лет. Медиана возраста детей в 1-й группе составила 2,4 года, во 2-й – 4 года.
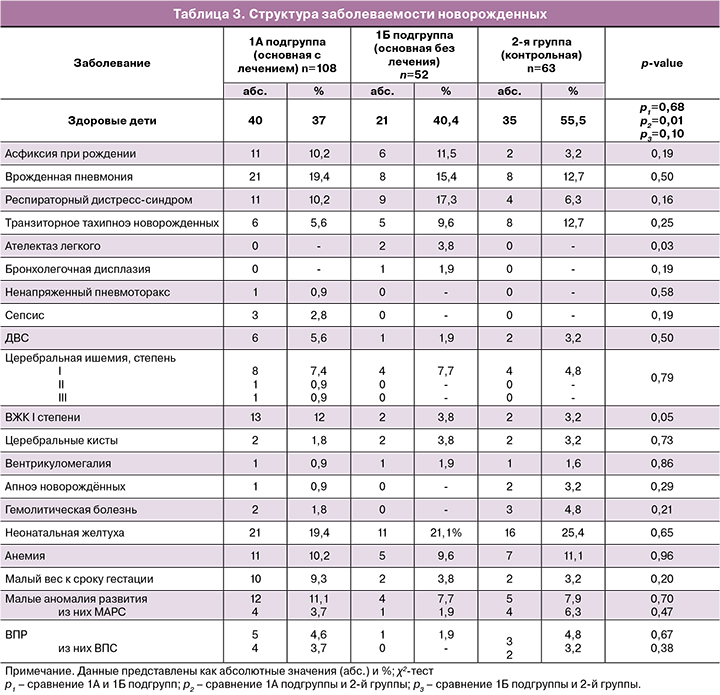
Структура заболеваемости детей 1А и 1Б группы представлена в табл. 4. Чаще всего у детей 1А подгруппы наблюдали заболевания верхних дыхательных путей (трахеит, бронхит) и заболевания ЛОР-органов (ангина, ларингит, ринит, фарингит, отит). Частота развития инфекционных заболеваний у детей в 1А и 1Б подгруппах была практически одинаковой. Анемия была выявлена у 9,9% детей в 1А подгруппе и у 6,9% – в 1Б (p=1,00). Врожденный ДМЖП ни в одном из случаев не потребовал оперативного вмешательства. Дети наблюдались у кардиолога по месту жительства. У всех детей с диагностированными МАРС (открытое овальное окно, межпредсердное сообщение) отмечали спонтанное закрытие дефекта в первые 1,5 года жизни ребенка. У 1 (1,4%) ребенка из 1А подгруппы, рожденного у матери с гипофосфатемическим рахитом, в первый год жизни было также диагностировано это наследственное заболевание. Отклонений в нервно-психическом развитии в обеих группах замечено не было.
Дети 1А и 1Б подгрупп, по мнению их родителей, не отличаются от своих сверстников и растут коммуникабельными, энергичными и любопытными. Дети имеют хорошую успеваемость (некоторые дети учатся на «отлично») в школе. Половина детей старше 5 лет посещают дополнительные кружки (шахматы, фигурное катание, гимнастика, танцы, айкидо и др.)
В обеих группах не было отмечено инвалидизации ребенка. Обследование детей, проведенное по нашей просьбе по месту жительства, не выявило каких-либо дополнительных пороков развития (кроме тех, которые были диагностированы в первые сутки жизни) или отклонений в развитии. Физическое и умственное развитие детей в 1А и 1Б подгруппах соответствовало возрасту. У детей обеих групп не наблюдали отклонений в нервно-психическом развитии, функционировании сердечно-сосудистой и кроветворной систем.
Обсуждение
Реализация репродуктивной функции является одним из важнейших аспектов в жизни женщины. В последнее время в связи с ростом онкологической заболеваемости у беременных, особенно у первородящих, наряду с сохранением здоровья и качества жизни женщины остро стоит вопрос о пролонгировании беременности. В нашем исследовании в половине (51%) случаев злокачественные заболевания были диагностированы у женщин, не имеющих детей. Все женщины вне зависимости от тяжести заболевания были крайне заинтересованы в сохранении беременности.
В современной литературе отсутствует единое мнение о влиянии онкологического заболевания на неонатальные исходы. В ряде работ имеются сообщения, что высокая частота преждевременных родов может приводить к увеличению числа неблагоприятных исходов для плода [1, 3]. Результаты нашего исследования также подтверждают, что заболеваемость новорожденных, в основном, связана с недоношенностью. Именно недоношенность является причиной развития у детей высокого числа бронхолегочных заболеваний и требует проведения реанимационных мероприятий (в том числе и респираторную поддержку). Высокий процент досрочного родоразрешения связан с необходимостью незамедлительно начать/продолжить противоопухолевое лечение пациентки. С 2014 г. тактика ведения таких пациенток изменилась – женщины подвергаются дополнительным курсам ХТ, а беременность пролонгируется до доношенного срока. Единственным показанием к досрочному родоразрешению теперь является ухудшение состояния матери и необходимость начать терапию, несовместимую с беременностью. Такой подход способствует существенному снижению числа недоношенных детей и приводит к снижению заболеваемости новорожденных.
Как известно, ХТ оказывает миелосупрессивное действие и повышает риски развития инфекционных осложнений [4, 5]. Действительно, результаты нашей работы показывают, что у детей, получавших ХТ антенатально, несколько чаще встречаются инфекционные осложнения и в большей степени (65,2%) при коротком интервале между окончанием лечения и родоразрешением. Для снижения этих рисков мы рекомендуем за 2–3 недели до родов воздержаться от применения ХТ. Такой подход особенно важен для недоношенных детей, у которых из-за незрелости печени и почек возможно снижение метаболизма токсических препаратов.
Одной из задач нашего исследования являлось изучение влияния ХТ на рост плода. Результаты когортных исследований, проведенных в предыдущие годы, противоречивы: в одних сообщается о повышении риска рождения маловесных детей к сроку гестации, в других влияние ХТ на рост плода не обнаружено [3, 4, 6, 7]. Отсутствие единого мнения по этому вопросу, вероятно, связано с тем, что авторы сообщали о ведении пациенток с разными типами опухоли с использованием разных программ лечения. По данным нашей работы, частота рождения детей с малым весом (ниже 10-го процентиля) к сроку гестации в группах наблюдения статистические не различалась (p=0,20). Однако отметим, что частота рождения детей в диапазоне ниже 20-го и выше 10-го процентиля наблюдалась чаще в группе с лечением, чем в остальных группах (p=0,01). По нашему мнению, этому обстоятельству следует уделить особое внимание и организовать динамический контроль за ростом плода до и после каждого курса ХТ.
Известно, что химиотерапевтические препараты оказывают на организм кардио- и нейротоксическое влияние. В нашем исследовании не обнаружено различий в частоте развития ВПС и МАРС у детей в группах наблюдения (p=0,38 и p=0,47). При этом МАРС были обнаружены только у недоношенных детей. У всех детей с диагностированными МАРС отмечалось спонтанное закрытие дефекта в первые 1,5 года жизни ребенка. При оценке катамнеза детей также не были выявлены отклонения в заболеваемости сердечно-сосудистой системы. Наши результаты совпадают с данными более ранних исследований [4, 8]. В работе 2016 г. Aviles и соавт. [8] обнаружили, что у детей, матери которых получали ХТ во время беременности, имеются только небольшие различия (по сравнению с детьми контрольной группой) во фракции выброса, фракционном укорочении и некоторых диастолических параметрах сердца. Эти небольшие различия, а также понимание того, что антрациклиновая кардиотоксичность может проявиться только через много лет, подчеркивают важность долгосрочного наблюдения за ребенком.
В исследовании проанализировано состояние нервной системы ребенка как еще одного органа-мишени для химиопрепаратов, и выявлено, что нарушения функции ЦНС могут быть связаны с недоношенностью. Поскольку ЦНС развивается не только во время беременности, но и после родов, воздействие ХТ на нейрокогнитивную функцию плода может иметь долгосрочные последствия. В недавнем исследовании Amant F. и соавт. [4], включившем 70 детей, подвергшихся ХТ по поводу различных материнских злокачественных новообразований, были представлены результаты наблюдения в среднем возрасте 22,3 месяца. Стандартизированную возрастную оценку использовали для изучения нейрокогнитивного функционирования, то есть интеллекта, внимания, памяти и исполнительных функций. Результаты сравнивали с нормативными данными для конкретных возрастных групп, представленными в проверенных тестах. У всех детей из двоен выявлены значимые нарушения развития. Тем не менее, развитие остальных детей оказалось в пределах нормы. У большинства детей результаты тестов на когнитивное развитие (по оценкам шкал развития младенцев Бейли, теста интеллекта Векслера или теста невербального интеллекта Снайдерса-Оомана) были нормальными. Более низкие баллы обычно обнаруживали у недоношенных детей. Было установлено, что средний коэффициент интеллекта (IQ) увеличивается на 11,6 балла (95%, ДИ 6,0-17,1) за каждый месяц увеличения продолжительности беременности (р<0,0001). Память и внимание не показали отклонений от нормы. Средние баллы за усвоение и экстернализацию поведения и общие проблемы были в пределах нормы, предоставленной специальным тестом.
По данным ряда авторов, при назначении ХТ матери со II триместра беременности риск развития у плода врожденных аномалий развития не увеличивается (в отличие от случаев применения ХТ в I триместре) [1, 3, 9]. Пациенткам нашего исследования ХТ проводили не ранее II триместра беременности. При анализе частоты ВПР было выявлено, что частота ВПР и МАР в группах была сопоставима (p=0,67 и p=0,70 соответственно) и не отличалась от частоты в общей популяции.
Результаты нашего опроса показали, что дети, подвергшиеся ХТ антенатально, росли и развивались в соответствии со своим возрастом и не имели каких-либо отклонений. Наши результаты исследований подтверждают выводы предыдущих работ [4, 10, 11]. Единственным недостатком исследования является субъективность оценки отдаленных показателей здоровья детей, основанной лишь на анкетировании матерей.
Заключение
Проведенный анализ состояния здоровья новорожденных у матерей с онкологическими заболеваниями и полученные данные катамнестического наблюдения позволяют сделать вывод, что ХТ можно и нужно проводить во время беременности. Однако, оптимальным для неонатальных исходов является отмена ХТ не позднее чем за 3 недели до родоразрешения. По результатам нашего исследования выявлено, что заболеваемость и тяжесть состояния новорожденных напрямую коррелирует со степенью недоношенности. Недоношенность является основной причиной заболеваемости в раннем неонатальном периоде у новорожденных, и, следовательно, беременность, по возможности, следует пролонгировать ближе к доношенному сроку. Таким образом, возможность проведения ХТ во время беременности исключает онкологические заболевания из противопоказаний к пролонгированию беременности.
Накопленный опыт ведения беременности у пациенток с онкологическими заболеваниями и информированность врачей и пациентов о том, что во время беременности может проводиться противоопухолевое лечение, привели к широкому использованию цитотоксической терапии беременным пациенткам и росту числа детей, подвергшихся ХТ антенатально. Представляет огромный научный интерес изучения химеризма клеток у детей, рожденных у матерей с онкозаболеваниями. Для полного понимания влияния онкологического заболевания и химиотерапии на плод и отделенные показатели здоровья ребенка наше исследование следует продолжить.
Для улучшения качества медицинской помощи и перинатальных исходов к проблеме ведения беременности у пациенток с онкологическими заболеваниями необходимо подходить мультидисциплинарно. Наблюдение женщин следует проводить в специализированных клиниках, имеющих опыт ведения пациенток с онкологическими заболеваниями.



