В яичниках человека ооциты находятся внутри фолликулов, заполненных фолликулярной жидкостью, полость которых выстилают соматические гранулезные клетки. В антральном фолликуле женскую гамету окружают клетки кумулюса (КК), специализированная подгруппа гранулезных клеток. КК дифференцируются из пристеночных гранулезных клеток под действием факторов, секретируемых ооцитами, и гормонов яичников. Самые внутренние слои КК, называемые corona radiata, находятся в непосредственном контакте с ооцитом через трансзональные выступы. Эти отростки клеток гранулезы проникают через блестящую оболочку ооцита и образуют специализированные соединения с оолеммой. Все обозначенные группы клеток участвуют не только в поддержании жизнеспособности ооцита, но и в дистантном взаимодействии гамет при оплодотворении. Сперматозоиды способны двигаться по направлению выделяемого КК хемоаттрактанта [1, 2]. В настоящее время активно изучаются КК методами современной молекулярной биологии для более глубокого понимания процессов оплодотворения у человека и повышения эффективности лечения бесплодия методами вспомогательных репродуктивных технологий (ВРТ) [3]. Показано, что лишь небольшая доля сперматозоидов может преодолеть множественные препятствия в женских половых путях и достигнуть места оплодотворения. КК служат барьером для сперматозоидов без акросомы. Только мужские половые клетки с интактной акросомой способны связаться с блестящей оболочкой ооцита и проникнуть внутрь клетки. В рутинной практике экстракорпорального оплодотворения (ЭКО) достаточно просто получить КК пациентки и использовать их в чашке Петри для совершенствования эмбриологического этапа программ ВРТ, улучшая исходы программ лечения бесплодия.
В опубликованной нами ранее работе было показано, что при использовании селекции сперматозоидов на КК улучшаются эмбриологические показатели программ ВРТ – повышается частота оплодотворения и бластуляции, особенно в группе супружеских пар с выраженным фактором мужского бесплодия [4].
Цель настоящего исследования: оценить вклад возраста женщины и влияние препарата, применяемого как триггер овуляции, на исходы программ лечения бесплодия методами ВРТ при селекции сперматозоидов на КК. Именно возраст женщины является критическим фактором, в большей степени определяющим исходы программ лечения [5]. Пациентки позднего репродуктивного возраста чаще сталкиваются со снижением овариального резерва, повышением суммарной дозы гонадотропинов, отсутствием оплодотворения ооцитов, остановкой раннего эмбриогенеза. Именно поэтому целесообразно совершенствовать эмбриологический этап программ ВРТ для женщин позднего репродуктивного возраста, внедряя новые методы селекции сперматозоидов и условия культивирования.
Материалы и методы
В исследование были включены мужчины и женщины, проходившие программы ВРТ в отделении вспомогательных технологий в лечении бесплодия имени профессора Б.В. Леонова ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава РФ с января 2020 г. по декабрь 2022 г. Критериями включения служили следующие параметры: возраст женщины от 18 лет до 45 лет; подписанное информированное добровольное согласие на участие в исследовании; уровень антимюллерова гормона в крови женщины больше или равно 1 нг/мл на 2–3-й день менструального цикла; присутствие живых сперматозоидов в эякуляте у партнера не менее 50%; прогрессивная подвижность сперматозоидов в нативном эякуляте PR не менее 12%; концентрация сперматозоидов не менее 1 млн/мл. Всего были включены 267 супружеских пар. Анализируемую группу составили 130 пациентов (группа КК), которым был произведен отбор сперматозоидов на КК с последующим проведением процедуры ИКСИ. Группу сравнения составили 137 пациентов, которым была выполнена стандартная процедура ИКСИ с отбором сперматозоидов по морфологическим характеристикам (группа ИКСИ). По возрасту каждая группа была разделена на две: женщины до 35 лет и 36 лет и старше. Для оценки влияния триггера овуляции при стимуляции функции яичников на исходы программ ВРТ женщины были разделены на группы: хорионический гонадотропин человека (ХГЧ) и агонист гонадотропин-рилизинг-гормона (аГнРГ). При этом были исключены пациентки, которым по тем или иным причинам перенос эмбриона в полость матки не производили (неудовлетворительное качество эмбриона, неадекватный рост эндометрия, соматическое заболевание). Всего были проанализированы данные 234 женщин.
Все супружеские пары перед вступлением в программу лечения бесплодия методами ВРТ прошли полное обследование согласно действующим регламентирующим документам. Программу ВРТ проводили по общепринятой методике. Стимуляцию функции яичников выполняли со 2–3-го дня менструального цикла препаратами антагοнистов ГнРГ и рекомбинантного фолликулостимулирующего гормона или менопаузального гонадотропина человека. Для предотвращения преждевременного пика лютеинизирующего гормона (ЛГ) при достижении фолликулом диаметра 14 мм назначали цетрореликса ацетат в дозе 0,25 мг/сут подкοжно. Для финального созревания ооцитов по достижении диаметра фолликулов ≥17 мм использовали ΧГЧ в дозе 10 000 ΜЕ или аГнРГ трипторелин в дозе 0,1 мг. Применение препаратов аГнРГ как триггера было обусловлено высоким риском синдрома гиперстимуляции яичников. В условиях операционной под внутривенной анестезией через 36–37 ч после введения триггера овуляции была выполнена трансвагинальная пункция фолликулов с забором фолликулярной жидкости и последующей оценкой качества ооцитов.
Образцы спермы собирали путем мастурбации после 3–5 дней воздержания от эякуляции. Сперматозоиды выделяли методом центрифугирования в градиенте плотностей с последующей отмывкой в среде для сперматозоидов согласно инструкциям производителя (Spermwash, IrvineSc., США). После инкубации в течение 2–3 ч КК отделяли от ооцитов раствором гиалуронидазы с помощью пастеровской пипетки перед ИКСИ стандартными методами (IrvineSc., США). После окончательной денудации отбирали ооциты на стадии MII, пригодные для ИКСИ. В группе КК проводили селекцию сперматозоидов описанным ранее методом [4], в группе сравнения — традиционно согласно стандартным операционным процедурам лаборатории эмбриологии. Кратко: с помощью культуральной среды, содержащей HEPES, готовили в чашке Петри три капли, соединенные между собой. Собранные аутологичные КК помещали в чашку Петри в центральную каплю. Сперматозоиды помещали в первую каплю, из которой они двигались через центральную, содержащую КК, собираясь в крайней правой капле. Оттуда микроинструментами для ИКСИ мужские половые клетки отбирали и проводили оплодотворение. Подготовленную рабочую чашку с КК и спермой выдерживали в инкубаторе в течение 1 ч, чтобы сперматозоиды могли пересечь КК. Полученные эмбрионы культивировали при 37°С, 6,2% CO2, 5% О2 в отдельных лунках чашки Петри под минеральным маслом до 5–6 суток. Перенос бластоцист в полость матки проводили катетерами СООК (Ирландия) под ультразвуковым контролем. Переносили строго 1 эмбрион. Поддержку лютеиновой фазы осуществляли препаратами прогестерона согласно инструкции производителя. В случае использования аГнРГ в качестве триггера финального созревания фолликулов применяли модифицированную схему поддержки лютеиновой фазы [5]. Беременность определяли по уровню ХГЧ в венозной крови через 14 суток после переноса, затем фиксировали плодное яйцо в полости матки через 21 сутки. Информация о родах была собрана путем телефонного звонка пациентам.
Статистический анализ
Анализ результатов проводился с помощью пакета программ IBM SPSS Statistics версии 23.0 (США), а также с помощью таблиц Microsoft Excel. Для анализа количественных данных в группах определялся вид распределения данных (тест Колмогорова–Смирнова). Непрерывные переменные были представлены в виде медианы (Ме) и межквартильных значений (Q1; Q3) на основе распределения выборки. Статистический анализ проводили с помощью теста Манна–Уитни при парном сравнении в случае, когда распределение не соответствовало закону нормального распределения. В случае нормального распределения переменных использовали среднее арифметическое (М) и стандартное отклонение (±SD): М (SD). Для анализа использовали методы параметрической статистики (t-критерий Стьюдента). Для описания категориальных бинарных данных (клинико-анамнестические данные и исходы программ ВРТ (имплантация и роды)) использовали процентные доли от общего числа пациенток в группе P и абсолютные числа N в формате P% (N). Анализ номинальных данных проводили с помощью критерия Хи-квадрат (χ2) и точного критерия Фишера. Для сравнения групп по номинальным признакам в проспективном исследовании рассчитывали относительный риск (ОР) с 95% доверительным интервалом (ДИ) для сравнения вероятности исхода (имплантация, роды) в зависимости от наличия фактора. Для оценки величины клинического эффекта для главных критериев эффективности первичных исходов (частота оплодотворения и частота бластуляции) для непрерывных данных использовали разность медиан с 95% ДИ (оценка Ходжеса–Лемана). Величину порогового уровня значимости p принимали равной 0,05. За критерии эффективности использования селекции сперматозоидов на КК принимали частоту оплодотворения и частоту бластуляции. Первичные исходы совпадают с критерием эффективности – улучшение показателей эмбриологического этапа. Вторичные исходы – эффективность программ ВРТ (частота наступления клинической беременности (имплантация) и частота живорождения).
К количественным переменным относили возраст женщины (Ж), количество полученных ооцит-кумулюсных комплексов, количество зрелых MII ооцитов, количество оплодотворенных клеток (2PN), количество бластоцист хорошего и отличного качества, процент зрелых клеток, процент оплодотворения, процент бластуляции, количество попыток ЭКО/ИКСИ в анамнезе. В качестве клинико-анамнестических данных, закодированных в бинарном виде, рассматривали наличие трубно-перитонеального фактора, наличие эндометриоза I и II стадий распространения или эндометриоидных кист, Б1 (первичное бесплодие) или Б2 (вторичное бесплодие), наличие маточного фактора (миомы, синехии, аденомиоз, рубец на матке), а также принадлежность к изучаемым группам (селекция сперматозоидов на КК или стандартная процедура проведения ИКСИ). Под частотой бластуляции понимали долю бластоцист хорошего и отличного качества, пригодных для переноса, в общей когорте получаемых бластоцист. Качество эмбрионов на 5-е сутки культивирования определяли согласно рекомендациям Российской ассоциации репродукции человека (РАРЧ, 2020). К морфологически отличным и хорошим бластоцистам относили категории АА, АВ, ВА, ВВ.
Результаты
Статистический анализ клинико-анамнестических данных и характеристик эмбриологического этапа исследуемых групп представлен в таблице 1 (для женщин ≤35 лет) и в таблице 2 (для женщин 36+ лет). Согласно результатам теста Колмогорова–Смирнова, распределение значений количественных характеристик в группе женщин ≤35 лет значимо отличается от нормального (р<0,05). В то время как в группе пациенток 36+ лет показатель «процент прогрессивно подвижных сперматозоидов» имел нормальное распределение.
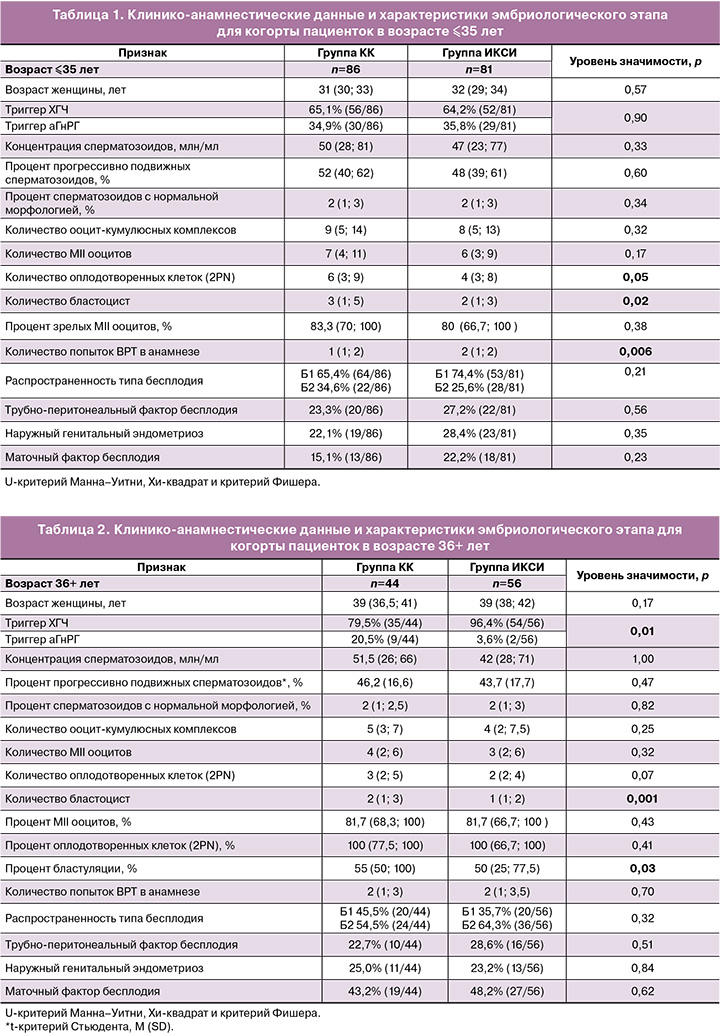
Несмотря на то что эмбриологические показатели в абсолютных значениях (количество оплодотворенных клеток и число бластоцист) в группе КК статистически значимо отличались от таковых в группе ИКСИ и были выше, при сравнении соответствующих относительных величин данных значений эти различия не подтвердились при анализе результатов эмбриологического этапа в когорте женщин младше 35 лет.
Также обращает на себя внимание значимое отличие между группами в частоте использования триггера в протоколах стимуляции: в группе ИКСИ чаще использовался ХГЧ по сравнению с аГнРГ.
Стоит отметить, что результаты сравнения показателей эмбриологического этапа в группе пациентов старше 36 лет показали статистически значимое увеличение процента бластуляции в подгруппе пациенток, которым проводился отбор сперматозоидов с использованием КК (р=0,03). Результаты показаны в таблице 3. Исходы программ ВРТ в анализируемых группах и подгруппах представлены в таблице 4. На основании полученных данных ни частота наступления беременности, ни частота родов не зависят от проведения селекции сперматозоидов на КК как среди молодых пациенток (≤35 лет), так и среди женщин позднего репродуктивного возраста (36+ лет)

Анализ результатов лечения двух групп пациенток (экспериментальной и контрольной) вне зависимости от возраста показал, что в группе с селекцией сперматозоидов с помощью КК при проведении протоков стимуляции с использованием триггера ХГЧ статистически значимо чаще наступала имплантация эмбриона, по сравнению с использованием в протоколах стимуляции аГнРГ. В группе пациенток с ИКСИ не было обнаружено разницы ни в частоте наступления имплантации, ни в частоте родов в зависимости от триггера (табл. 5).
Обсуждение
Вклад сперматозоида в ранний эмбриогенез активно изучается в настоящее время, поскольку до 50% случаев бесплодия связано с отцовским фактором [6]. Традиционные методы, используемые в программах лечения бесплодия методами ВРТ для отбора и оценки качества сперматозоидов, в основном основаны на параметрах подвижности и жизнеспособности. Однако другие характеристики сперматозоидов, в том числе целостность ДНК, состояние мембраны, упаковка хроматина, имеют такое же значение для успешного живорождения.
При естественном оплодотворении сперматозоиды перемещаются по мужским и женским половым путям, чтобы достичь ооцита и оплодотворить его. Во время транспортировки сперматозоиды сталкиваются со многими препятствиями, которые резко сокращают количество поступающих к месту оплодотворения. У человека количество сперматозоидов уменьшается от десятков миллионов в эякуляте до сотен в маточной трубе [6]. Маточные трубы играют ключевую роль в фертильности, модулируя транспорт, жизнеспособность и созревание сперматозоидов, обеспечивая мужские половые клетки, пригодные для оплодотворения в нужное время. Именно поэтому необходима разработка методов селекции сперматозоидов при оплодотворении in vitro, которые имитировали бы физиологические условия. В настоящей работе был применен метод отбора сперматозоидов с помощью аутологичных КК супруги. Полученные данные показали, что возраст женщины имеет критическое значение при любом методе оплодотворения: как с КК, так и без. В группе молодых пациентов до 35 лет абсолютное значение числа полученных бластоцист на 5-е сутки культивирования значимо больше в группе с применением селекции на КК по сравнению с традиционным ИКСИ (Ме 2 (1; 3) и 3 (1; 5), p=0,02). Однако это может быть связано с большим числом полученных ооцитов на стадии MII (р=0,05). При этом пациентки в группе традиционного ИКСИ были со значимо большим числом неудачных попыток ВРТ в анамнезе (р=0,006); по причинам бесплодия в супружеской паре группы не отличались.
Пациентки позднего репродуктивного возраста также показали статистически значимо большее число бластоцист на 5-е сутки культивирования при селекции сперматозоидов с помощью КК (р=0,03). По остальным анализируемым параметрам группы между собой не отличались. Данные результаты могут говорить о целесообразности применения селекции сперматозоидов на КК для улучшения эмбриологического этапа, а именно для увеличения числа бластоцист. Однако мы не изучали генетический статус полученных эмбрионов. Для группы женщин младше 35 лет большее число полученных бластоцист ввиду низкого риска анеуплоидий в эмбрионах позволит с одной стимуляции и нескольких криопротоколов получить долгожданную беременность и рождение здорового ребенка. Для группы женщин старше 36 лет, когда растет риск хромосомных аномалий в эмбрионах, улучшение эмбриологических показателей в виде увеличения числа бластоцист, пригодных для переноса в полость матки, может привести как к рождению ребенка с генетическими нарушениями, так и ко множественным неудачным попыткам переноса размороженного эмбриона в полость матки. Для женщин старше 36 лет актуальна рекомендация по проведению преимплантационного генетического тестирования эмбрионов на анеуплоидии для снижения риска рождения больных детей [7].
При анализе исходов программ лечения бесплодия методами ВРТ с разными типами селекции сперматозоидов было выявлено отсутствие статистически значимой разницы во всех возрастных группах пациенток по частоте наступления беременности и частоте родов.
Ввиду того, что триггер финального созревания фолликулов преимущественно действует на КК, пациентки были разделены по типу препарата: ХГЧ и аГнРГ. Из анализа были исключены женщины, которым не проводили перенос эмбриона в полость матки по причине неготовности эндометрия или риска развития синдрома гиперстимуляции яичников. В результате группу КК составили 117 пациенток, группу традиционного ИКСИ — также 117 пациенток. При оценке влияния триггера финального созревания фолликулов было выявлено, что при использовании ХГЧ и селекции сперматозоидов на КК достоверно выше частота имплантации эмбрионов в полости матки (КК 44,9%, ИКСИ 17,9%, р=0,01), при этом частота родов значимо не отличалась. В группе ИКСИ данных закономерностей выявлено не было.
Таким образом, можно говорить о том, что селекция сперматозоидов на КК повышает эффективность программ лечения бесплодия при использовании ХГЧ как триггера финального созревания фолликулов. Данный факт можно объяснить влиянием ХГЧ на КК. В естественном менструальном цикле с нормальной овуляцией разрыв доминантного фолликула и выход ооцитов инициируются резким подъемом уровня ЛГ в середине цикла. В программах стимуляции функции яичников для контроля выброса ЛГ используют аГнРГ (петля обратной связи), а ХГЧ — для замещения недостаточного пика ЛГ (прямая связь). Экзогенный ХГЧ также поддерживает лютеиновую фазу благодаря длительному периоду полувыведения; по этой же причине ХГЧ увеличивает вероятность развития синдрома гиперстимуляции яичников. Более длительное воздействие ХГЧ на КК позволяет ооцит-кумулюсному комплексу формировать менее плотные связи на гиалуроновом матриксе, тем самым, вероятно, способствуя лучшей селекции сперматозоидов. КК при использовании триггера аГнРГ не имеют такого «распушенного» матрикса; тем самым менее эффективно отбираются сперматозоиды [8]. Можно говорить о том, что именно экспансия КК, определяемая типом триггера, влияет на эффективность селекции сперматозоидов in vitro в программах лечения бесплодия методами ВРТ.
Заключение
Таким образом, проведенное исследование показывает, что технология селекции сперматозоидов с помощью КК в программах лечения бесплодия методами ВРТ может быть успешно реализована у разных возрастных групп женщин, что позволит увеличить число эмбрионов на стадии бластоцисты, пригодных для переноса в полость матки и криоконсервации. При этом частота имплантации может быть повышена только у тех женщин, у которых триггером финального созревания ооцитов был экзогенный ХГЧ. Полученные в работе данные дают надежду на разработку еще более совершенных методов селекции сперматозоидов in vitro, которые бы имитировали физиологические условия в женском репродуктивном тракте и приводили к повышению числа рожденных здоровых детей после программ ВРТ.



