Гипоксически-ишемическая энцефалопатия (ГИЭ) – крайне тяжелое состояние, запускающее апоптоз клеток головного мозга, что приводит в 10–15% случаев к смерти и в 25–30% – к инвалидизации новорожденных [1, 2]. Частота встречаемости тяжелой асфиксии новорожденных в родах в большинстве развитых стран составляет от 2 до 9 случаев на 1000 новорожденных [3, 4]. По данным UK TOBY Register, наиболее частыми интеркуррентными состояниями при тяжелой асфиксии в родах, являются аспирационные синдромы и внутриутробные инфекции (ВУИ) [5].
Тяжелая асфиксия плода вызывает гипоксемию и ацидоз, что приводит к расслаблению анального сфинктера и отхождению мекония в околоплодные воды, а дыхательные движения способствуют попаданию мекония в дыхательные пути [6]. Летальность при синдроме аспирации мекония (САМ) составляет от 24 до 53% [7, 8].
Искусственная вентиляция легких (ИВЛ) в лечении новорожденных с острым периодом ГИЭ является первичным терапевтическим мероприятием и занимает ведущее место в поддержании доставки кислорода к клеткам головного мозга. Однако она оказывает как положительное, так и негативное влияние в виде паренхиматозных повреждений легких, угнетения сердечного выброса и, соответственно, мозгового кровотока, которые ухудшают состояние ребенка и могут вызвать летальный исход [9–11].
Аспирационные синдромы вызывают вентиляционно-перфузионные нарушения, что является основой для развития персистирующей легочной гипертензии (ПЛГ), вторичного инфицирования и бронхолегочной дисплазии [12, 13]. Мониторинг биомеханических свойств легких и анализ кислотно-щелочного состояния у новорожденных, является основным методом оценки эффективности ИВЛ. Работы, посвященные данной проблеме в неонатологии единичны, что и стало основанием для проведения нашего исследования [11, 14].
Цель исследования – определить влияние интеркуррентных состояний на биомеханическую функцию легких у новорожденных перенесших тяжелую асфиксию в родах, на фоне проведения системной лечебной гипотермии.
Материал и методы исследования
Исследование проводили на базе кафедры анестезиологии и реаниматологии ГБОУ ВПО Иркутский государственный медицинский университет Минздрава России, отделение реанимации и интенсивной терапии новорожденных ОГАУЗ Иркутский городской перинатальный центр. Исследование одобрено этическим комитетом ИГМУ; во всех случаях получено письменное согласие от родителей или законного представителя респондента.
Дизайн: ретроспективное, обсервационное, продольное, когортное исследование, проведенное у 40 новорожденных, родившихся в тяжелой асфиксии, с проявлениями ГИЭ II и III степени по шкале Sarnat (в модификации A. Hill, J.J. Volpe, 1994) [15]. Критерии включения в исследуемые группы: новорожденные дети с гестационным возрастом более 35 недель, рожденные в тяжелой асфиксии в родах; тяжелое нарушение кислотно щелочного баланса: рН≤7,0; дефицит буферных оснований (Ве) ниже 16 ммоль/л; лактат ≥10 ммоль/л в крови, взятой в течении первого часа жизни; наличие ГИЭ по шкале Sarnat II или III степени. Критерии исключения из исследуемых групп: масса тела при рождении менее 1800 г; внутричерепные кровоизлияния; пороки развития, не совместимые с жизнью; пороки развития, требующие немедленной хирургической коррекции; наличие нейроинфекции и натальной травмы.
Все дети с первых минут жизни находились на синхронизированной перемежающейся принудительной вентиляции (SIMV) с контролем по давлению в дыхательных путях. Для проведения ИВЛ использовали аппараты экспертного класса: Maquet servo-i, SensorMedics 3100A и Leoni plus. В связи с наличием показаний у всех детей, была проведена процедура общей контролируемой гипотермии, согласно утвержденному протоколу [16]. Для обеспечения температурного режима использовали систему: «Allon 2001» во время проведения гипотермии, затем использовалась открытая реанимационная система Cosy Cot. Интенсивная терапия основывалась на общепринятых методиках лечения новорожденных [17].
В зависимости от наличия и вида интеркуррентных заболеваний все исследуемые дети были разделены на 4 группы: группа 1 – дети без интеркуррентных заболеваний (n=9), группа 2 – дети с ВУИ легких (n=9), группа 3 – дети с аспирацией чистых околоплодных вод (ОПВ) (n=12), группа 4 – дети с аспирацией мекониальных околоплодных вод (САМ) (n=10).
Для оценки степени тяжести поражения дыхательной системы использовалась шкала градации тяжести поражения легких (табл. 1).
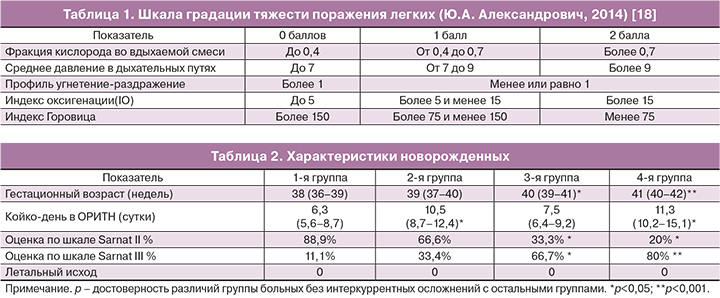
При оценке от 0 до 3 баллов поражение легких оценивалось как легкое, от 4 до 6 баллов — средней степени и от 7 до 9 баллов — тяжелой степени.
Исследования проводили в несколько этапов: при поступлении в отделение реанимации и интенсивной терапии новорожденных (ОРИТН), через 12, 24, 48, 72, 96 и 120 часов после поступления и в последний день респираторной поддержки. Для оценки эффективности проводимой ИВЛ до и во время процедуры охлаждения, а также после нормализации температуры тела фиксировались такие параметры ИВЛ, как фракция кислорода во вдыхаемой смеси (FiO2), среднее давление в дыхательных путях (MAP), частота дыхательных движений (RR) и комплаенс легких. Динамику изменений кислотно-щелочного состояния (КЩС), оценивали на анализаторе Radiometr (Дания): измеряли рН – кислотность крови, парциальное давление рСО2 – углекислого газа и рО2 – кислорода, Bе – дефицит буферных оснований. Транскутанный мониторинг газового состава крови проводили при помощи аппарата TCM4.
Данные статистически обрабатывали с использованием программы Statistica v. 8.0. и Microsoft Office Access 2013. Основная часть полученных данных не соответствовало закону нормального распределения, в связи с чем результаты представлены в виде медианы, 25-го и 75-го перцентилей. Анализ достоверности различий между группами осуществляли с использованием метода непараметрической статистики U-тест Манна–Уитни. За критический уровень значимости было принято значение р<0,05.
Результаты исследования и их обсуждение
Масса тела новорожденных в среднем составила 3670 (2600–4300) г, различий массы тела, связанных с полом не выявлено. В табл. 2 приведены сравнительные характеристики изучаемых групп.
Анализируя данную таблицу, можно сделать вывод что аспирационные синдромы достоверно чаще встречаются у доношенных, сроком гестации 40–41 недель и переношенных новорожденных (р<0,05). Ряд авторов отмечает наиболее частое сочетание тяжелой интранатальной асфиксии с аспирационными синдромами у переношенных новорожденных [6, 19–22]. САМ и ВУИ достоверно увеличивают продолжительность госпитализации в условиях ОРИТН (р<0,05). Во всех исследуемых группах летальных исходов не было. Выявлена взаимосвязь оценки по шкале Sarnat III (р<0,001) и оценки по шкале Апгар на первой минуте до 2 баллов, а на 5-й минуте – до 3 баллов (р<0,05) с аспирационными синдромами. Это доказывает, что асфиксия повышает риск аспирации [6,23].
В табл. 3 приведены результаты оценки степени тяжести поражения легочной системы в зависимости от вида интеркуррентных заболеваний.
Используя шкалу тяжести поражения легких (Ю.А. Александрович, 2014), установили, что новорожденные 2-й и 4-й группы имеют более тяжелое поражение легочной системы, чем дети 1-й и 3-й группы (р<0,01). Выявлено что в группах новорожденных с ВУИ и САМ достоверно чаще пролонгируется ИВЛ более 5 суток (р<0,01). Некоторые авторы, наоборот, отмечают меньшую продолжительность ИВЛ в группе детей с САМ в связи с более быстрым началом лечения, чем при аспирации ОПВ [24]; но в нашем случае все дети начали получать интенсивную терапию с первых минут жизни, в связи с этим отражается более достоверное влияние САМ на дыхательную систему.
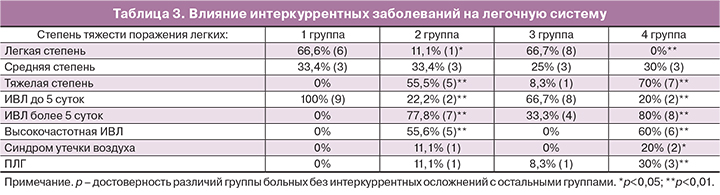
Тяжесть поражения дыхательной системы статистически значимо влияла на показатели ИВЛ. Так, наиболее высокие показатели комплаенса легких (р<0,05) характерны для детей без интеркуррентных заболеваний. Более высокие значения комплаенса характерны для детей с легкой степенью поражения дыхательной системы [18]. При старте системной гипотермии FiO2, MAP и RR снижались к 12-му часу жизни и доходили до минимума к концу 3-х суток у 1-й и 3-й группы (р<0,05), данные изменения отмечают и другие авторы [25]. Во время согревания наблюдалась статистически недостоверная тенденция к повышению данных показателей у детей 1-й и 3-й группы. Полученные результаты позволяют предположить, что лечебная гипотермия улучшает уровень оксигенации и уменьшает образование pCO2, что связано со снижением обмена веществ; это подтверждают и другие исследования [25].
К 12-му часу жизни у новорожденных 2-й и 4-й группы наблюдалось статистически достоверное нарастание всех параметров ИВЛ (р<0,01), также у этих групп выявлен переход на высокочастотную ИВЛ (р<0,05). У новорожденных с САМ выявлена связь с реализацией ПЛГ (р<0,01) и с синдромом утечки воздуха (СУВ) (р<0,05), что ухудшает прогноз для этих детей [26]. В.В. Бондырев и К.Д. Горелик [27] рассказали о необходимости применения «жестких» параметров ИВЛ и высокочастотной ИВЛ у новорожденных с САМ. В связи с этим новорожденные с САМ и ВУИ требуют более тщательного контроля за витальными функциями и подбором параметров ИВЛ.
При анализе показателей кислотно-щелочного состояния крови у всех детей при поступлении был выявлен декомпенсированный метаболический ацидоз, который удалось купировать в течение первых суток (р<0,01). Наличие метаболического ацидоза доказывает наличие перенесенной асфиксии [28]. Но в динамике выявлено значимое сохранение гиперлактатацидоза в группе детей с САМ (р<0,01).
В зависимости от тяжести поражения дыхательной системы были выявлены достоверные различия при поступлении и на 12-м часу жизни. В 1-й и 3-й группе новорожденных были более высокие значения рН, рО2 и более низкие значения рСО2 (р<0,01), по сравнению со 2-й и 4-й группами. Аналогичное сочетание газового и дыхательного ацидоза крови, в зависимости от тяжести поражения дыхательной системы отмечают и другие исследователи [18, 27]. Различия между показателями 1-й и 3-й групп отсутствовали. У всех детей на фоне проведения ИВЛ удалось в течение первых 24 часов компенсировать уровень рСО2 крови. В связи с более высоким показателем рСО2 крови у новорожденных 2-й и 4-й группы, требовалось более высокое значение MAP, что подтверждает наличие паренхиматозного поражения легких. С 48-го часа жизни и далее различий кислотно-щелочного состояния выявлено не было. Стабильный уровень рСО2 и рО2 указывает на стабилизацию детей и адекватно подобранные параметры ИВЛ у всех групп.
Достоверные различия рО2 наблюдались между 1-й и 4-й группами в течение первых 48 часов: рО2=90,1 (85,4–93,1) мм рт. ст., РаО2=81,2 (71,3–85,2) мл рт. ст. (р<0,05). Во 2-й и 4-й группе всем новорожденным приходилось повышать FiO2=0,68±0,15 (р<0,001), а в 38% случаев – до 100% O2 (р<0,05). Наличие гипоксемии свидетельствует о тяжелом поражении дыхательной системы у новорожденных с САМ и ВУИ [27].
Заключение
Таким образом, новорожденные с САМ и ВУИ требуют более тщательного контроля за витальными функциями, подбора параметров ИВЛ и частого контроля кислотно-щелочного состояния в первые часы жизни. Оценивая комплаенс, FiO2, МАР и индекс оксигенации можно оценить тяжесть поражения дыхательной системы и спрогнозировать длительность ИВЛ. Дети с САМ и ВУИ имеют более тяжелое поражение легочной системы, чем дети без интеркуррентных заболеваний и с синдромом аспирации ОПВ. Выявлено что САМ и ВУИ существенно влияют на длительность ИВЛ и увеличивают продолжительность госпитализации в условиях ОРИТН. К 12-му часу жизни у новорожденных с САМ и ВУИ наблюдалось нарастание параметров ИВЛ, также у этих групп выявлен переход на высокочастотную ИВЛ и реализация ПЛГ и СУВ. Во всех исследуемых группах летальных исходов не было.



