Проблеме профилактики малых пороков развития плода, к сожалению, не уделяется достаточного внимания. Отчасти это связано с трудностями диагностики малых пороков (низкая информативность УЗИ, биохимических и цитогенетических маркеров). Если болезнь гиалиновых мембран при нарушении формирования сурфактанта легких проявляется в период новорожденности или даже в родовом зале, то другие малые пороки зачастую обнаруживаются не при рождении, а в последующие периоды жизни ребенка. Нарушения прорезывания зубов обнаруживаются только в возрасте 4–12 мес., диафрагмальная грыжа, аномалии развития желчного пузыря могут быть диагностированы в школьном возрасте.
Малые врожденные пороки развития (ВПР), несмотря на слово «малые», превращаются достаточно серьезную проблему для реабилитации. Например, даже устранение такого «малого» порока развития, как сращение 5-го и 4-го пальцев кисти руки, в зависимости от глубины сращения (затронуты только эпидермис или же эпидермис, мышцы, костная ткань), требует многоэтапной реконструктивной хирургии с использованием наркоза и длительного курса двигательной реабилитации.
Обеспеченность организма матери всеми необходимыми витаминами, витамин-подобными веществами и микроэлементами – бесспорный фактор, способствующий физиологическому течению беременности и нормальному развитию плода [1, 2]. Установлена взаимосвязь между недостаточным потреблением матерью тех или иных нутриентов и риском преждевременных родов [3, 4]. Например, данные по 5738 родам в рамках крупномасштабного исследования по предупреждению врожденных дефектов показали, что риск родов до 32 недель повышался в среднем на 50% при дефицитах таких микронутриентов, как тиамин, рибофлавин, холин, витамин А, β-каротин, витамин Е, железо, медь и цинк [5].
Профилактика всех ВПР намного более эффективна при использовании витаминно-минеральных комплексов (ВМК), чем при использовании монопрепаратов тех или иных микронутриентов (только фолиевой кислоты, только цинка, только йода, только витамина А и др.). По данным крупного исследования (n=5000) использование поливитаминных комплексов с фолиевой кислотой (препарат элевит пронаталь) снижало риск многих видов ВПР на 90%. В то же время монопрепараты фолиевой кислоты способствуют снижению риска отдельных ВПР (прежде всего дефектов нервной трубки) не более чем на 70%. При этом монопрепараты фолиевой кислоты эффективны в профилактике гораздо меньшего круга ВПР, чем ВМК [4]. С учетом биодоступности фолиевой кислоты (76–97%) [6], 0,7–0,8 мг/сут ФК будет соответствовать потреблению эффективной дозы фолатов в 0,50–0,78 мг/сут. С учетом не более чем 50% биодоступности диетарных фолатов [3] из 0,2–0,3 мг/сут фолатов, поступающих в организм женщины с пище, будет усвоено не более 0,1–0,15 мг/сут.
Эффективность ВМК в профилактике ВПР обусловлена широким распространением полигиповитаминозов у женщин репродуктивного возраста. Обследования последних десяти лет, проводимые Институтом питания РАН, показали, что дефицит витаминов группы В выявляется у 20–100% обследованных, аскорбиновой кислоты – у 13–50%, каротиноидов – 25–94% при относительно хорошей обеспеченности витаминами А и Е. Наиболее часто отмечается дефицит железа, йода, кальция, цинка, хрома, фолиевой кислоты, биотина, витаминов А, D, В1, В6 [3, 7].
Результаты анализа когорты женщин репродуктивного возраста (20–45 лет, n=2141) показали, что в таком, казалось бы, «обеспеченном» регионе, как современная западная Европа, потребление определенных витаминов не всегда достигает даже минимально рекомендуемых норм суточного потребления. Например, витамина В6 потребляется в среднем 1,6 мг/сут (при норме 2 мг/сут), фолатов – 375 мкг/сут (и это с учетом фолат-содержащих ВМК) при норме 400 мкг/сут, а витамин Е – 6,2 мг/сут при норме 15 мг/сут. Одновременно всеми рассмотренными эссенциальными микронутриентами было обеспечено менее 10% участниц, что указывает на высокий уровень полигиповитаминоза. Сниженная обеспеченность витаминами В6, В9, Е и другими была достоверно ассоциирована с нарушениями липидного профиля крови, повышенным риском гипергомоцистеинемии, нарушениями барьерной функции кожи, эндометриозом, нарушениями иммунитета и ожирением – то есть факторами, способствующими формированию различных ВПР [8, 9].
С целью наиболее эффективной профилактики «больших» и «малых» ВПР адекватные уровни обеспеченности организма женщины витаминами и микроэлементами должны поддерживаться постоянно: и в преконцепцию, и в течение всего срока беременности (а не только в первый месяц). Обеспеченность микронутриентами в течение всей беременности важна потому, что многие ВПР формируются во 2-м и даже в 3-м триместрах. Если дефекты нервной трубки, грубые пороки головного мозга формируются в течение 1-го месяца беременности, то диафрагмальная и пупочная грыжи, аномалии развития мочеточников, перегибы желчного пузыря и желчевыводящих путей, аномалии прикуса и зачатков зубов, микрокисты мозга формируются во 2-м и 3-м триместре. Болезнь гиалиновых мембран формируется в последние недели беременности. Далее рассмотрим роли обеспеченности различными микронутриентами для профилактики «малых» и «больших» ВПР.
Витамин А (ретинол)
Роль витамина А в профилактике ВПР ничуть не меньше роли фолатов или витамина D: ретинол участвует в формировании скелета, обеспечивает нормальное существование клеток эпителия кожи и слизистых оболочек глаз, дыхательных, мочевыводящих путей, пищеварительного тракта, функции зрения. На поздних сроках беременности витамин А важен для профилактики таких «малых» ВПР, как аномалии мочеточника, бронхов, кистей рук.
По нашим данным, обеспеченность витамином А женщин репродуктивного возраста (20–5 лет) в странах западной Европы составляет 38%, в России – всего 28% [8]. При дефиците витамина А возрастает возможность инфицирования плода, риск мастита у кормящих. У беременной дефицит витамина А снижает местный иммунитет, поражается эпителий слизистых оболочек, легче возникают стоматит, поражение эмали зубов; беременные больше подвержены острым респираторным заболеваниям и гриппу, молочнице, циститу, формированию желчных камней, нефролитиазу и формированию «зубного камня».
Эмбрион не может синтезировать ретинол и зависит от доставки ретинола от матери [10]. Ретиноиды важны для развития сердца на ранних стадиях эмбрионального развития [11]. В частности, внутриклеточные сигналы, передаваемые через ретиноиды, необходимы для завершения развития левой/правой асимметрии сердца [12, 13]. Дефицит витамина А в первом триместре приводит к аномалиям развития эмбриона и плацентарных структур и стимулирует развитие тяжелых форм ВПР [14].
Продукт биотрансформации витамина А, ретиноевая кислота, синтезируется ферментом ретинальдегид дегидрогеназой 2 (ген RALDH2) и необходима для развития переднего мозга, воздействуя на рост клеток через сигнальные пути типа «SHH» (англ. Sonic Hedgehog) и «FGF8» (фактор роста фибробластов 8) [14].
Алкоголь вызывает пороки развития различных эмбриональных структур, в частности, за счет ингибирования ретинальдегид дегидрогеназу во время гаструляции. Витамин А, получаемый беременными в физиологических дозах, способствует профилактике развитие гиалиновых мембран и нарушений формирования сурфактанта легких у новорожденных [15].
В более поздние сроки беременности ретиноевая кислота играет роль в регуляции цикла сон-бодрствование, а после родов необходима для развития цитоархитектоники коры, обучения и памяти [16]. Дефицит витамина А и цинка ассоциирован с повышенным риском диареи новорожденных, повышенной заболеваемостью корью. Достаточные уровни витаминов А и Е у новорожденных положительно влияют на формирование поведения и когнитивное развитие детей, профилактируют детское ожирение [17].
В экспериментах на животных нарастающий дефицит витамина А приводит к дозозависимому сокращению заднего мозга эмбриона у крыс [18], нарушениям развития гортани крыс [19], к высокой перинатальной смертности, тяжелой атаксии, затруднению сосания и слепоте у телят [20].
Даже пограничная недостаточность витамина А приводит к уменьшению размера почек у новорожденных [21].
Наблюдения 22 новорожденных с врожденной диафрагмальной грыжей и 34 здоровых новорожденных в контрольной группе показали, что новорожденные с данным ВПР имели значительно более низкие уровни ретинола (0,60 мкмоль/л, контроль – 0,76 мкмоль/л; P=0,003) и ретинол-связывающего белка РСБ (5,42 мг/л, контроль – 7,11 мг/л, P=0,02), чем здоровые новорожденные. У новорожденных с ВПР уровни низкие уровни ретинола в крови (менее 0,6 мкмоль/л) встречались в 11 раз чаще, чем в контрольной группе (95% ДИ 2,54–48,66; P=0,001); низкие уровни РСБ (<4,5 мг/л) – в 4 раза чаще (95% ДИ, 1,00–15,99; P=0,05) [22]. Исследование «случай-контроль», проводимое в Дании в течение 4 лет, показало, что более высокие уровни витамина А, потребляемого с пищей и поливитаминами, соответствовали снижению риска «заячьей губы» [23].
Рекомендуемые суточные дозы витамина А лежат в диапазоне 3000–3500 ME/сут для взрослых (для беременных – 3333 МЕ/сут, для кормящих — 4333 МЕ/сут). При заболеваниях, связанных с недостаточностью ретинола, дозировка может быть увеличена до верхнего допустимого уровня потребления — 10000 МЕ/сут. Острая токсичность по витамину А наблюдается возникает при однократном приеме 1 000 000–1 500 000 МЕ витамина А, хроническая токсичность – при суточных дозировках в 200 000–300 000 МЕ/сут. Однако токсическое воздействие на печень может наблюдаться при дозировке в 15 000 МЕ/сут. [24].
Витамин Е (токоферол)
Термин «витамин Е» объединяет целую группу соединений: a-, β-, γ-токоферолы. Органами, максимально концентрирующими витамин Е, являются плацента, печень, мозг. Обеспеченность женщин репродуктивного возраста витамином Е в странах западной Европы составляет 33%, в России – 52% [8].
В эксперименте дотации витамина Е у мышей с моделью диабета (стрептозотоцин) дозозависимо уменьшали частоту встречаемости пороков эмбриона, что сопровождалось нормализацией апоптотического белка Вах. Дотации витамина Е значительно уменьшают риск развития таких «малых» ВПР, как низкая посадка ушных раковин, малые размеры щитовидной и вилочковой желез, отсутствие паращитовидных желез, смещение аорты, дефекты межжелудочковой перегородки сердца [24].
В исследовании 206 матерей, родивших ребенка с расщелиной верхнего неба, и 203 матерей в группе контроля потребление растительных белков, клетчатки, β-каротина, аскорбиновой кислоты, α-токоферола, железа и магния было значительно ниже у матерей, родивших детей с данным врожденным пороком [25]. В исследовании 55 случаев гастрошизиса (ВПР брюшной стенки, развивающийся во 2-м и 3-м триместрах) и 182 человек в контрольной группе было показано, что матери, родившие ребенка с ВПР, характеризовались большой частотой дефицита α-каротина (в 4,6 раза, 95% ДИ 2,2–9,5), β-каротина (в 3 раза, 95% ДИ 1,6–6,0), витамина С (в 2,2 раза, 95% ДИ 1,5–7,8) и витамина Е (в 2,3 раза, 95% ДИ 1,2–4,4) [24]. Подчеркнем, что достаточный уровень витаминов А и Е у новорожденных положительно влияет на когнитивное и поведенческое развитие детей [17].
Витамин D
Активные метаболиты витамина D являются компонентами сложной гормональной системы, регулирующий кальций-фосфорно-магниевый гомеостаз, минерализацию костной ткани, оказывает влияние на развитие мозга эмбриона, регулирует иммунитет и функцию плаценты [2]. Мета-анализ 15 исследований, включивший данные для 2649 беременных и 820 новорожденных, показал высокую встречаемость дефицита витамина D (уровни 25(OHD в сыворотке крови менее 30 нг/мл) – до 90% обследованных [26]. Пренатальный дефицит витамина D приводит к изменению морфологии мозга новорожденных, снижению плотности нейронов на фоне более низких уровней нейротрофинов: кора мозга была значительно тоньше, боковые желудочки увеличены, уровни фактора роста нервов и рецептора нейротрофинов p75 (NTR) были снижены [2].
Для беременных из групп риска (гестационный диабет, остеопения, частые простудные заболевания, преэклампсия, гиповитаминоз D, то есть уровни 25(OH)D в сыворотке крови менее 30 нг/мл и др.) ежесуточный прием витамина D должен определяться врачом и лежит в диапазоне от 1000 МЕ/сут. до 4000 МЕ/сут.
Недостаточный уровень витамина D в организме беременной приводит к неонатальной гипокальциемии, врожденному рахиту, врожденной катаракте, ДНТ, макросомии плода и ожирения у детей [2]. Мета-анализ 20 клинических исследований (n=9209) подтвердил, что у беременных с дефицитом витамина D (25(OH)D<30 нг/мл) риск гестационного диабета был в 1,5 раза выше (ОШ 1,53, 95% ДИ 1,33–1,75) [27].
Витамин С (кислота аскорбиновая)
Витамин С обеспечивает превращение фолиевой кислоты в ее активную форму – тетрагидрофолиевую кислоту, необходим для формирования активных метаболитов витамина D и для поддержки структуры соединительной ткани, дефицит которой ассоциирован с высоким риском самых различных ВПР [24]. Витамин С снижает частоту хромосомных аномалий вызванных облучением преовуляторных ооцитов и защищает структуру легких новорожденных от токсических эффектов никотина при активном или пассивном курении [28]. Витамин С также снижает эмбриотоксичность фтора у беременных крыс, снижая риск скелетных аномалий (волнистые ребра, 14-е ребро, неполное окостенение черепа, утолщения голени) и висцеральных аномалий ведущих к возникновению подкожных кровотечений у плода [29]. Обеспеченность женщин витамином С в странах западной Европы составляет 48%, в России – 36% [8].
Витамин В1 (тиамин)
При дефиците витамина В1 у беременной возрастает потеря аминокислот с мочой, в повышенных количествах начинает выделяться креатинин, что стимулирует развитие многих ВПР. При значительном дефиците в организме витамина В1 беременность не развивается, а у самой беременной возникает тяжелое заболевание, проявляющееся в виде энцефалопатии. Дефицит тиамина во время беременности приводит к гибели нейронов ЦНС плода и кардиомиопатии [30].
По нашим данным, обеспеченность женщин витамином В1 в странах западной Европы составляет 40%, в России – 25% [8]. Дефицит витамина В1 во время беременности приводит к преждевременным родам, повышает риск преэклампсии [31], дефектов нервной трубки плода и других ВПР, острой сердечной недостаточности у новорожденных. В исследовании 206 матерей, родивших ребенка с расщелиной верхнего неба, и 203 матерей контрольной группы наблюдалась тенденция к снижению риска ВПР с ростом содержания тиамина (р=0,04) и пиридоксина (р=0,03) в пищевом рационе [32].
С дефицитом В1 ассоциирована врожденная диафрагмальная грыжа. В ходе исследования 377 случаев диафрагмальной грыжи и 5008 пациенток контрольной группы матери новорожденных заполняли опросник по питанию, посредством которого оценивалось потребление нутриентов в течение года до наступления беременности. Среди женщин, принимавших ВМК, более высокое потребление фолиевой кислоты, витаминов B1, B2, B6, B12 и минералов кальция, железа, магния и цинка соответствовало пониженному риску развития диафрагмальной грыжи [33].
Витамин В2 (рибофлавин)
При недостатке рибофлавина уменьшается количество окислительных ферментов, страдает окисление органических веществ, дающих энергию для роста и развития организма. Витамин В2 также участвует в построении зрительного пурпура, необходим для развития нервной системы, кожи, слизистых оболочек, печени плода и стимулирует кроветворение.
Обеспеченность женщин витамином В2 в странах западной Европы составляет 45%, в России – 34% [8].
Дефицит рибофлавина негативно отражается прежде всего на тканях, богатых капиллярами и мелкими сосудами – плаценте и мозге. При дефиците рибофлавина увеличивается риск преэклампсии у беременной, расщелин неба у плода, а регулярное употребление рибофлавина способствует уменьшению риска послеродовой депрессии [34].
Гиповитаминоз В2 является важным фактором риска «больших» и «малых» ВПР. В эксперименте низкий уровень рибофлавина в рационе питания отрицательно влияет на эмбриональное развитие, повышает риск геморрагии, приводит к задержке развития эмбриона, увеличивает риск ВПР сердца (дефект межжелудочковой перегородки, снижение толщины стенок левого желудочка). Диетарный дефицит рибофлавина и никотинамида, отражаемый в уровнях этих витаминов в крови, был выше у матерей, родивших детей с врожденным пороками сердца [35].
Изучение 324 детей с дефектами конечностей и 4982 здоровых младенцев показало, что самое низкое диетарное потребление рибофлавина соответствовало 3-кратному риску ВПР (ОШ 2,9, 95% ДИ: 1,04–8,32) [36]. ВПР, известный как краниостеноз (краниосиностоз), характеризуется ранним закрытием черепных швов, что способствует ограниченному объему черепа, его деформации. В 8-летнем исследовании детей с краниостенозом (N=815) и здоровых новожденных (N=6789) риск краниостеноза была значительно ниже среди женщин с адекватным потреблением рибофлавина, витамина В6 и витамина E [37]. В исследовании 190 матерей и новорожденных с дефектами мочевыделительной системы и 324 матерей в группе контроля диетарное потребление рибофлавина (1,32 и 1,41 мг/сут, P<0,05) и никотинамида (14,6 и 15,1 мг/сут; P<0,05) было ниже у матерей, родивших ребенка с ВПР. Кроме того, низкое диетарное потребление рибофлавина (<1,20 мг/сут) и никотинамида (<13,5 мг/сут) беременными увеличивало риск рождения ребенка с пороками сердца более чем в 2 раза (ОШ 2,4; 95% ДИ 1,4–4,0) [35].
Витамин РР (ниацин, витамин В3, никотиновая кислота, никотинамид)
Гиповитаминоз РР у беременных ассоциирован с повышенной утомляемостью, депрессией, эпизодическими головокружениями, нарушениями сна, тахикардией с ощущениями сердцебиения, цианозом губ, лица, кистей, бледностью и сухостью кожи. Кожные проявления дефицита витамина РР легко обнаруживаются при приеме солнечных ванн (отмечается усиленное потемнение кожи на коленях).
По нашим данным, обеспеченность женщин витамином РР в странах западной Европы составляет 42%, в России – 31% [8]. При тяжелом дефиците витамина РР во время беременности формируются многочисленные аномалии развития [24]. Низкий диетарный уровень рибофлавина (менее 1,2 мг/сут.) и ниацина (менее 13, мг/сут.) в 2 раза увеличивает риск рождения ребенка с врожденными пороками сердца. Увеличение дотации никотинамида уменьшало риск развития пороков, причем вне зависимости от потребления фолатов [35]. В исследовании 190 матерей новорожденных с пороками развития желудочков сердца диетарное потребление никотинамида было ниже у матерей, родивших ребенка с данным ВПР (14,6 и 15,1 мг/сут; P<0,05, Нидерланды [36]). В ходе исследования 140 новорожденных с транспозицией магистральных артерий и 698 случаев контроля более низкое потребление фолиевой кислоты, ниацина, рибофлавина и витамина В12 повышало риск ВПР после поправок на эффекты других питательных веществ [37, 38].
Витамин В6 (пиридоксин)
При гиповитаминозе В6 у беременных характерны рвота, кариес, перхоть, сухие дерматиты. Обеспеченность женщин витамином В6 в странах западной Европы составляет 27%, в России – 22% [8].
Дефицит витамина В6 во время беременности способствует развитию дефектов нервной трубки плода и краниостеноза [24]. Мета-анализ 5 исследований, включивший более 1600 женщин, показал, что регулярное употребление витамина В6 уменьшает риск рассасывания эмали зубов и кариеса у беременных, риск спонтанной потери плода [39], риск рождения ребенка с низким весом [40].
Дефицит витамина В6 стимулирует развитие «продольных» дефектов конечностей (таких, как отсутствующие пальцы (эктродактилия), синдактилия, брахидактилия, полидактилия). Эти ВПР встречаются среди новорожденных с суммарной частотой примерно 1:3000 и могут быть результатом окклюзии артерий, воздействия тератогенов, материнского диабета, ожирения, а также недостаточности микронутриентов. Изучение 324 случаев новорожденных с дефектами конечностей и 4982 здоровых младенцев показало, что самое низкое диетарное потребление витамина B6 матерями во время беременности соответствовало 4-кратному увеличению риска дефектов конечностей (ОР 3,9, 95% ДИ 1,08–13,78). Квартиль участников с наиболее низким потреблением витамина B6 (менее 3,3 мг/сут.) соответствовал 3,84-кратному риску дефектов конечностей (95% ДИ: 0,93–15,86) [41]. В ходе исследования когорты детей с врожденными пороками (500 новорожденных, родившихся с ВПР) было показано, что ежедневный прием ВМК с витамином РР в периконцепцию приводил к статистически достоверному снижению риска дефектов конечностей в 3 раза (ОР 0,3) и дефектов мочевых путей – на 40% (ОР 0,6) [42].
Фолаты (витамин В9)
Роль препаратов фолиевой кислоты в понижении риска ДНТ была многократно доказана. У беременных дефицит фолиевой кислоты и фолатов увеличивает риск частичной или полной отслойки плаценты, спонтанного аборта и множественных ВПР. У детей, матери которых испытывали дефицит фолатов во время беременности, повышается риск задержки умственного развития [24]. По нашим данным, обеспеченность женщин фолатами в странах западной Европы составляет 35%, в России – 15% [8].
Прием препаратов фолиевой кислоты до беременности и во время ее в количестве 400–800 мкг/сут предотвращает не только ДНТ, но и аномалии эмбриогенеза мозга, сердечно-сосудистой системы, мочевыделяющей системы, образование расщелины верхнего неба, дефектов конечностей, дефектов больших артерий, и омфалоцеле – пупочной грыжи, синдром Дауна и врожденные пороки сердца [24]. Изучение 324 случаев детей с ВПР конечностей и 4982 здоровых младенцев показало, что низкое диетарное потребление фолиевой кислоты соответствовало 4-кратному увеличению риска дефектов (ОШ 3,9, 95% ДИ 1,08–13,78) [36].
Витамин В12
Метаболизм фолатов и процессы метилирования ДНК, столь важные для роста клеток, нарушаются при дефиците каждого из этих трех витаминов – В6, В9 или В12. По нашим данным, обеспеченность женщин витамином В12 в странах западной Европы составляет 57%, в России – 40% [8]. Исследование 203 матерей, родивших ребенка с «заячьей губой» и/или «волчьей пастью», и 178 матерей новорожденных без дефектов показало, что «западная диета» (высокое содержание мяса, пицца, бобовые и картофель, низкое содержание фруктов) связана с повышенным риском этих ВПР (ОШ 1,9; 95% ДИ 1,2–3,1). В соответствии с результатами авторов, «западная» разновидность диеты была связана с пониженным уровнем фолатов (P=0,02), витамина В6 (P=0,001), витамина В12 (P=0,02) и повышенным уровнем гомоцистеина в плазме крови (P=0,05) [43].
Цинк
Роль цинка в профилактике ВПР не менее весома, чем, например, роль фолатов или витамина А. Существует более 1200 цинк-связывающих белков и ферментов, активность которых в условиях дефицита цинка значительно снижена. Данные белки вовлечены в (1) воздействие на внутриклеточные сигнальные каскады, (2) поддержку убиквитин-зависимого протеолиза, (3) регуляцию процессов роста эмбриона и (4) осуществление биологических эффектов многих гормонов. Диета беременной с недостаточным содержанием цинка связана с повышенным риском развития осложнений беременности, преждевременных родов, низкого веса при рождении, «больших» и «малых» ВПР, тяжелых дефектов развития ЦНС, сердца, сращения пальцев, нарушений прорезывания зубов, врожденных нарушений иммунитета и др. В последующей жизни у ребенка повышается риск атопического дерматита, низкорослости и ожирения [24].
По нашим данным, обеспеченность женщин цинком в странах западной Европы составляет 31%, в России – 19% [8].
В эксперименте добавление препаратов цинка к диете с дефицитом белка снижало смертность плода и риск врожденных пороков. Пища с 17% белка в рационе (норма) или с 9% (дефицит белка) дополнялась недостаточным, нормальным или избыточным количеством цинка во время беременности. По сравнению с контрольной группой животных (нормальное содержание белка и цинка) смертность плода была выше на 67%, а частота пороков развития – на 74% выше в группах с ДЦ [44].
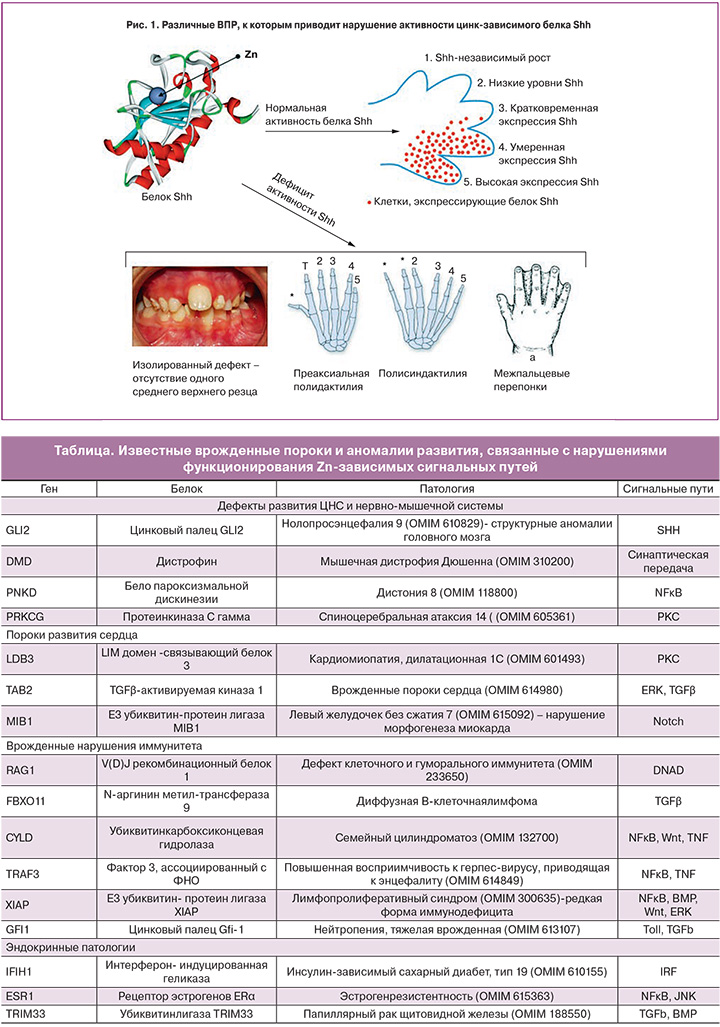
Один из наиболее распространенных пороков развития плода – синдактилия – связан со снижением активности цинк-зависимого каскада Shh (англ. «Sonichedgehog», дословно «сверхзвуковой ежик», герой одноименного мультфильма). Основным элементом этого сигнального каскада является цинк-связывающий белок Shh (рис. 1).
Из огромного корпуса фундаментальных исследований следует, что цинк-зависимый белок Shh вовлечен в масштабную координацию роста клеток эмбриона/плода и осуществляет формирование общей структуры конечностей, структур головного мозга, спинного мозга, таламуса [45] и др. Данные по моногенным заболеваниям показали, что дефицит активности Shh связан с широким кругом ВПР (рис. 1), включая изолированную микрофтальмию с колобомой (OMIM611638); тяжелейший ВПР мозга – холопросэнцефалию – нарушение деления мозга на левое и правое полушарие (OMIM142945); изолированный дефект – отсутствие одного среднего верхнего резца (OMIM147250); полисиндактилию и преаксиальную полидактилию (OMIM174500).
В целом, нарушение активности цинк-зависимых сигнальных путей приводит к дефектам развития ЦНС и нервно-мышечной системы, порокам развития сердца, врожденным нарушениям иммунитета, эндокринным патологиям и другим аномалиям развития (таблица).
Цинк, являясь кофактором многочисленных протеаз, принципиально необходим для управляемой деградации белков (протеолиза) с участием особого сигнального белка – убиквитина. Управляемый протеолиз белков осуществляется на специальной молекулярной машине клетки – протеосоме и необходим для удаления поврежденных, дисфункциональных белков из клетки, устранения абнормально свернутых белков и высвобождения строительного материала белков – аминокислот. Специальные цинк-зависимые ферменты убиквитин-лигазы распознают особые участки в последовательностях белков и присоединяют к этим участкам молекулы убиквитина. Присоедение четырех молекул убиквитина к молекуле белка гарантирует поступление комплекса белок-убиквитин в протеосому для деградации.
В протеоме человека установлено наличие 238 Zn-содержащих белков, активность которых непосредственно связана с убиквитин-зависимой деградацией белков. В работе Громовой О.А., Торшина И.Ю. [24] суммирована известная на сегодняшний день информация о взаимосвязи наследственно обусловленного снижения активности этих белков с соответствующими патологиями развития. Большинство цинк-зависимых белков убиквитинового протеолиза являются убиквитинлигазами, которые присоединяют молекулы убиквитина к деградируемым белкам. Дефицит активности этих ферментов приводит к широкому кругу патологий развития, включая нервно-мышечные, эндокринные, онкологические и ряд других. Все рассматриваемые убиквитинлигазы являются цинк-зависимыми, так как содержат регуляторные домены типа «цинковый палец», которые принципиально необходимы для активности и стабильности данной группы ферментов (рис. 2).

Заключение
В настоящее время отмечена опасная тенденция «минимизации» состава ВМК для беременных за счет удаления якобы «маловажных» микронутриентов (таких, как цинк, витаминов А, В2, РР и др.). Также «малые» пороки развития считаются «маловажными» и, что удивительно, зачастую не ассоциируются с дефицитом микронутриентов во время беременности. Проведенный анализ показал, что риск и «больших», и «малых» ВПР значительно повышается при недостаточности цинка, витамина А, рибофлавина, пиридоксина, цианкобаламина, а не только фолатов. Приводимые в настоящей работе данные доказательной медицины показывают, что компенсация дефицита каждого из этих микронутриентов – эффективное и безопасное средство профилактики врожденных пороков развития. В частности, результаты крупномасштабных интервенционных исследований ВМК элевит показали, что сочетание адекватной дозы фолиевой кислоты (800 мкг/таб.), витаминов группы В, аскорбиновой кислоты, витамином А и цинка повышает эффективность профилактики ВПР (до 90%) по сравнению с монопрепаратами фолиевой кислоты (70%). Эффективность и безопасность препарата элевит пронаталь доказана рандомизированными плацебо-контролируемыми клиническими испытаниями и подтверждается 15-летним опытом применения более чем у миллиона беременных в странах Европы [46].



