В ряде исследований последних лет продемонстрировано, что морфофункциональное состояние эндометрия вносит существенный вклад в эффективность программ экстракорпорального оплодотворения (ЭКО) [1–5]. В структуре причин женского бесплодия частота приобретенной внутриматочной патологии составляет около 50% [1, 6]. Хронический эндометрит (ХЭ) занимает первое место в структуре патологических изменений эндометрия, его распространенность у женщин с бесплодием варьирует от 2,8 до 68% [4, 7]. У пациенток с неудачными попытками ЭКО и переноса эмбриона в анамнезе частота ХЭ по разным данным составляет от 30 до 60% [7–9].
Известно, что для диагностики ХЭ проводят гистологическое исследование соскоба эндометрия на 7–10-й день менструального цикла, и ведущим критерием при этом является наличие плазматических клеток. Большинство морфологов подчеркивают обязательное выявление в строме эндометрия даже единичных плазматических клеток, которые, по их мнению, в здоровой ткани эндометрия не содержатся. В то же время выявление очаговой лимфо-лейкоцитарной инфильтрации, эозинофилов, очагового фиброза стромы, склеротических изменений стенок спиральных артерий являются лишь косвенными признаками ХЭ [10–14]. Для оценки рецептивности эндометрия исследуется биоптат эндометрия в среднюю стадию фазы секреции [15].
На данном этапе развития науки совершенствуются иммуногистохимические (ИГХ) и молекулярно-генетические критерии диагностики ХЭ. Учитывая повышенный интерес исследователей в последнее десятилетие к оценке «имплантационного эндометрия» у пациенток с бесплодием, актуальным является поиск возможных диагностических критериев ХЭ именно в этот короткий временной промежуток [11, 13, 16–18].
Принимая во внимание ведущую роль ХЭ в структуре патологии эндометрия при бесплодии, а также трудности диагностики данного заболевания, представляется актуальным дальнейший поиск универсальных маркеров которые позволяли бы при одном заборе соскоба (или биоптата) эндометрия выявить наличие воспаления в эндометрии, оценить состояние рецепторного аппарата, а также служить основой для разработки тактики прегравидарной подготовки.
Цель исследования: разработать критерии диагностики ХЭ по профилю экспрессии матричной РНК (мРНК) в эндометрии в период «окна имплантации».
Материал и методы исследования
В соответствии с целью исследования было обследовано 33 женщины с трубно-перитонеальным бесплодием (ТПБ), планирующих реализацию репродуктивной функции в программе ЭКО, обратившихся в отделение сохранения и восстановления репродуктивной функции ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. Критерии включения: ТПБ, возраст не более 37 лет; овуляторный менструальный цикл; наличие диагностических ультразвуковых критериев ХЭ (повышение эхогенности эндометрия, расширение полости матки, неровный контур эндометрия, неоднородная эхоструктура эндометрия), 2 безуспешные попытки ЭКО в анамнезе. Критерии исключения: толщина эндометрия менее 7 мм в период предполагаемого «имплантационного окна», противопоказания для проведения программы ЭКО и переноса эмбриона, гинекологические заболевания: миома матки, эндометриоз.
Для выявления мРНК генов в среднюю стадию фазу секреции, ассоциированных с ХЭ, всем 33 пациенткам в 1-ю фазу менструльного цикла были проведены гистероскопия и диагностическое выскабливание эндометрия, а также пайпель-биопсия в день предполагаемого «окна имплантации» следующего менструального цикла.
Гистероскопию выполняли с помощью жесткого 5-миллиметрового гистероскопа фирмы Karl Storz (Германия) по общепринятой методике. Для инстилляции жидкости с целью регуляции скорости потока и давления использовали аппарат HAMEUO ENDOMAT, Karl Storz. Под гистероскопическим контролем проводили диагностическое выскабливание эндометрия.
В зависимости от результатов гистологического исследования были сформированы две группы: 1-я группа (основная) из 15 пациенток, у которых при гистологическом исследовании соскобов эндометрия в фазе пролиферации обнаружены плазматические клетки; 2-я группа (сравнения) из 18 женщин, у которых плазматические клетки не были обнаружены.
Биопсию эндометрия проводили в амбулаторных условиях в день менструального цикла ЛГ+7, который определяли с помощью мочевого теста Clear Blue («Unipath Ltd», Великобритания), основанного на определении пика ЛГ в моче. С помощью аспирационной кюретки Pipelle de Cornier («LaboratorieC.C.D.», Франция) получали биоптат эндометрия, который был поделен на 2 части: для гистологического и молекулярно-генетического исследования. Гистологическое исследование проводилось в 1-м патологоанатомическом отделении ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России в соответствии с современными стандартами, изложенными в фундаментальных руководствах [19].
Материалы биоптатов эндометрия для молекулярно-генетического исследования помещали в пробирки со средой для стабилизации РНК (лизирующий растовор из комплекта реагентов «Проба-НК», ООО «НПО ДНК-Технология», Россия). В биоптатах энометрия проанализирован уровень экспрессии 39 мРНК генов (маркеров ростовых факторов: протеин, связывающий инсулиноподобный фактор роста (IGFBP)1, IGFBP2, IGFBP3, IGFBP4, сосудисто-эндотелиальный фактор роста (VEGF)A (общий и изоформа 189), гепаринсвязывающий эпидермальный фактор роста (HBEGF), инсулиноподобный фактор роста (IGF)2; цитокинов: интерлейкины (IL)1B, IL2, IL6, IL8, IL10, IL12A, IL15, IL18, лейкемия-ингибирующий фактор (LIF) и его рецптор LIFR, фактор некроза опухоли (TNF)A, трансформирующий фактор роста (TGF)B1), поверхностных маркеров клеток иммунной системы: CD45, CD56, CD68; матриксных металлопротеиназ: ММР2, ММР7, ММР8, ММР9, ММР11; генов гомеобокса: HOXA10, HOXA11, MSX1; циклооксигеназы PTGS2; эстрогенового ESR1 и прогестеронового PGR рецепторов; маркеров транскрипционных факторов: AREG, OSM; BCL2, BAX, PTEN).
Оценку уровня экспрессии мРНК проводили с помощью количественной полимеразной цепной реакции с предварительной стадией обратной транскрипции (ОТ-ПЦР) в режиме реального времени («ДНК-Технология», Россия). Реакция амплификации проводилась с помощью детектирующего амплификата ДТ-96 («ДНК-Технология», Россия).
Нормировка уровня экпрессии генов выполнена с использованием метода сравнения индикаторных циклов (метод Δ∆Cp) по четырем референсным генам HPRT1, TBP, B2M, GUSB. В качестве меры центральной тенденции выбрана медиана (Me), а в качестве интервальной оценки – верхний (L) и нижний квартили (H). Для оценки значимости межгрупповых различий применялся. U-критерий Вилкоксона–Манна–Уитни для несвязанных совокупностей. При сравнении эффективности диагностики в разные фазы менструального цикла использовали U-критерий Вилкоксона–Манна–Уитни для связанных совокупностей.
При оценке множественного влияния факторов на исход использовался метод математического моделирования путем построении бинарной логистической регрессионной модели путем обратной селекции. Оценка качества полученных моделей проводилась с помощью ROC-анализа. При этом рассчитывалась площадь под кривой (AUC), характеризующая эффективность модели. Для каждого значения AUC рассчитывался 95% доверительный интервал (CI). Для установления порогового значения (уровень cut-off) проводился пересмотр значений исследуемого параметра от максимального до минимального. Для каждого значения проводилось разделение групп с определением чувствительности и специфичности. Критерием выбора порогового значения выбрано требование максимальной суммарной чувствительности и специфичности модели.
Результаты исследования
Средний возраст женщин варьировал от 24 до 37 лет, составляя в среднем 33±3,4 года. Длительность бесплодия колебалась от 2 до 18 лет и составила в среднем 5,9±3,4 года. Все пациентки имели сохраненный овариальный резерв и овуляторный менструальный цикл. Средняя толщина эндометрия у обследованных пациенток в день предполагаемого «окна имплантации» (ЛГ+7) составила 10,2±2,2 см.
При проведнии гистероскопии у 21 (63,6%) пациентки из 33 были выявлены очаги гиперемии, неравномерная толщина и неравномерная окраска слизистой полости матки – у 14 (42,4%) и 9 (27,3%) женщин соответственно, усиленный сосудистый рисунок – у 7 (21,2%) пациенток. Сочетание 2 гистероскопических признаков ХЭ было отмечено у 22 (66,7%) женщин, трех – у 13 (39,4%), четырех – у 4 (12,1%) женщин. То есть, гистероскопические признаки ХЭ были выявлены у 23 (69,7%) из 33 женщин.
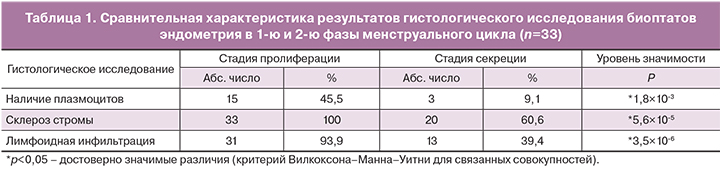
При гистологическом исследовании соскобов эндометрия плазматические клетки были обнаружены у 15 (45,5%) из 33 пациенток, склероз стромы – у всех 33 женщин, лимфоидная инфильтрация стромы – у 31 (93,9%), сочетание склероза стромы и лимфоидной инфильтрации – у 31 женщины (93,9%) (табл. 1). Таким образом, по результатам гистологического исследования в 1-ю фазу менструального цикла ХЭ был верифицирован по наличию плазматических клеток у каждой второй пациентки. У 18 (56,3%) женщин плазматические клетки отсутствовали.
Для сравнительной оценки диагностической значимости морфологического исследования эндометрия в разные фазы менструального цикла было проведено сравнение частоты выявления признаков ХЭ. У всех 33 пациенток, которым проводили гистероскопию и диагностическое выскабливание в первую фазу цикла, были проанализированы данные гистологического исследования материала, полученного при пайпель-биопсии эндометрия, проведенной во 2-ю фазу следующего менструального цикла (день ЛГ+7).
Данные, представленные в табл. 1, демонстрируют, что результаты гистологического исследования у одних и тех же пациенток в первую и во вторую фазы менструального цикла достоверно различались между собой. Так, в 33 образцах соскобов эндометрия первой фазы менструального цикла плазматические клетки, являющиеся ведущим критерием диагностики ХЭ, были выявлены у 15 пациенток (45,5%). Однако во 2-ю фазу менструального цикла (день ЛГ+7) плазматические клетки присутствовали лишь у 3 женщин (9,1%), (р=1,8×10-3). Чувствительность гистологического исследования во вторую фазу составила всего 20%. Склероз стромы был выявлен у всех 33 пациенток в пролиферативной фазе цикла, в то время как во 2-й фазе менструального цикла – только у 20 женщин (60,6%) (р=5,6×10-5). Лимфоидная инфильтрация диагностирована у 31 (93,9%) женщины в фазу пролиферации и лишь у 13 (39,4%) – в фазу секреции (р=3,5×10-6). Таким образом, морфологические признаки ХЭ в стадию пролиферации выявлялись достоверно чаще, чем в стадию средней секреции (р<0,05). Полученные нами данные продемонстрировали неэффективность гистологического исследования в период «окна имплантации».
Очевидно, для одновременной оценки параметров имплантационного эндометрия и выявления признаков ХЭ во второй фазе менструального цикла необходимы дополнительные диагностические тесты. Использование таких тестов является немаловажным в подготовке пациенток с бесплодием к программе ЭКО, так как позволяет существенно снизить количество инвазивных диагностических процедур и уменьшить длительность обследования.
На следующем этапе работы были использованы молекулярно-генетические методы исследования. Были сформированы две подгруппы в зависимости от результатов гистологического исследования в фазу пролиферации:
- 1-я подгруппа из 15 пациенток, у которых при гистологическом исследовании соскобов эндометрия в фазе пролиферации обнаружены плазматические клетки, что соответствовало «полному морфологическому комплексу ХЭ»;
- 2-я подгруппа из 18 женщин, у которых при гистологическом исследовании соскобов эндометрия в фазе пролиферации плазматические клетки не были обнаружены, что соответствовало «неполному морфологическому комплексу ХЭ».
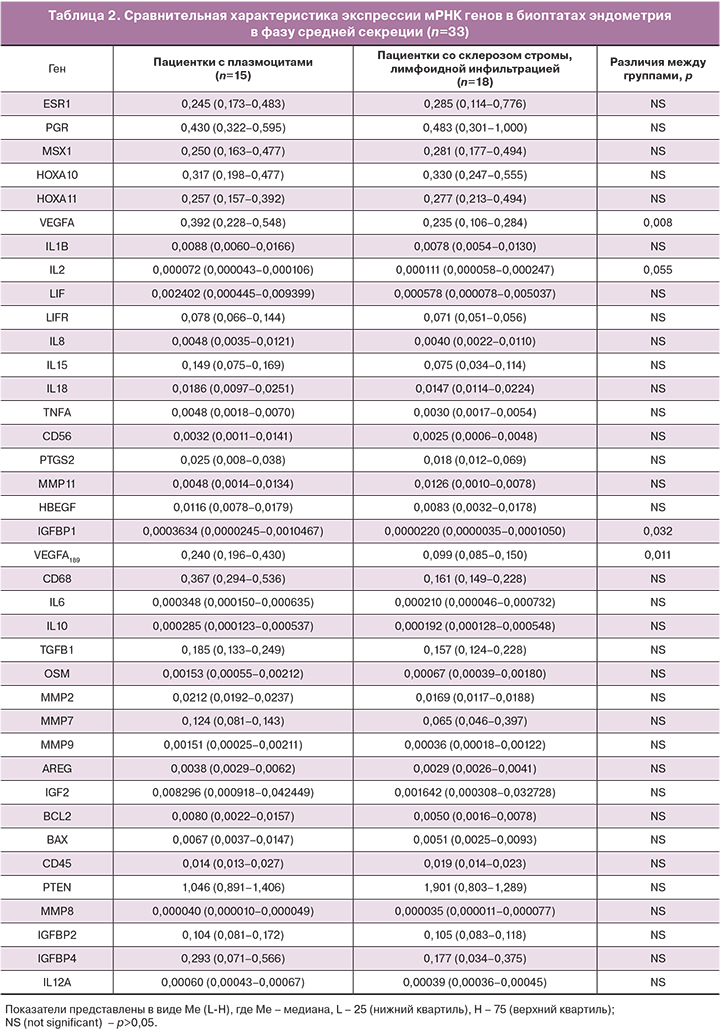
Анализ экспрессии мРНК 39 генов показал, что уровень экспрессии мРНК только 4 генов (ростовых факторов: VEGFA, VEGFA189, IGFBP1 и цитокина IL2) у пациенток с плазмоцитами достоверно различался с уровнем экспрессии мРНК генов при их отсутствии (табл. 2).
Для оценки диагностической значимости молекулярно-генетических маркеров в биоптатах эндометрия при ХЭ был проведен многофакторный регрессионный анализ, по результатам которого был выбран единственный независимый информативный маркер VEGFA, позволяющий диагностировать наличие ХЭ во 2-ю фазу цикла.
Согласно проведенному ROC-анализу, высокий уровень экспрессии мРНК VEGFA ассоциирован с наличием плазматических клеток в 1-й фазе менструального цикла. Пороговым значением выбран уровень экспрессии, равный 0,250. Площадь под кривой составила 0,778 (0,612–0,943). Чувствительность и специфичность модели в области порогового значения составили 64 и 89% соответственно.
Обсуждение
При проведнии гистероскопии признаки ХЭ были выявлены у 23 (69,7%) из 33 женщин. При этом по данным гистологического исследования в 1-ю фазу менструального цикла ХЭ был верифицирован по наличию плазматических клеток у каждой второй пациентки. У 18 (56,3%) женщин плазматические клетки отсутствовали.
Полученные нами данные согласуются с результатами ретроспективного исследования E. Cicinelli и соавт. 2014 года, в котором изучали распространенность ХЭ у пациенток с неудачными попытками ЭКО в анамнезе. Из 106 обследованных пациенток явления ХЭ по данным гистероскопии были выявлены у 70 женщин (66%), по данным культурального исследования из полости матки – у 48 женщин (45 %) и только у 61 (57,5%) женщины диагноз ХЭ был подтвержден при гистологическом исследовании. У 36 пациенток с неудачными попытками ЭКО ХЭ выявлен не был [17].
Аналогичные данные были получены Rui Yang и соавт. в 2014 году при сравнении гистологического и гистероскопического методов исследования для выявления патологических изменений полости матки и эндометрия у пациенток с неудачными попытками ЭКО. При обследовании 202 пациенток явления ХЭ по данным гистероскопии (микрополипы, гиперемия, неравномерная толщина и неравномерная окраска слизистой полости матки) были выявлены в 63,3% случаев, в то время как, согласно гистологическим критериям, ХЭ был выявлен только в 43,6% случаев. Чувствительность и специфичность гистероскопии составила 35,2 и 67,5% соответственно [20].
Анализ экспрессии мРНК 39 генов в эндометрии в среднюю стадию фазы секреции показал, что уровень мРНК только 4 генов (ростовых факторов: VEGFA, VEGFA189, IGFBP1 и цитокина IL2) у пациенток с плазмоцитами достоверно различался с уровнем мРНК генов при их отсутствии. Кроме того, согласно проведенному ROC-анализу, высокий уровень экспрессии мРНК VEGFA ассоциирован с наличием плазматических клеток в 1-й фазе менструального цикла.
Сходные данные были получены И.Б. Манухиным и соавт. в 2014 году при ИГХ исследовании параметров имплантационного эндометрия при ХЭ. Авторами выявлено, что воспалительные изменения в эндометрии характеризовались высоким уровнем VEGF. При этом наибольшая экспрессия наблюдалась на 5–7-й день менструального цикла, а наименьшая – на 19–21-й. Интенсивность экспрессии VEGF в первой и второй фазах менструального цикла превышала аналогичные показатели пациенток контрольной группы [2].
Наши результаты согласуются и с данными, полученными в исследовании А.В. Шуршалиной (2007 г.), в котором проанализированы морфологические и ИГХ особенности эндометрия при ХЭ с использованием панели из 12 маркеров по сравнению с неизмененным эндометрием. Было выявлено статистически значимое повышение маркера ангиогенеза VEGF в 9,5 раза (р<0,001) и число макрофагов CD68 в 2 раза (р<0,001), по сравнению с контрольной группой. Кроме того, корреляционный анализ выявил связь между CD138 (маркер плазматических клеток) и VEGF (r=0,84; р<0,001). Было выявлено повышение более чем в 4 раза регулятора воспалительного процесса фактора роста TNFα, а также числа больших гранулярных лимфоцитов CD56 по сравнению с контрольной группой (р<0,05), что, по мнению авторов, может являться причиной нарушения имплантации [16]. В нашем исследовании также прослежено повышение мРНК генов TNFα и CD56 у пациенток с ХЭ, однако статистически значимых различий выявлено не было. Важно отметить, что биопсия эндометрия в исследовании А.В. Шуршалиной проводилась на 7–10-й день менструального цикла.
Так же, как и в нашем исследовании, C. Di Pietro и соавт. в 2013 году сравнивали во время «окна имплантации» в эндометрии профиль экспрессии из 25 генов, кодирующих белки, которые участвуют в воспалительной реакции, пролиферации и апоптозе, с помощью ОТ-ПЦ в режиме реального времени. Исследование показало, что у пациенток с ХЭ значительно изменена экспрессия генов, кодирующих провоспалительные цитокины, факторы роста и процессы апоптоза. Так, экспрессия IGFBP1, BCL2 и BAX была повышена, а экспрессия IL11, CC14, IGF1 и каспазы (CASP)8 – снижена [18]. В нашем исследовании уровень экспрессии мРНК гена IGFBP1 также был повышен в 16,6 раза (р=0,032) у пациенток с ХЭ, однако статистически значимые различия в уровне экспрессии мРНК генов BCL2 и BAX между группами нами выявлены не были.
Выводы
- Для эндометрия средней стадии фазы секреции при наличии плазмоцитов характерно увеличение мРНК VEGFA в 1,7 раза, VEGFA189 – в 2,4 раза, IGFBP1 – в 16,6 раза, CD68 – в 2 раза, а также снижение экспрессии мРНК гена IL2 в 1,5 раза по сравнению с пациентками, у которых плазмоциты отсутствуют.
- Экспрессия мРНК гена VEGFA (>0,250) в среднюю стадию фазы секреции ассоциирована с наличием ХЭ (чувствительность 64%, специфичность 89%).



