Проблема диагностики и лечения врожденных пороков центральной нервной системы (ЦНС) продолжает оставаться чрезвычайно актуальной в медицинском и социальном аспектах, несмотря на выдающиеся достижения в области медицины последних десятилетий. Заболевания нервной системы занимают 1-е место среди причин инвалидности у детей, при этом чаще всего встречаются аномалии, связанные с дефектами нервной трубки, уступающие лидирующее место лишь детскому церебральному параличу. Частота дефектов нервной трубки в среднем составляет 1 случай на 1000 новорожденных [1]. Используемое в последние годы сочетание ранней пренатальной диагностики с помощью сывороточных маркеров и эхографической визуализации плода и профилактики в виде дородового приема фолиевой кислоты способствовало снижению количества рождения детей с аномалией нервной трубки на 20–50% [2–4]. При этом данные пороки не искоренены полностью; это подчеркивает тот факт, что не все формы дефектов нервной трубки являются фолат-предотвратимыми и что этиология, вероятно, является мультифакториальной [4–6].
Врожденные пороки развития (ВПР) нервной трубки включают в себя широкую группу нозологических форм, большинство из которых, благодаря возможностям визуальной диагностики, можно идентифицировать на ранних сроках внутриутробного развития и, в случае неблагоприятного исхода, прервать беременность. Сложнее дело обстоит с пороками, являющимися нелетальными, но приводящими к тяжелой инвалидизации ввиду выраженных неврологических нарушений. К таким порокам относятся спинномозговые грыжи (Spina Bifida) – дефект развития позвоночника в результате нарушения нейруляции на третьей и четвертой неделе внутриутробного развития. Основным проявлением данной патологии является снижение двигательной активности и чувствительности ниже уровня поражения, проявляющееся в виде парезов и параличей нижних конечностей, дисфункции тазовых органов. Наиболее распространенными пороками являются миеломенингоцеле (ММЦ) и рахишизис (РШ), входящие в состав мальформации Арнольда–Киари II типа (далее Киари II). Данный порок характеризуется выпячиванием мозговых оболочек и вещества спинного мозга через дефект отростков позвонков, наиболее часто выявляемый в пояснично-крестцовой области. Особенностью является вклинение мозжечка и ствола мозга в большое затылочное отверстие с последующим развитием гидроцефалии из-за нарушения оттока ликвора из желудочковых систем. По данным некоторых зарубежных исследований данный порок ассоциируется с такими структурными аномалиями ЦНС, как нарушение миграции нейронов, перивентрикулярная гетеротопия, дисплазия мозжечка и мозолистого тела, что увеличивает риск развития когнитивного дефицита и расстройств психики [7–15]. При данной патологии также высок и уровень неонатальной смертности, который приближается к 50%, вследствие выраженной дисфункции ствола мозга [2].
В настоящее время актуальной задачей является возможность ранней пренатальной диагностики ВПР нервной трубки. Методические рекомендации, разработанные признанными во всем мире медицинскими сообществами, такими как ISUOG, FMF, AIUM, DEGUM, позволили значительно улучшить диагностику многих хромосомных аномалий и пороков развития, в том числе и аномалий головного и спинного мозга уже в процессе пренатального скрининга первого триместра беременности [16–18]. Поиск новых возможностей раннего выявления врожденных аномалий привел многих специалистов к осознаю того, что у плода можно получать точно такие же эхографические срезы анатомических структур головного мозга, как и при нейросонографии у детей первого года жизни. Таким образом, в мировую практику пришло понятие «нейросонография» плода и вместе с этим первые результаты выявления спинального дизрафизма на основании изменения структур и положения задних отделов головного мозга у плода уже в I триместре беременности.
Лечение Киари II долгие годы заключалось в закрытии дефекта после рождения. При этом у 80–90% детей в связи с прогрессированием гидроцефалии требовалась установка вентрикуло-перитонеального шунта в течение первого года жизни. Широкое внедрение с 2010-х гг. в мировую практику внутриутробной коррекции спинномозговой грыжи позволило уменьшить выраженность гидроцефалии и снизить частоту шунтирования [19, 20].
Детальная морфометрическая оценка структур головного мозга у плодов с Киари II позволит усовершенствовать диагностику данного порока с целью выявления категории пациенток для потенциально успешной внутриутробной коррекции Spina Bifida.
Цель исследования: оценить эхографические особенности структур головного мозга у плодов с Киари II.
Материалы и методы
Проанализированы 25 случаев беременности с Киари II у плода. Все беременные прошли перинатальный консилиум на базе ФГБУ «Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России в период с января 2019 по февраль 2022 гг. Гестационный срок устанавливался по данным копчико-теменного размера плода во время ультразвукового скрининга I триместра беременности. Плодам проводились: экспертное исследование анатомии, расширенная двухмерная эхокардиография и допплерометрия. При изучении церебральных структур в I триместре беременности оценивались: в среднесагиттальной плоскости – пропорциональное соотношение структур: ствол – IV желудочек – Большая цистерна, в аксиальной плоскости – факт смещения заднего края Сильвиева водопровода к контуру затылочной кости и отсутствие визуализации IV желудочка. При уменьшении расстояния между задним контуром ствола и затылочной костью проводился диагностический поиск уровня спинального дизрафизма. Детальная оценка структур ЦНС со второго триместра беременности включала в себя изучение следующих параметров (согласно нормативным таблицам Timor-Tritsch I. et al. (2012): длина мозолистого тела (расстояние между отдаленными точками колена и валика, измеряемое в среднесагиттальном срезе), его форма, контуры и толщина в проекции колена, тела и валика [12, 13, 17]. Длина тектума (расстояние между максимально удаленными точками верхнего края – точка соединения с задней стенкой III желудочка и нижнего края – точка соединения с верхней поверхностью червя) и его положение относительно ствола мозга (рис. 1).
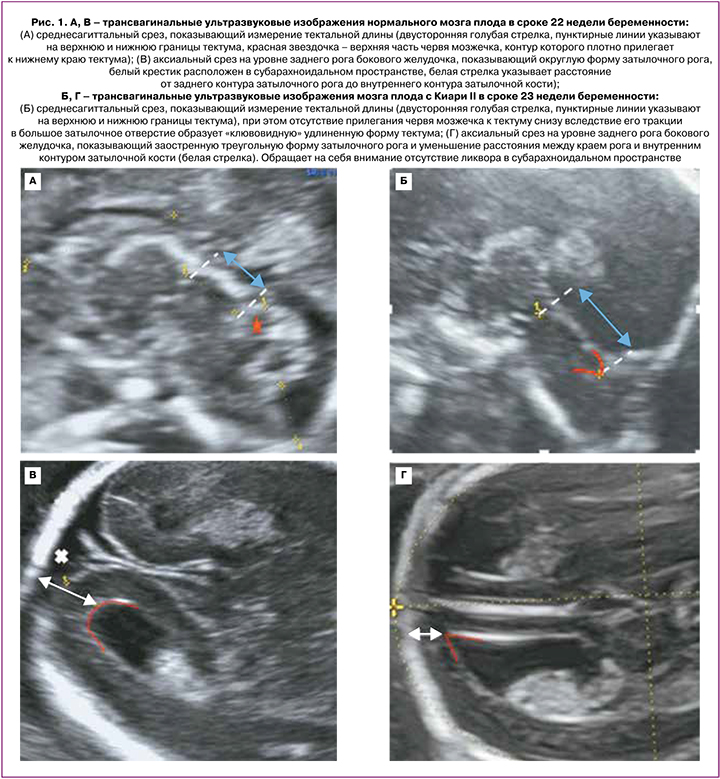
Сочетание гипо- и гиперплазии мозолистого тела, когда толщина одного анатомического сегмента находилась в диапазоне выше 95-го процентиля, а толщина другого сегмента – ниже 5-го процентиля, независимо от общей длины мозолистого тела, расценивалось как его дисгенезия. Изменение конфигурации заднего рога бокового желудочка, а именно его заострение и уменьшение расстояния между его контуром и затылочной костью расценивались как «заостренный» задний рог [7, 10]. Идентификация борозд проводилась согласно международным рекомендациям ISUOG от 2021 г. по нейросонографии с 19-й недели беременности: теменно-затылочные и Сильвиевы борозды – в аксиальном чрезжелудочковом и чрезмозжечковом срезах соответственно, шпорные борозды – в коронарном чрезмозжечковом срезе [16]. Дальнейшая динамическая оценка развития борозд, в том числе процесс формирования островковой доли, проводилась пре- и постнатально в трех ортогональных плоскостях: аксиальной, коронарной и сагиттальной [15]. Ультразвуковое исследование проводилось с помощью двухмерного конвексного датчика 3,5 МГц и конвексного 3D-датчика с частотой 5–9 МГц на аппаратах Voluson E8 (General Electric, Австрия) и Samsung Medison WS80 (Samsung Medison, Республика Корея. В 5 случаях диагностики Киари II до 14 недель беременность была прервана по месту жительства по медицинским показаниям и отказу родителей от проведения внутриутробной операции. В остальных 20 случаях по желанию родителей пролонгировать беременность в сроках 23,1–25,5 недель плодам была успешно проведена внутриутробная корреция Spina Bifida в ФГБУ НМИЦ АГП им. В.И. Кулакова. Все 20 пациенток дали информированное согласие на проведение внутриутробной операции, разработанное специалистами Центра.
Количественные параметры представлены в виде медианы, 25–75-го процентилей, минимального и максимального значений.
Результаты
Мальформация Киари II была диагностирована у 5/25 плодов в сроке 12–14 недель, у 20/25 – в сроке 19–21 недель.
В сроке 12–14 недель у всех 5 плодов были выявлены следующие церебральные особенности: аномальное количество ликвора в боковых желудочках (в 2 случаях – «сухой мозг», в 3 случаях – сосудистое сплетение занимало менее 50% просвета бокового желудочка); сужение/отсутствие визуализации водопровода мозга со смещением его заднего контура к затылочной кости; форма мозжечка – «банан» (рис. 2). Начальный уровень расположения Spina Bifida по отношению к позвоночнику визуализировался с позвонков L2–L3; при этом у 1/5 плодов было выявлено выраженное искривление позвоночника (угол 90°) (рис. 3).
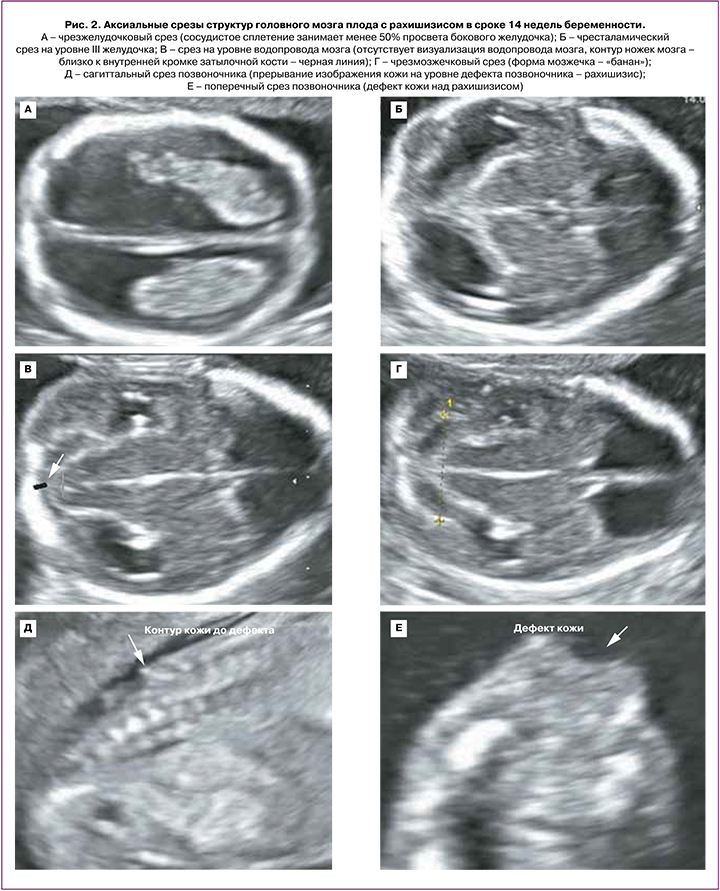
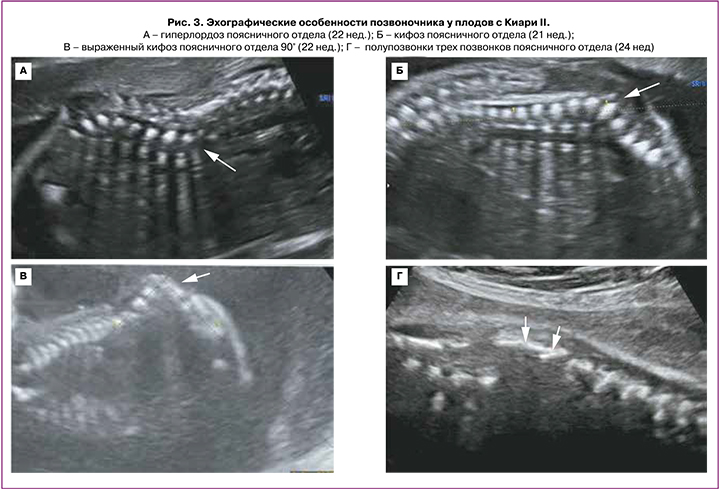
Во II триместре беременности во всех 20 случаях были выявлены общепринятые эхографические признаки Киари II: вклинение мозжечка в Большое затылочное отверстие с признаком его деформации (форма «банан»), изменение конфигурации костей черепа (форма «лимон»), вентрикуломегалия, наличие спинномозговой грыжи позвоночника. ММЦ и РШ определялись у 15/20 и 5/20 плодов соответственно. Начальный уровень расположения Spina Bifida по отношению к позвоночнику определялся у 2 плодов с позвонка T10, у 14 плодов – с L2–L3, у 4 – с L4–L5 (рис. 3). Средний срок беременности, когда проводилась детальная морфометрия церебральных структур, составил 23,9 (23,0–25,3) недель. Для 20 плодов были характерны изменения: вентрикуломегалия (10–17 мм независимо от уровня поражения спинного мозга), «клювовидный» тектум (крыша мозга), «заостренные» затылочные рога боковых желудочков, задержка формирования борозд (рис. 4, таблица). Средние значения ширины задних рогов боковых желудочков составляли: слева – 11,5 (9–16) мм, справа – 11 (5–17) мм. Дисгенезия мозолистого тела была выявлена у 3/20 пациентов. Для остальных 17 случаев было характерно незначительное укорочение длины мозолистого тела. Средние значения длины мозолистого тела составили 23,8 (14–29) мм (таблица). У половины плодов (55%) определялось дорсальное кистообразное расширение III желудочка. У 3 плодов из 20 с уровнем Spina Bifida L2–L3 была диагностирована межполушарная голопрозэнцефалия. При оценке тектума мы не выявили достоверно значимых различий в его длине по сравнению с нормативными значениями, однако у всех плодов была изменена его форма и расположение. Средние значения длины тектума составили 11,1 (9,5–14) мм. Лишь у 5/20 (25%) плодов длина тектума была более 11 мм, что соответствует более 2 стандартных отклонений для срока беременности 24–25 недель согласно исследованию Leibovitz Z. et al. [12]. У 80% (16/20) пациентов отмечалось нарушение формирования борозд островковых долей при типичном формировании остальных борозд полушарий мозга.
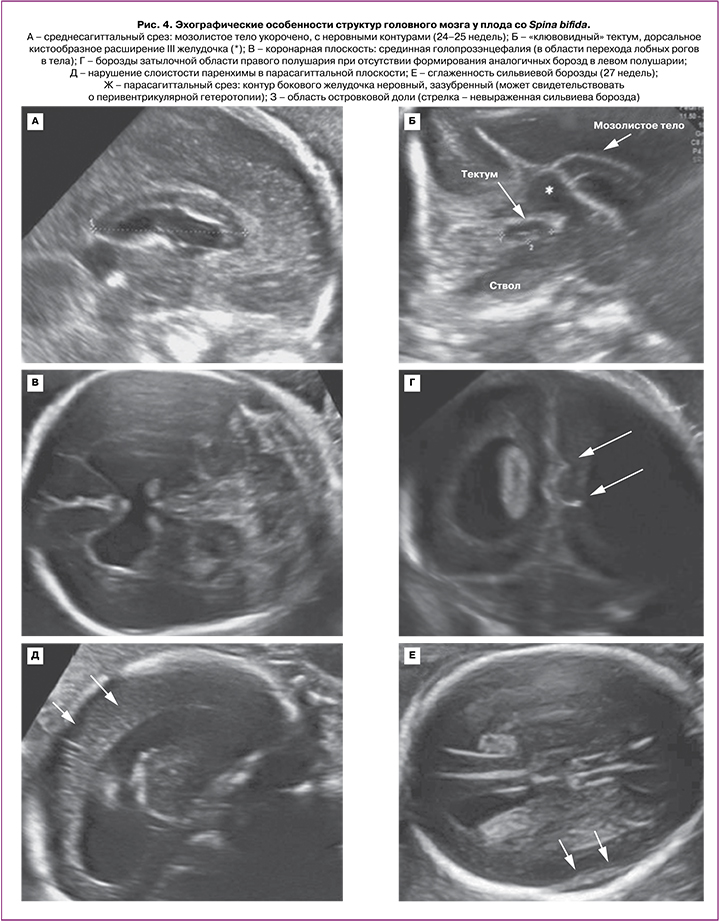
Дополнительные эхографические находки у плодов с Киари II включали: косолапость (у 4/20 плодов с ММЦ на уровне L2), удвоение матки (1/20), тазовая дистопия почки (1/20).
Обсуждение
Возможность внутриутробной коррекции Spina Bifida при мальформации Арнольда-Киари II типа привело к внедрению в пренатальную ультразвуковую диагностику расширенной нейросонографии и к разработке новых морфометрических параметров. Оценка структур головного мозга в сагиттальной и коронарной плоскостях в дополнение к аксиальной, позволяет диагностировать порок развития ЦНС уже в I триместре беременности. За последние десятилетия было разработано несколько церебральных эхографических маркеров Spina Bifida в I триместре беременности. Так, еще в 2011 г. группа австралийских ученых – Finn M. et al. выявила, что визуализация смещения заднего края Сильвиева водопровода к контуру затылочной кости является достоверным признаком вклинения задних отделов головного мозга в Большое затылочное отверстие при спинномозговой грыже [11]. Другие исследования показали, что изменение пропорционального соотношения структур: ствол – IV желудочек – Большая цистерна, визуализируемого в средне-сагиттальной плоскости, а именно уменьшение расстояния между задним контуром ствола и затылочной костью, также может говорить о наличии порока нервной трубки [17]. В нашем исследовании обнаружение вышеуказанных маркеров позволило выявить Киари II у 5 пациентов в I триместре беременности.
Учитывая тот факт, что диагностика большинства случаев Киари II приходится на II триместр беременности, применение расширенного протокола нейросонографии позволяет достоверно точно определить все морфометрические особенности инфра- и супратенториальных структур, в том числе для отбора плодов на внутриутробную коррекцию Spina Bifida. В нашем протоколе мы сконцентрировали описанные в мировой литературе диагностические приемы и маркеры данного порока, которые могут быть воспроизводимы в каждом случае. Таким образом, был установлен ряд эхографических особенностей структур головного мозга: аномалия мозолистого тела, дорсальное кистообразное расширение III желудочка, «клювовидный» тектум, «заостренный» затылочный рог бокового желудочка, межполушарная голопрозэнцефалия, задержка/аномалия формирования борозд.
Роль этих структурных аномалий в когнитивном развитии пациентов с Киари II мало изучена. У этих пациентов часто наблюдаются сложные нейропсихологические отклонения в развитии, познании темперамента и обучении, что зачастую связывают с гидроцефалией вследствие нарушения ликвородинамики [21]. Однако современные исследования с использованием магнитно-резонансной томографии демонстрируют структурные аномалии, которые нельзя объяснить одной лишь гидроцефалией. Кроме того, нейропсихологические исследования показали, что некоторые когнитивные нарушения не зависят от гидроцефалии и применения вентрикулоперитонеального шунтирования, что доказывает диспластическую природу выявленных структурных изменений [22]. С другой стороны, ряд исследований указывает на то, что часть краниальных аномалий Киари II вторична по отношению к механическим воздействиям [23, 24].
По данным нашего исследования, у всех плодов была выявлена особенность развития мозолистого тела, проявляющаяся дисгенезией, частичной агенезией и, в большинстве случаев, незначительным укорочением его длины. Обнаруженные у плодов «заостренные» задние рога боковых желудочков с уменьшением расстояния между его контуром и затылочной костью, а также межполушарные кисты (в 50% случаев), являющиеся задним и верхним продолжением третьего желудочка, подтверждают теорию дефицита белого вещества задних отделов, по сравнению с передними. Эхографическим подтверждением эмбрионально заложенной диспластической мальформации головного мозга при Киари II также является обнаруженная нами межполушарная голопрозэнцефалия у 15% (3/20) плодов.
Корковая мальформация при Киари II преобладает в задней медиальной части полушарий, где дефект белого вещества наиболее заметен. Еще в 1986 г. Gilbert et al. в патологоанатомическом исследовании 25 умерших детей с Киари II обнаружили мальформацию коры их головного мозга в 92% случаев: незрелое развитие – у 24%, нарушение слоистости паренхимы – у 24%, гетеротопию, истинное нарушение миграции нейронов – у 44%, полимикрогирию – у 40% пациентов [25]. Наиболее распространенная аномалия описывается в литературе, как стеногирия (что означает узкие извилины, от греческого stenos: узкий), характеризующаяся наличием многочисленных мелких уплотненных извилин с неглубокими бороздами, преимущественно в слаборазвитой задней медиальной части полушарий. Вышеописанные признаки согласуются с результатами нашего исследования, в котором задержка формирования борозд была выявлена в 100% случаев. Кроме того, у 80% плодов была выявлена аномальная сулькация островковых долей, подтвержденная постнатально, что не было ранее описано в мировой литературе.
Другой характерной особенностью мозговой организации при Киари II является изменение конфигурации «крыши» мозга – тектума, отвечающего за зрительные и слуховые рефлексы и коррелирующего, по некоторым данным, с выраженностью глазодвигательных нарушений при Spina Bifida [8]. В 2014 г. Leibovitz Z. et al. применили разработанные ими нормограммы среднего (midbrain) и заднего (hindbrain) отделов мозга у плодов с аномалией задней черепной ямки, в том числе с Киари II, и выявили ряд особенностей: удлинение тектума с формированием «клюва» и уменьшение переднезаднего диаметра среднего мозга более чем на 2 стандартных отклонения [12, 13]. В нашем исследовании у всех плодов с Киари II был выявлен «клювовидный» тектум. Однако в большинстве случаев размеры данной структуры не выходили за пределы нормативных значений. Лишь в четверти случаев длина тектума была увеличена и составляла более 12 мм, что выходило за рамки двух стандартных отклонений по нормативной шкале, разработанной Leibovitz Z. et al.
Заключение
Таким образом, выявленные в ходе нашего исследования эхографические особенности структур головного мозга плодов с Киари II имеют важное значение при отборе кандидатов на внутриутробное вмешательство и интерпретации результатов послеоперационного динамического исследования мозга плода. Ассоциированые с Киари II аномалии ЦНС не являются критериями исключения для внутриутробной коррекции Spina Bifida.



