В структуре гипертензивных расстройств среди беременных женщин частота преэклампсии (ПЭ) составляет от 2 до 8% [1]. ПЭ – это мультисистемное патологическое состояние, клинически проявляющееся после 20-й недели беременности и характеризующееся артериальной гипертензией (АГ) в сочетании с протеинурией (>0,3 г/л в суточной моче), отеками и проявлениями полиорганной недостаточности [1, 2]. Патогенез ПЭ на сегодняшний день остается не до конца изученным, и значимых успехов в прогнозировании, профилактике и лечении пока не достигнуто [3, 4]. Возможно, это объясняется тем, что ПЭ является конечным клиническим проявлением различных по своему происхождению расстройств. Тяжелая ПЭ часто сочетается с синдромом задержки роста плода (ЗРП), тогда как при умеренной ПЭ плод характеризуется нормальными массово-ростовыми показателями [5, 6]. Ряд исследователей уделяют большое внимание изучению плаценты и роли иммунологической толерантности в генезе ПЭ [5, 7–9]. Одними из важных звеньев врожденного иммунитета, связанных с регуляцией уровня воспалительных реакций организма, являются толл-подобные рецепторы (TLRs); при связывании TLRs с лигандами происходит индукция ключевых провоспалительных факторов и нарушение иммунологической толерантности [10, 11]. Наименее изученным классом TLRs является TLR8. Кроме того, считается, что TLR8 связан с аутоиммунными заболеваниями и системным воспалительным ответом [8, 12–14].
Цель исследования – выявить ультраструктурные и иммуногистохимические особенности плаценты при ПЭ в сочетании с ЗРП.
Материалы и методы
Выполнен клинико-анамнестический анализ данных 33 женщин на сроке 26–39 недель гестации, подвергнутых оперативному родоразрешению, соответствующих критериям включения и подписавших добровольное информированное согласие на участие в исследовании. У 15 пациенток диагностировали тяжелую ПЭ, у 8 беременных – умеренную ПЭ. Группу контроля составили 10 рожениц с неосложненной доношенной беременностью. У 6 женщин из группы тяжелой ПЭ отмечалась ЗРП.
Критерии включения в группу с умеренной ПЭ и тяжелой ПЭ были определены в соответствии с принятыми рекомендациями [1, 2].
Критериями включения в группу с тяжелой ПЭ, осложненной ЗРП, было наличие сочетания ПЭ с ЗРП II и III степени (масса плода менее 5 перцентилей) [1, 12].
Критериями включения в группу контроля явились: неосложненная доношенная беременность, родоразрешение путем кесарева сечения (КС) по поводу рубца на матке после ранее выполненных оперативных вмешательств, неправильного положения плода, анатомически узкого таза, прогрессирующей миопии высокой степени тяжести. Таким образом, были сформированы 4 группы.
Критериями исключения из всех групп явились острые и хронические воспалительные заболевания, тяжелая экстрагенитальная патология, многоплодная беременность, применение вспомогательных репродуктивных технологий (ВРТ), состояние после трансплантации внутренних органов, онкологические заболевания в анамнезе, сахарный диабет (СД), врожденные пороки развития плода, самопроизвольное родоразрешение.
На серийных парафиновых срезах было выполнено гистологическое (окраска гематоксилином и эозином) и иммуногистохимическое исследование. Иммуногистохимия выполнена посредством иммуностейнера закрытого типа (Ventana; Roche, UK) с закрытым набором для детекции с применением первичных поликлональных антител к TLR8 (1:250; кат. номер GTX2120; GenTex) [15]. Негативный и положительный контроль был поставлен в соответствии с рекомендациями фирмы-производителя. Продукт иммуногистохимической реакции визуализировался в виде коричневого окрашивания мембраны и цитоплазмы клеток. При количественной оценке нами было оценено мембранное и цитоплазматическое окрашивание в синцитиотрофобласте (СЦТ) и синцитиальных почках, или узелках (СУ) в условных единицах при помощи системы анализа изображения на базе микроскопа Nikon Eclipse с использованием программного обеспечения (NIS-Elements, Чехия). В каждом образце было оценено не менее 20 полей зрения при увеличении ×400. Для удобства представления данных все данные были умножены на 100.
Кроме того, посредством электронного микроскопа были исследованы 10 образцов плаценты и на ультраструктурном уровне определено состояние СЦТ и СУ ворсин плаценты. Для трансмиссионной электронной микроскопии брали фрагменты плаценты размером 1 мм3 из толщи плацентарного диска через 2–5 минут после КС. Материал фиксировали в растворе 2,5% глутарового альдегида и 1% параформальдегида в 0,1 М фосфатном буфере (рН 7,4) и дофиксировали в 1,5% растворе OsO4, обезвоживали, заливали в аралдит. Полутонкие срезы окрашивали по методу ШИК с докраской метиленовым синим. Ультратонкие срезы контрастировали уранилацетатом и цитратом свинца и исследовали под электронным микроскопом Philips CM100 (Philips/FEI Corporation, Eindhoven, Holland).
Статистическая обработка полученных данных проведена в пакете программ SPSS Statistics for Windows v. 21. Учитывая малый объем выборки для статистического анализа, была приведена оценка нормальности распределения данных при помощи теста Колмогорова–Смирнова. Выборка отлична от нормального распределения. В данной работе использовались непараметрические методы статистического анализа. Для описания количественных данных оценивались медианы и квартили (Me (Q1;Q3)). Для оценки различий в 4 группах использовался непараметрический метод статистического анализа с применением критерия Краскела–Уоллиса.
Результаты
При сравнении включенных в исследование женщин выявлено статистически значимое различие среднего возраста беременных с ПЭ 33(28;39) года и группы контроля (27 (25;32) лет (р=0,01)). Данное наблюдение указывает на возможную связь развития ПЭ с возрастом женщины. Между группами тяжелой и умеренной ПЭ значимых различий отмечено не было. При сравнительном анализе сроков родоразрешения в обследованных группах отмечено, что имеются достоверные различия между группами тяжелой ПЭ и контрольной группой (р<0,02). Так, срок родоразрешения в группе с тяжелой ПЭ составлял 35 (32;38) недель, что было статистически ниже, по сравнению с группой контроля 39 (36;40) недель (р=0,02). Необходимость экстренного досрочного родоразрешения в группе с тяжелой ПЭ была чаще обусловлена выраженными нарушениями состояния плода по данным допплерометрии и нарастанием тяжести ПЭ на фоне проводимой антигипертензивной терапии.

При анализе микропрепаратов отмечено наличие продуктов иммуногистохимической реакции TLR8 в мембране и цитоплазме цитотрофобласта, CЦТ и СУ, в децидуальных клетках, в амниотическом эпителии, эндотелии кровеносных сосудов, макрофагах (клетки Кащенко–Гофбауэра), а также в клетках стромы ворсин. При количественной оценке установлено, что уровень экспрессии TLR8 при тяжелой ПЭ, осложненной ЗРП, составил: в СЦТ — 69 (55;77) и 77 (71;81) и в СУ – 66 (59;73) и 70 (62;75), мембранное и цитоплазматическое окрашивание соответственно, что было значимо выше, чем во всех остальных исследуемых группах (р<0,01) (рис. 1, А–Б). Наряду с этим, в контрольной группе мембранное и цитоплазматическое окрашивание было минимальным – в СЦТ – 17 (12;20) и 15 (11;21) и в СУ – 17 (11;20) и 16 (11;20) соответственно; р=0,04 (рис. 1, В–Г; рис. 2, А–Г). Та же тенденция присутствовала и при умеренной ПЭ – преобладание мембранного окрашивания в СЦТ и СУ. Соотношение мембранного окрашивания к цитоплазматическому в СЦТ составило по группам: тяжелая ПЭ в сочетании с ЗРП – 0,8 (0,4;1,3), тяжелая ПЭ без ЗРП – 0,8 (0,6;1,1), умеренная ПЭ – 1,4 (1,1;1,7) и в контроле – 1,3 (0,9;1,4). Аналогичная тенденция отмечена при анализе типа окрашивания в СУ: при тяжелой ПЭ – 0,7 (0,5;1,0), при умеренной ПЭ – 1,3 (0,9;1,5) и в группе контроля – 1,1 (0,8;1,4) (p=0,04), в группе тяжелой ПЭ с ЗРП – 1,0 (0,8;1,4).
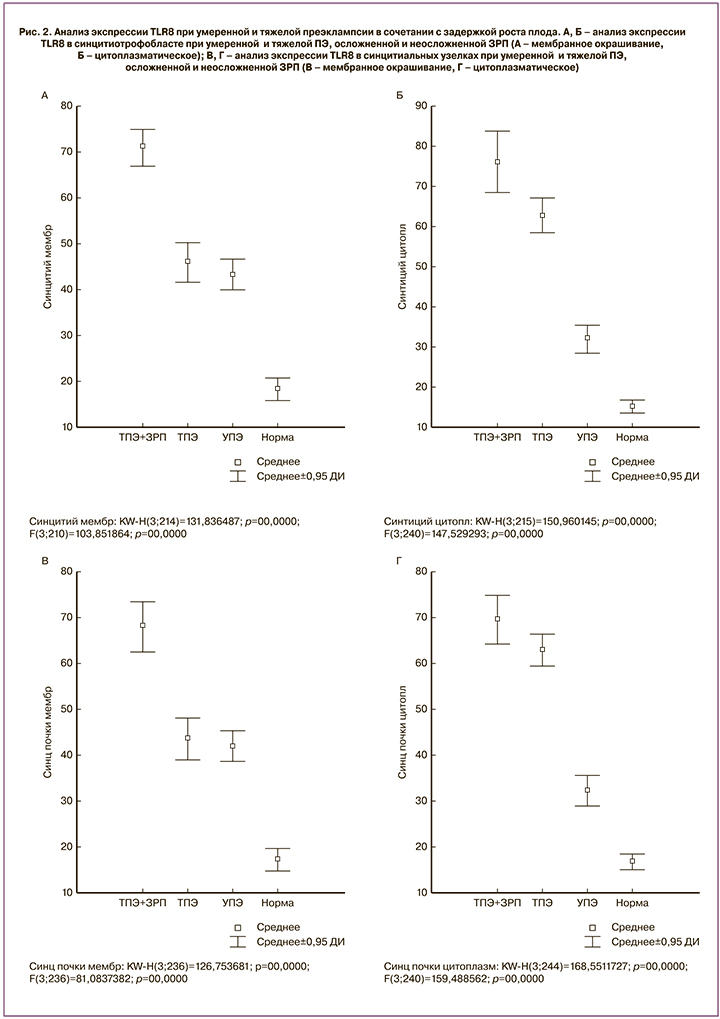
Таким образом, для умеренной ПЭ и неосложненной доношенной беременности характерно преобладание в СЦТ и СУ мембранного окрашивания TLR8 над цитоплазматическим, а при тяжелой ПЭ – преобладание цитоплазматического окрашивания над мембранным (p<0,03), что может быть связано с переходом к состоянию декомпенсации.
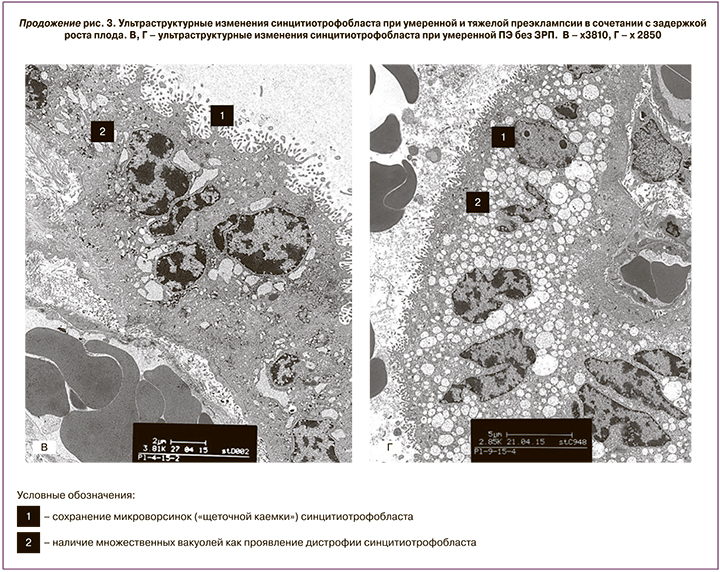
При анализе данных трансмиссионной электронной микроскопии было отмечено, что при физиологической беременности на поверхности СЦТ ворсин наблюдались микроворсинки (по типу щеточной каемки). В цитоплазме СЦТ обнаружены мелкие вакуоли, образованные цистернами гранулярного эндоплазматического ретикулума (рис. 3, А–Б). При умеренной ПЭ на поверхности СЦТ микроворсинки сохранялись, в некоторых участках мембрана СЦТ образовывала выпячивания с микроворсинками. Характерным изменением ультраструктуры СЦТ при умеренной ПЭ стало появление в цитоплазме многочисленных вакуолей разного размера, образованных за счет набухания и дилатации цистерн гранулярного эндоплазматического ретикулума. За счет этих изменений высота СЦТ увеличивалась в 1,3 раза, по сравнению с контролем (рис. 3, В–Г). У пациенток с тяжелой ПЭ изменения ультраструктуры СЦТ заключались в значительной конденсации хроматина ядер и редукции числа микроворсинок на поверхности. Оставшиеся микроворсинки были деформированы и имели причудливую форму. В цитоплазме СЦТ выявлено скопление вакуолей разного размера, обнаружены признаки дистрофических изменений – миелиноподобные тельца, фагосомы, повреждение апикальных участков СЦТ, а также наличие апоптотических телец и очаговая десквамация СЦТ (рис. 3, Д). Снижение мембранного окрашивания TLR8 в СЦТ и СУ при тяжелой ПЭ может объясняться редукцией числа микроворсинок. В то же время при ПЭ, осложненной ЗРП, мембраны и апикальные отделы СЦТ и СУ были частично сохранены, хотя множественные вакуоли в цитоплазме присутствовали (рис. 3, Е).


Обсуждение
В последние годы представления о ПЭ трансформировались от заболевания периода беременности, характеризующегося сочетанием почечной патологии и гипертензии, до гетерогенного мультисистемного расстройства, оказывающего влияние на состояние здоровья матери и ребенка в течение последующей жизни. Женщины, имеющие ПЭ в анамнезе, входят в группу высокого риска развития ишемической болезни сердца, других сосудистых заболеваний, включая гипертоническую болезнь, инсульт, венозные тромбоэмболии, почечную недостаточность, СД 2 типа, гипотиреоз [7, 8, 11, 16, 17].
По данным ряда исследований, миозин повышается в крови у пациентов с кардиоваскулярной патологией [17–21]. Кроме того, наряду с фрагментами молекул ДНК и малыми интерферирующими РНК (siRNA), он является ключевым лигандом для TLR8 [9, 17, 22–25]. При повреждении миокарда и стенок сосудов молекулы миозина, попадая в кровь, запускают TLR8-рецепторы, активируя воспалительные каскады на моноцитах, опосредуя развитие системного воспалительного ответа [24–26], что приводит к формированию порочного круга и прогрессированию заболевания. Как было показано, повышенный уровень в кровотоке матери миозина (лиганда TLR8) может явиться стартовым механизмом у пациенток с сердечно-сосудистой патологией [6], и по аналогии с этим тяжелая ПЭ также может протекать на фоне повышения миозина и опосредовать развитие системного воспалительного ответа.
Полученные результаты исследования позволяют предположить, что при быстром и молниеносном развитии ПЭ происходит тотальное разрушение и повреждение мембран СЦТ, развивающееся в течение короткого промежутка времени. Тогда как при тяжелой ПЭ, осложненной ЗРП, данный процесс растянут во времени, включаются механизмы компенсации, при истощении которых наступает декомпенсация, которая может нарастать не резко, а постепенно, поэтому возможно, что часть мембран СЦТ и СУ может быть сохранена. То есть функциональная компенсация плацентарного барьера переходит в декомпенсацию и спустя определенное время приводит к ЗРП с полной декомпенсацией системы «мать–плацента–плод».
Следует отметить, что увеличение количества СУ является выражением компенсаторных изменений, направленных на улучшение обмена между организмом плода и матери. СУ являются очагами пролиферации СЦТ в виде тесно расположенных ядер, окруженных общей цитоплазмой и расположенных на поверхности ворсин хориона [27]. Наряду с этим, СУ ассоциированы с апоптозом СЦТ, что особенно выражено при акушерской патологии и доказывается данными иммуногистохимических исследований, электронной микроскопией [28, 29].
Кроме того, СУ синтезируют большой спектр биологических веществ, гормонов, включая хорионический гонадотропин и микроРНК [12, 30], которые затем поступают в материнский кровоток и обеспечивают поддержание физиологического течения беременности. Дистрофические изменения и неполноценность СУ при тяжелой ПЭ ведут к ускоренному снижению компенсаторных возможностей плаценты и плацентарной недостаточности. Доказано, что снижение количества СУ нередко ассоциировано с ЗРП [12]. Учитывая, что СЦТ формирует гемоплацентарный барьер, его повреждение опосредует развитие плацентарной недостаточности [31], а повреждение СУ обусловливает снижение способности трофобласта к инвазии.
Повреждение мембран СЦТ, по нашему мнению, определяет нарушение маточно-плацентарной перфузии и плацентарную недостаточность с резким ухудшением состояния плода, что часто приводит к досрочному родоразрешению. Однако нельзя исключить, что высокий провоспалительный ответ трофобласта, а также экспрессия TLR8 ведут к активации воспалительных каскадов и являются причиной ЗРП. Наряду с этим, сохранение мембранного окрашивания при тяжелой ПЭ в сочетании с ЗРП, свидетельствует, вероятно, о частичном сохранении компенсаторных возможностей плаценты.
Принимая во внимание, что СУ синтезируют большой спектр биологически активных веществ, поддерживающих нормальную гестацию, их неполноценность может быть дополнительным фактором снижения компенсаторных возможностей плаценты. На фоне этого разработка терапии, основанной на понимании различий в течении тяжелой ПЭ, может иметь точку приложения, направленную на сохранение и регенерацию трофобласта и, вероятно, будет способствовать сохранению и пролонгированию беременности.
Заключение
Таким образом, при тяжелой ПЭ выявлена высокая экспрессия TLR8 в СЦТ. Для тяжелой ПЭ характерно преобладание цитоплазматического окрашивания TLR8, а для умеренной ПЭ – мембранного окрашивания. Кроме того, тяжелая ПЭ ассоциирована с повреждением мембран СЦТ, что ведет к резкому нарушению гемоплацентарного барьера и плацентарной недостаточности.



