По данным разных авторов, эндометриоз встречается у 10-16% женщин раннего репродуктивного возраста, проявляется хронической тазовой болью, дисменореей и бесплодием в дальнейшем [1]. Точная распространенность эндометриоза у подростков неизвестна, но как минимум у 2/3 девочек с хронической тазовой болью, сохраняющейся на фоне применения нестероидных противовоспалительных препаратов (НПВП) или комбинированных оральных контрацептивов (КОК), при диагностической лапароскопии выявлен эндометриоз в малом тазу [1]. В настоящее время наблюдается омоложение тяжелых форм распространенного эндометриоза, значимо снижающего качество жизни пациенток, требующих зачастую повторных серьезных оперативных вмешательств, в том числе в раннем репродуктивном возрасте. Несмотря на распространенность этого заболевания, алгоритм лечения на сегодняшний день не до конца разработан, что делает вопрос поиска адекватной терапии особенно актуальным.
Несмотря на отсутствие единого мнения по вопросу лечения эндометриоза, медицинское сообщество сходится в следующих положениях: терапия должна быть подобрана индивидуально с учетом особенностей течения заболевания, тяжести симптомов, потребности в контрацепции [2]. Принципы медикаментозного лечения эндометриоза универсальны для всех пациенток в репродуктивном возрасте, в том числе в раннем репродуктивном периоде, к которому относятся подростки после менархе, согласно классификации STRAW+10 [3]. Нет единого мнения относительно длительности и подходов к терапии эндометриоза с подросткового возраста. При этом терапия имеющимися на сегодняшний день медикаментозными средствами направлена на подавление пролиферации и атрофию эндометриальной ткани, в лечении применяется «пошаговый» подход.
Подходы к терапии эндометриоза и группы лекарственных средств
На сегодняшний день нет достаточных результатов возможности этиотропной терапии эндометриоза; в качестве симптоматической выступают НПВП и КОК, в качестве патогенетической — средства на основе прогестагенов, агонистов гонадотропин- рилизинг-гормона (аГнРГ), ингибиторы ароматазы, синтетические андрогены, модуляторы активности прогестероновых (SPRM) и эстрогеновых рецепторов (SERM) [2] (рис. 1). Также рассматривается возможность применения в качестве патогенетической терапии высокоселективных противовоспалительных средств, воздействующих на цитокин-зависимые процессы в развитии эндометриоидных очагов, и ряда других лекарственных веществ.

Клинические рекомендации разных стран и организаций включают противоречивые данные по поводу того, какие лекарственные средства должны быть отнесены к первой линии гормональной терапии эндометриоза. Согласно клиническим рекомендациям 2013 г., Европейское общество репродукции человека и эмбриологии (ESHRE) относит к первой линии терапии эндометриоза прогестагены и аГнРГ, имеющие уровень доказательности А, а КОК с уровнем доказательности В — ко второй [4]. Американское общество репродуктивной медицины допускает в равной степени в качестве первой линии гормональной терапии применение КОК, прогестинов, аГнРГ [5].
Клинические рекомендации по эндометриозу Российского общества акушеров и гинекологов (РОАГ), утвержденные Министерством здравоохранения Российской Федерации в 2020 г., относят к первой линии гормональной терапии эндометриоза прогестагены. При неэффективности подобной терапии средствами выбора являются аГнРГ, искусственные андрогены, ингибиторы ароматазы. Однако их применение у молодых пациенток репродуктивного возраста нежелательно ввиду развивающейся на их фоне гипоэстрогении, аменореи, гепатотоксичности и ряда других побочных реакций [6]. По данным клинических рекомендации РОАГ, КОК в лечении дисменореи при эндометриозе рассматриваются у пациенток, которым требуется контрацепция, и в качестве противорецидивной терапии после оперативного лечения эндометриоза, в том числе эндометриоза яичников.
Помимо вышеперечисленного, в качестве перспективных средств для лечения эндометриоза рассматриваются SERM и SPRM [7-9]. Кроме того, имеются данные о возможности применения метформина [10], каберголина [11, 12], статинов, мелатонина и др. [9, 13], эффективность которых в настоящее время не является полностью обоснованной. Также на сегодняшний день все большую актуальность приобретает изучение этиопатогенетической таргетной терапии, воздействующей на провоспалительные цитокины и факторы роста, ответственные за развитие эндометриоидных очагов.
Важно также отметить, что для исследования эффективности и безопасности препаратов, внедрения их использования в клиническую практику у рассматриваемой группы пациенток раннего репродуктивного возраста существует и юридический аспект безопасности и приемлемости назначения препаратов и проведения клинических испытаний. Многие пациентки с эндометриозом являются несовершеннолетними, и применение в их лечении ряда рекомендованных лекарственных средств для взрослых пациенток официально не разрешено инструкциями препаратов. Назначение препаратов off-label требует подписания законным представителем несовершеннолетней пациентки добровольного информированного согласия, что также должно учитываться специалистами при ведении этой категории пациенток.
Нестероидные противовоспалительные средства
Применение НПВП в качестве 1-й линии эмпирической терапии крайне распространено и признается медицинским сообществом оправданным в отношении
как первичной, так и вторичной дисменореи, ассоциированной с эндометриозом. Несмотря на то, что ряд клинических рекомендаций относят курс НПВП в течение 3-6 месяцев к 1-й линии терапии, подобная тактика малоэффективна, поскольку эта группа лекарственных средств не способствует элиминации эктопических очагов эндометрия. Она оправдана в первую очередь для дифференциальной диагностики первичной дисменореи и вторичной, ассоциированной с эндометриозом [14]. Обновленный обзор Кокрейн от 2017 г. подтверждает данные о том, что с 2009 г. не было опубликовано новых исследований, позволяющих говорить о высоком уровне доказательности применения НПВП для купирования болевого синдрома при эндометриозе [15]. Неэффективность препаратов в снижении дисменореи и другой болевой симптоматики в течение 3-6 месяцев рассматривается как подозрение на наличие эндометриоза и является поводом для смены терапии на патогенетическую при эндометриозе [14].
Комбинированные оральные контрацептивы
КОК — лекарственные средства, содержащие различные количества эстрогенового компонента (преимущественно этинилэстрадиола) и один из гестагенов. Помимо своего основного механизма действия (подавление овуляции), они оказывают важный в терапии эндометриоза эффект — индуцируют в эндометрии процесс децидуализации, ведущий к его атрофии [5]. Данные препараты в непрерывном режиме приема в настоящее время определены, по данным ряда клинических рекомендаций, в виде 1-й линии эмпирической терапии дисменореи (степень доказательности В), в том числе в раннем репродуктивном возрасте, наряду с НПВП. Однако обе группы лекарственных средств не являются патогенетическими для лечения эндометриоза, поскольку не индуцируют атрофию эктопических очагов эндометрия [2, 3]. Кроме того, нельзя исключить, что КОК, оказывая положительный клинический эффект в виде снижения степени дисменореи и диспареунии [15], могут маскировать дальнейшее прогрессирование заболевания.
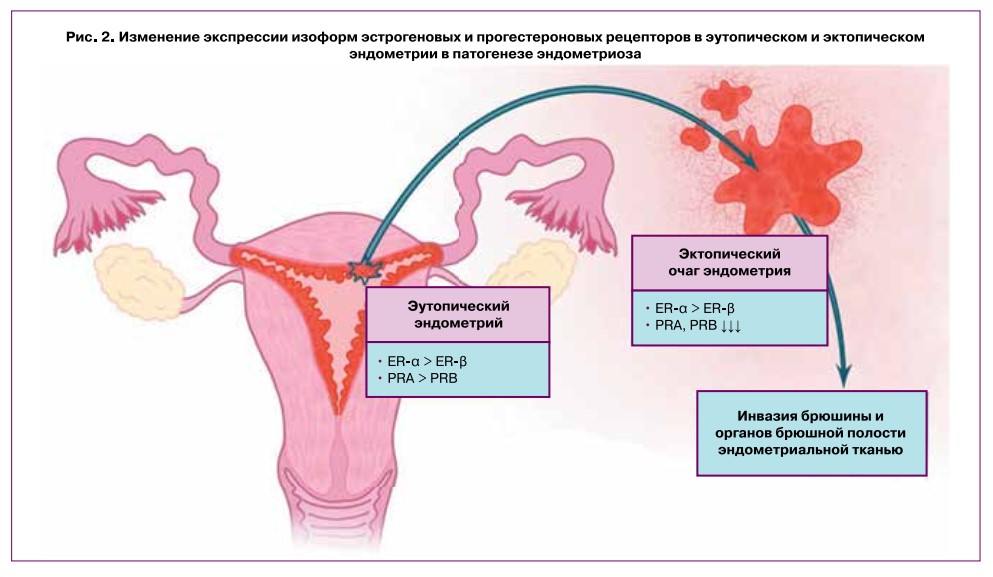
Известно два типа ядерных рецепторов эстрогена: ER-a и ER-|3. Пул эстрогеновых рецепторов эутопи- ческого и эктопического эндометрия неодинаков: в эндометриоидных очагах активнее экспрессируются ER-|3; поэтому нормально и атипично локализо
ванный эндометрий по-разному отвечает на гормональную терапию [16]. Измененный рецепторный аппарат клеток очагов эндометриоза может обусловливать выраженное пролиферативное действие эти- нилэстрадиола, реализуемое преимущественно через эстрогеновые рецепторы типа в. Несмотря на то что этинилэстрадиол имеет сходное сродство к ER-a и ER-в (аффинность к ER-a даже немного превышает таковую для ER-в) [17, 18], ввиду большего количества ER-в в эктопическом эндометрии именно этот тип рецептора, вероятно, ответственен за возможность прогрессирования и роста эндометриоидных очагов под действием КОК. Существуют исследования, лапароскопически и гистологически подтверждающие прогрессирование эндометриоза на фоне КОК [19], при этом наиболее значимым этот эффект оказывается у пациенток с глубокой инфильтративной формой эндометриоза [20].
Изменения экспрессии рецепторов в клетках патологически локализованной ткани эндометрия затрагивают и пул прогестероновых рецепторов (рис. 2), что также важно, поскольку КОК содержат и проге- стагенный компонент. Это может объяснять относительную нечувствительность эктопических очагов эндометрия к прогестерону, что будет освещено ниже.
Кроме того, существуют противоречивые данные об эффективности КОК в отношении устранения болевого синдрома: в систематическом обзоре Кокрейн от 2018 г. рассматривается только одно исследование, освещающее применение КОК для купирования боли, вызванной эндометриозом. Авторы отмечают, что применение низкодозированных КОК эффективно снижает боль у пациенток с эндометриозом, однако признают, что размер выборки для исследования был небольшим и наблюдения ограничивались периодом 6 месяцев, что не позволяет достоверно утверждать об эффективности КОК для купирования болей при
эндометриозе в долгосрочной перспективе [21]. Систематический обзор Американского общества репродуктивной медицины от 2018 г. включает 18 исследований и также делает вывод о том, что КОК могут эффективно снижать болевые ощущения у пациенток с эндометриозом, однако имеющихся данных недостаточно, и этот вопрос требует дальнейшего исследования [22]. Помимо возможной индукции пролиферации эктопического эндометрия, на фоне приема КОК имеется повышенный риск венозных тромбоэмболических осложнений, обусловленный преимущественно содержанием эстрогенового компонента, что также требует детальной оценки семейного анамнеза и факторов риска перед назначением препаратов [23, 24].
Стоит отметить, что с эмпирической точки зрения КОК могут быть эффективны как для лечения дисменореи, так и для профилактики рецидивирования эндометриоза, в т.ч. таких его проявлений, как дисменорея и эндометриоидные кисты. Назначение КОК в непрерывном режиме после хирургического удаления эктопических очагов эндометрия и эндометри- омы рекомендовано со степенью доказательности В Канадским обществом акушерства и гинекологии (COGS) от 2010 г. [25], Национальной коллегией акушерства и гинекологии Франции (CNGOF) от 2018 г. [26], Национальным институтом здоровья и клинического совершенствования Великобритании (NICE) от 2020 г. [27], Европейским обществом репродукции человека и эмбриологии (ESHRE) от 2013 г. [4], Российским обществом акушеров- гинекологов (РОАГ) с уровнем рекомендации С от 2020 г. [6].
К неоспоримым достоинствам КОК относят их экономическую доступность, широкую распространенность, хорошую переносимость и большой клинический опыт применения. Широкое распространение КОК получили в т.ч. благодаря относительно низкой
выраженности побочных реакций: препараты этой линии не влияют на костную ткань, не вызывают гипоэстрогении и медикаментозной аменореи, что особенно актуально для пациенток молодого репродуктивного возраста. Кроме того, преимуществом комбинированных гормональных контрацептивов является разнообразие лекарственных форм, что дает пациентке возможность выбора наиболее комфортного для нее варианта. Помимо таблетированных средств, препараты с аналогичным эстроген-гестаге- новым составом могут быть применены: а) трансдер- мально — в виде пластыря: в любом месте наклеивается на кожу в течение 3 недель, после чего следует неделя без пластыря. Данный вариант может оказаться проще в применении, чем ежедневный пероральный примем таблетированных форм, требующий от пациентки дисциплины — пластырь меняется 1 раз в неделю, в то время как пероральные формы необходимо принимать ежедневно в одно и то же время; б) вагинально — в виде кольца, которое устанавливается во влагалище на 3 недели, после чего следует 1 неделя без кольца. По эффективности способ сопоставим с трансдермальными контрацептивами.
Таким образом, несмотря на то, что КОК можно отнести к средствам симптоматической терапии дисменореи, в том числе ассоциированной с эндометриозом, а также к препаратам для профилактики постоперационных рецидивов эндометриоза, это не исключает возможности их назначения пациенткам в раннем репродуктивном возрасте с контрацептивной целью, что необходимо учитывать, поскольку в инструкции по применению препаратов КОК в показаниях к назначению указана контрацепция у пациенток после наступления менархе.
Гестагены в терапии эндометриоза
Препараты на основе прогестинов — исторически первая группа, применявшаяся для гормональной терапии эндометриоза. Впервые в исследовании 1958 г. авторами отмечена положительная динамика инволюции эндометриоидных очагов при беременности, в связи с чем сформулирована гипотеза возможной эффективности применения искусственных гестагенов. Авторами обнаружены клинически значимые изменения: под действием прогестинов запускались процессы децидуализации с последующим некрозом и устранением поверхностных эктопических очагов эндометрия [28]. Терапия прогестинами проводилась на протяжении 3—7 месяцев, по прошествии которых клинические наблюдения и гистологическое исследование подтвердили улучшение состояния пациенток и регресс эндометриоидных очагов. Несмотря на то что с 1958 г. было предложено немало альтернативных методов консервативной симптоматической и патогенетической терапии, предпочтение в лечении эндометриоза и сегодня отдается синтетическим гестагенам.
В качестве монотерапии и в сочетании с другими гормональными препаратами, способствующими гипоэстрогении и гипоандрогении, прогестины способны вызывать децидуальную трансформацию, в т.ч. в эктопических очагах эндометрия [29]. Кроме того, современные исследования сообщают о еще одном механизме воздействия прогестинов на эндометриоидные гетеротопии: они подавляют индукцию транскрипционного фактора NF-zB, снижая синтез провоспалительных цитокинов — фактора некроза опухоли-а (TNF-а), интерлейкинов ИЛ-8, ИЛ-6 и др. [30].
Существует 3 типа прогестероновых рецепторов: ядерные рецепторы типа А (PGA) и типа В (PGB), митохондриальная изоформа (PRM), а также мембранные рецепторы (mPRs). В патогенезе эндометриоза ключевая роль отводится в первую очередь PGA и PGB. Существуют противоречивые данные о том, как меняется соотношение пулов прогестероновых рецепторов в эндометриоидных очагах. Однако в большинстве случаев отмечается некоторое снижение экспрессии обеих изоформ рецепторов (А и В) по сравнению с эутопическим эндометрием. В ряде случаев это может обусловливать нечувствительность к прогестиновой терапии. Кроме того, показано, что в клетках эктопического эндометрия изменена ферментативная активность 17-бета-гидроксистероидде- гидрогеназы 2 типа, которая инактивирует эстрадиол; в связи с дефектом данный фермент теряет способность активироваться гестагенами, что не позволяет им проявить свою антипролиферативную активность в полной мере [31]. Наконец, в эндометриоидных очагах отмечается патологическая активность ароматазы, что создает эффект локальной гиперэстрогении в эктопических имплантах и провоцирует пролиферацию эндометрия. Однако случаи критического снижения чувствительности к прогестинам относительно редки, и потому для большинства пациенток с эндометриозом они остаются одними из самых эффективных средств.
Кроме вышеперечисленных эффектов, прогестины оказывают подавляющее воздействие на местную продукцию эстрадиола: к примеру, диеногест способен оказывать подобный эффект за счет ингибирования экспрессии ароматазы [32]; аналогичным действием обладает и медроксипрогестерон, что подтверждено на данный момент экспериментами in vivo на голых мышах с имплантами человеческого эндометрия [33]. Помимо ароматазы, прогестины воздействуют и на другие ферменты, вовлеченные в стероидогенез, в т.ч. на 17-бета-гидроксистероидде- гидрогеназу типа 1, катализирующую превращение эстрона в эстрадиол [34, 35], а также на 17-бета- гидроксистероиддегидрогеназу типа 2, инактивирующую эстрадиол, что позволяет снизить уровень локальной гиперэстрогении [34].
Стоит отметить, что эффективность прогестинов в лечении эндометриоза связана не только с индукцией децидуализации эндометрия, но также с противовоспалительным и иммуномодулирующим эффектами за счет подавления пути NF-zB, снижения транскрипции провоспалительных цитокинов (ИЛ- 2, ИЛ-6, ИЛ-8, фактора хемотаксиса моноцитов-1 (MCP-1), нейро- и ангиогенных факторов (эндотелиальный сосудистый фактор роста (VEGF) и фактор роста нервов (NGF)). Таким образом подавляется как пролиферативная активность очагов, так и трофика к очагам за счет ингибирования роста сосудов и нервов [7, 12, 30].
Прогестагеновые препараты в силу своих структурных отличий по-разному воздействуют на рецепторы и модулируют активность гипоталамо-гипофизар- ной оси [31]. Основными прогестагенами, наиболее широко применяемыми в клинической практике в терапии дисменореи, являются диеногест, дидро- гестерон, дезогестрел, дроспиренон, ципротерона ацетат.
- Диеногест — синтетический прогестин IV поколения, обладающий высокой селективностью к прогестероновым рецепторам. Предназначен для перорального применения как в качестве монотерапии, так и в составе комбинированных схем, в т.ч. в айй-Ьаск терапии в сочетании с аГнРГ. По структуре является производным С-19-нортестостерона, обладает дополнительной антиандрогенной активностью за счет слабого сродства к андрогеновым рецепторам, при этом не имеет глюкокортикоидных и минералокортикоидных свойств. Механизм действия диеногеста включает несколько компонентов, из которых ключевым является индукция децидуа- лизации и атрофии ткани эндометрия, в т.ч. эктопического. Диеногест снижает локальную продукцию эстрогенов в эндометриальной ткани, модулируя активность 17-бета-гидроксистероиддегидрогена- зы 2 типа, инактивирующей эстрадиол, тем самым уменьшая пролиферацию клеток эндометрия. В исследовании, проведенном на модели эндометриоза на крысах, авторы отмечают подтвержденное гистологически и иммуногистохимически снижение интенсивности ангиогенеза и уровня его маркеров в гетеротопиях, подвергшихся воздействию диеноге- ста [36]. В другом эксперименте in vivo на макаках циномолгус авторы показали активацию апоптоза в гранулезных клетках доминантного фолликула и более низкий уровень ароматазы в них, предположительно, обусловленные снижением местной продукции эстрадиола, вызванной диеногестом [32]. Также многочисленные исследования подтверждают эффективность противовоспалительного эффекта прогестинов, осуществляемого за счет подавления важнейшего провоспалительного транскрипционного фактора NF-kB [37]. В систематическом обзоре от 2015 г. [38] подтверждено влияние диеногеста на противовоспалительное окружение в эндометриоидных гетеротопиях. По данным исследований разных лет показано снижение уровня таких провоспали- тельных цитокинов, как ИЛ-6 и -8, MCP-1; также было отмечено снижение экспрессии циклооксигеназы типа 2 (ЦОГ-2), ароматазы, снижение активации NF-kB пути в клетках эндометриоидных гетеротопий под действием диеногеста [7, 12, 32—38].
Необходимо отметить, что данные длительных проспективных исследований приема диеногеста у пациенток раннего репродуктивного возраста по поводу эндометриоза единичны. В 2021 г. опубликованы результаты наиболее крупного международного многоцентрового исследования VIPOS, в которое были включены более 27 тыс. участниц с динамической оценкой на протяжении вплоть до 7 лет наблюдения за женщинами на фоне приема препарата [39]. В общей сложности 798 участниц исследования использовали диеногест в постоянном режиме длительно в течение 15 месяцев или дольше. По результатам исследования показан выраженный клинический эффект при благоприятном профиле безопасности и переносимости препарата, значимо превалировавший над нежелательными или побочными эффектами, которые носили предсказуемый и клинически хорошо управляемый характер. Дискутабельным остается вопрос о невысоком, однако сохраняющемся риске возможного влияния диеногеста на снижение минеральной плотности костной ткани у молодых пациенток на фоне длительного приема препарата. Есть достаточно работ о, безусловно, менее выраженной гипоэстрогении и влиянии на минеральную плотность костной ткани диеногеста в сравнении с аГнРГ, как и частоте побочных эффектов [4, 7, 9]. Кроме того, в исследовании 2018 г. на меньшей выборке пациенток репродуктивного возраста (от 22 до 37 пациенток 39±8 лет), которые принимали диеногест в дозе 2 мг в течение от 3 до 5 лет (36—60 месяцев наблюдения) авторами не было показано значимого снижения лабораторного уровня эстрадиола в плазме крови, который оставался в пределах референсных значений [40]. В других двух работах 2009 и 2021 гг. коллективом авторов было показано статистически значимое, однако не критически выраженное снижение минеральной плотности костной ткани на фоне длительного приема диеногеста в течение от 52 недель до 3 лет, как и восстановление прежних значений до начала терапии после отмены препарата в течение 24—52 недель [41, 42]. На основании данных наблюдений авторы делают вывод о необходимости контролировать минеральную плотность костной ткани у пациенток на фоне приема диеногеста через год и далее, что не снижает значимости и клинической эффективности использования препарата, в том числе в раннем репродуктивном возрасте.
В качестве терапии после хирургического вмешательства по поводу эндометриоза и эндометриомы яичника диеногест также показал высокую эффективность по данным систематического обзора и метаанализа 2020 г. при длительности наблюдения от 29 до 36 месяцев [43]. Перечисленные эффекты в совокупности с доступностью и хорошей переносимостью терапии диеногестом делают его многообещающим средством для лечения эндометриоза с раннего репродуктивного возраста. Кроме того, нужно подчеркнуть, что в инструкции к назначению диеногеста 2 мг (в составе препарата «Визанна») указаны безопасность и эффективность использования препарата в лечении эндометриоза у подростков после наступления менархе (с 12 лет).
- Дидрогестерон — синтетический прогестин, близкий по своей структуре к натуральному и обладающий сродством исключительно к прогестероновым рецепторам. Дидрогестерон показывает высокую эффективность в снижении болевого синдрома при эндометриозе; кроме того, его достоинством для пациенток с эндометриозом, планирующих беременность, является большая вероятность успешной овуляции, а следовательно, наступления беременности на фоне терапии, поскольку в циклическом режиме приема дидрогестерон не оказывает блокирующего овуляцию эффекта [44]. В исследовании 2018 г. на животной модели эндометриоза у мышей проводилось сравнение диеногеста и дидрогестерона, показавшее схожую клиническую эффективность и молекулярную обоснованность обоих препаратов. Воздействуя преимущественно через прогестероновые рецепторы, они подавляют пролиферативную активность и индуцируют апоптоз в эндометриоидных гетеротопиях. Помимо уменьшения размеров очагов, в эндометриоидных гетеротопиях на фоне воздействия диеногеста и дидрогестерона было отмечено сопоставимое снижение транскрипции маркеров клеточной адгезии (MMP2, Itgav |33) и пролиферации (PCNA, Ki 67), прогестероновых рецепторов; а при использовании дидрогестерона выявлено также увеличение количества апоптотических клеток и экспрессии маркера апоптоза MAPK1 [45]. Авторы исследования 2020 г. отмечают эффективность дидрогестерона в лечении пациенток с эндометриозом как в непрерывном, так и в пролонгированном циклическом режиме (по 10 мг 2—3 раза в день с 5-го по 25-й день менструального цикла), которые показывают сопоставимые значения снижения интенсивности болевой симптоматики [46]. При этом авторы указывают, что возможность подбора персонифицированного режима для пациенток, планирующих реализовать репродуктивную функцию и не нуждающихся в блоке овуляции, является несомненным преимуществом данного режима терапии [15, 29, 31].
- Дезогестрел — синтетический прогестин III поколения, по структуре представляет собой производное 19-нортестерона и является пролекарством для орального применения; в организме переходит в активную форму — этоногестрел. Существуют исследования, подтверждающие эффективность дез- огестрела в лечении эндометриоза [31]. Дезогестрел обладает слабой антиандрогенной и антигонадо- тропной активностью, эффективно подавляя овуляцию и снижая локальную продукцию эстрогенов, что обуславливает возможность его применения как в самостоятельном варианте, так и в составе комбинированных с эстрогеновым компонентом препаратов.
- Дроспиренон — синтетический прогестин IV поколения, производное 17а-спиронолактона. Помимо типичной для этого класса препаратов про- гестагенной активности, обладает также антиандро- генными и антиминералокортикоидными свойствами. Имеются данные о положительном эффекте применения дроспиренона в комбинации с эстрогеновым компонентом в составе КОК в постоперационном периоде у пациенток с эндометриозом [47].
Помимо того, что терапия гестагенами воздействует на патогенез заболевания, а не только устраняет симптомы, к достоинствам прогестинов можно отнести меньшее количество противопоказаний по сравнению с КОК из-за отсутствия эстрогенового компонента, наиболее значимым из которых является меньшее влияние на свертывающую систему крови. Также к достоинствам прогестиновых препаратов можно отнести большое разнообразие вариантов применения: препараты данной группы включают в себя оральные, инъекционные, имплантационные, внутриматочные формы.
- Таблетированные формы: по составу включают в себя микродозы синтетических аналогов прогестерона, что позволяет их отнести к 1-й линии терапии эндометриоза.
- Помимо пероральных форм, на основе прогестинов в терапии эндометриоза применяются также внутриматочные левоноргестрел-содержащие контрацептивы. Неоспоримым достоинством такого способа является возможность установки на длительный срок в 5 лет, а также низкий тромбогенный потенциал.
- Инъекционные формы: внутримышечная инъекция производится 1 раз в 3 месяца. Данных о применении подобных форм для лечения эндометриоза на сегодняшний день нет; им отдается преимущество при проведении заместительной гормональной терапии у женщин в постменопаузе.
- Имплантационные формы — подкожный имплант размером 4 см*2 мм, действует 3 года. В литературе не описан опыт применения их в терапии эндометриоза.
Агонисты гонадотропин-рилизинг-гормона
Препараты аГнРГ не назначаются в качестве 1-й линии терапии эндометриоза в связи с выраженными побочными реакциями, в числе которых — значимое снижение уровня эстрогенов и минеральной плотности костной ткани. По этой причине они не применяются в качестве 1-й линии терапии эндометриоза у пациенток в раннем репродуктивном возрасте; назначение допускается только при неэффективности других препаратов и выраженном распространенном процессе глубокого инфильтративного эндометриоза. В настоящее время в случае терапии данной группой препаратов более 6 месяцев все большее распространение получает add-back-терапия, при которой негативные побочные эффекты аГнРГ, связанные с гипоэстрогенией, нивелируются комбинируемым с ними эстрогенсодержащим препаратом. При этом для ремоделирования костной ткани требуются значительно более низкие дозировки эстрогенов (20—50 пг/мл), чем для роста эндометриоидных гетеротопий (100—300 пг/мл); следовательно, применение эстрогенов в составе add-back-терапии не приводит к пролиферации эндометрия и не препятствует атрофии его эктопических очагов под действием аГнРГ [48]. Используемые на сегодняшний день принципы и подходы к терапии эндометриоза в репродуктивном возрасте суммированы на рисунке 3.

Помимо основных групп препаратов, направленных на лечение эндометриоза, с меньшей частотой в клинической практике сохраняется применение синтетических андрогенов; наиболее широкое распространение среди них получил даназол. Даназол не обладает эстрогеновыми и прогестиновыми эффектами, но имеет слабый антигонадотропный эффект. Даназол показал достаточную эффективность в лечении эндометриоза, вызывая атрофию эндометриоидной ткани, в том числе в ее эктопических очагах. Эффективность даназола в снижении болевого синдрома при эндометриозе, по данным обзора Кокрейн от 2007 г., составила свыше 80% [49]. Однако в настоящее время применение синтетических андрогенов ограничено, в особенности в раннем репродуктивном возрасте, более выраженными, чем у других препаратов, гепатотоксическим, андрогенным и анаболическим эффектами, в числе которых акне, набор веса, усиление роста волос на андрогензависимых участках тела, атрофия молочных желез.
Селективные модуляторы прогестероновых и эстрогеновых рецепторов
Перспективными средствами в лечении эндометриоза являются также SPRM и SERM. SPRM специфично воздействуют на эндометрий, не вызывая системной гипоэстрогении [7, 12]. Эффективность этой группы лекарственных препаратов в лечении эндометриоза показана преимущественно на культурах клеток человека и в экспериментах на животных. Результаты исследований на приматах и крысах показали, что такие SPRM, как мифепристон, онапристон и ZK136799, патогенетически подавляют пролиферацию и локальное воспаление эндометрия за счет снижения уровня экспрессии простагландинов, что влечет за собой снижение болевого синдрома при эндометриозе [8, 9]. Эффективность SERM для терапии эндометриоза на сегодняшний день также имеет небольшую доказательную базу. Известно несколько экспериментов на животных, в которых была показана эффективность ралоксифена и базедоксифена в уменьшении эндометриоидных очагов, а для хлориндазола и окса- бициклогептенсульфоната, кроме того, отмечены противовоспалительная активность и способность подавлять ангио- и нейрогенез в эндометриоидных гетеротопиях [7].
Перспективные препараты таргетной терапии эндометриоза
На сегодняшний день активно разрабатываются другие препараты и схемы для таргетной терапии эндометриоза, включая селективные ингибиторы ЦОГ-2 (целекоксиб), антипролиферативные, проа- поптотические и противовоспалительные препараты (мелатонин, ресвератрол, туникамицин, вертепор- фин, сорафениб, N-ацетилцистеин), лиганды эстрогеновых рецепторов (хлориндазол, оксабициклогеп- тенсульфонат), модуляторы аутофагии (гинзенозиды типа ППД (производные протопанакса-диола)), анти- миграционные, антиинвазивные, антиангиогенные и антифиброзные препараты (генистеин, метформин, фасудил) и др. [12, 50-53].
По данным исследования 2018 г., проведенного на крысиной модели эндометриоза, было подтверждено, что агонист дофаминовых рецепторов каберголин индуцирует фагоцитоз рецептора VEGF 2 типа и тем самым уменьшает ангиогенез в гетеротопиях и непосредственно размер эндометриоидных очагов по сравнению с контрольной линией крыс [11]. В других исследованиях показана как самостоятельная эффективность каберголина, так и применение его в сочетании с диеногестом в лечении эндометриоза у мышей и на клеточных моделях, подтвержденное гистологическими данными и снижением экспрессии ER-a, ER-Б, CD61 и NGF в очагах [12, 50].
Гипогликемический препарат метформин также обладает множественными механизмами, способными вызывать регресс эндометриоидных гетеротопий, в числе которых снижение экспрессии провоспали- тельных цитокинов (TNF-a, ИЛ-1в, ИЛ-6), VEGF, металлопротеиназы 9 типа, супероксиддисмутазы, а также повышение уровня тканевого ингибитора металлопротеиназы-2 [50]. Эффективность метформина в лечении эндометриоза была показана в работах зарубежных и отечественных авторов [50, 51, 54, 55]. В исследованиях 2010—2018 гг. на модели эндометриоза на крысах и мышах зарубежные [10, 54] и отечественные авторы [55] показали, что у животных, получавших метформин, был отмечен регресс эндометриоидных очагов, подтвержденный гистологически. В работах последних лет отмечено, что метформин влияет на рекрутинг и активацию макрофагов, нейтрофилов и NK-клеток к очагам эндометриоза, ингибирует ангиогенез и пролиферацию клеток гетеротопий [9, 50, 55].
Статины — группа гиполипидемических препаратов, которые также рассматриваются в перспективе влияния на патогенез эндометриоза, поскольку характеризуются антиангиогенной и антиадгезивной активностью. Выявлено, что статины затрудняют адгезию эктопического эндометрия за счет снижения уровня матриксных металлопротеиназ и повышения уровня тканевого ингибитора металлопротеиназы-2, негативно влияют на ангиогенез за счет снижения уровня VEGF и повышения уровня апоптоза эндо- телиоцитов, обладают антипролиферативным и противовоспалительным эффектом [13]. В систематическом обзоре Vitagilano et al. обобщили результаты, посвященные применению статинов in vivo и in vitro, и показали антипролиферативное, проапоптотиче- ское действие, способность статинов снижать жизнеспособность и миграцию клеток эндометриоидных гетеротопий, а также ингибировать ангиогенез [9]. Однако остается не до конца ясным влияние статинов на стероидогенез и фертильность, что лимитирует использование данной группы препаратов у молодых пациенток.
Заключение
Таким образом, несмотря на достаточно большое разнообразие вариантов лечения эндометриоза, вопрос поиска эффективной медикаментозной терапии, в том числе у пациенток раннего репродуктивного возраста, остается открытым и на сегодняшний день требует дальнейшего изучения. Существует достаточное количество групп препаратов, которые могут оказаться перспективными в лечении эндометриоза, но для внедрения их в клиническую практику необходим ряд исследований, подтверждающих их эффективность и безопасность. На данном этапе наиболее эффективной и обладающей наименьшим количеством нежелательных побочных реакций группой лекарственных препаратов, которые могут быть применены для лечения эндометриоза в качестве 1-й линии терапии в раннем репродуктивном возрасте с патогенетической точки зрения, являются средства на основе гестагенов.



