Синдром задержки роста плода (СЗРП) – патологическое состояние, связанное с отставанием размеров плода от предполагаемых для данного срока гестации и массой плода при рождении ниже десятого процентиля для данного срока беременности. СЗРП может приводить к целому спектру перинатальных осложнений, включая внутриутробную асфиксию и гибель плода. Около 60% неонатальных смертей, которые происходят во всем мире каждый год, связаны с низким весом при рождении [1, 2]. Задержка роста плода происходит в результате недостаточного поступления кислорода и нутриентов, в том числе по причине изменений сосудов фето-плацентарного комплекса. Известно, что у пациенток с последующим развитием СЗРП уже в первом триместре беременности происходит нарушение инвазии трофобласта, вследствие чего развиваются гемодинамические нарушения маточно-плацентарного кровотока, приводящее к хронической гипоксии [3]. Патологические изменения кровотока в спиральных артериях и межворсинчатом пространстве приводит к снижению интенсивности газообмена между матерью и плодом. Эндогенная антиоксидантная система при критических уровнях гипоксии оказывается несостоятельной, что приводит к развитию выраженного окислительного стресса [4–6].
Окислительный стресс является закономерным явлением во время беременности, как при нормальном ее течении, так и при патологии [4]. Физиологическая беременность сопровождается увеличением метаболической активности организма и потребности тканей в кислороде, что приводит к окислительному стрессу как следствию интенсификации работы митохондриального аппарата и усиленного клеточного дыхания [7]. Параллельно с этим происходит компенсаторное повышение активности антиоксидантной системы. Митохондриальные дисфункции различного генеза приводят к неконтролируемому окислительному стрессу на клеточном и тканевом уровнях и к развитию осложнений беременности, в том числе и СЗРП [4, 8].
Митохондрии являются основными источниками активных форм кислорода (АФК) в клетке, при этом сами наиболее подвержены их разрушительному влиянию: окислению липидов, белков, нуклеиновых кислот [7]. Во время беременности повреждение клеток свободными радикалами не только приводит к разрушению мембран и нарушениям структуры клеток и тканей, но и способно запускать реакции запрограммированной гибели клеток – апоптоз. При манифестации массовой гибели клеток синцитиотрофобласта в системный кровоток матери, помимо мембранных фрагментов, в значительном количестве попадают компоненты внутриклеточных органелл, в том числе митохондриальная ДНК (мтДНК). В связи с этим определение количества копий мтДНК в крови матери представляет большой интерес в качестве возможного маркера развития осложнений гестации.
Известно, что процессы митохондриального биогенеза и селекции дефектных митохондрий тесно взаимосвязаны и регулируются как внешними, так и внутренними факторами. Поврежденные митохондрии селективно удаляются из клетки путем митофагии. Баланс между скоростью биогенеза и митофагии определяет количество митохондрий в клетке, а следовательно, и ее метаболический статус.
Изучение митохондриального биогенеза, процессов митохондриального слияния и фрагментации, а также митофагии является важным этапом в понимании причинно-следственных связей гестационных осложнений при СЗРП и участия в них митохондрий.
В связи с вышесказанным целью исследования было оценить экспрессию основных маркеров слияния и фрагментации митохондрий в ткани плаценты, а также определить число копий мтДНК в крови женщин при физиологическом течении беременности и с диагностированным СЗРП.
Материал и методы исследования
На первом этапе в исследование были включены 27 женщин, родоразрешенных путем плановой операции кесарева сечения и была создана коллекция образцов ткани плаценты. Все пациентки были разделены на две группы: в основную группу вошли беременные женщины с диагностированным СЗРП; контрольную группу составили женщины с физиологическим течением беременности (ФБ) и неотягощенным акушерско-гинекологическим анамнезом. Все обследованные женщины подписали информированное согласие на участие в исследовании.
Для выполнения второго этапа была сформирована коллекция образцов цельной крови, полученной в разные сроки гестации у пациенток с диагностированным СЗРП и ФБ (контроль). В группе ФБ было проанализировано 10 женщин / 30 образцов крови, в группе СЗРП – 12 женщин / 33 образца крови.
Критериями включения в исследование являлись: возраст от 18 до 45 лет; одноплодная беременность с гестационным сроком от 24 до 40 недель, наступившая самопроизвольно; родоразрешение путем операции кесарева сечения. Критериями исключения являлись тяжелая экстрагенитальная патология, включая сахарный диабет, заболевания почек и сердечно-сосудистой системы, инфекционные заболевания.
В работе проводили общеклиническое и лабораторное обследование женщин. В качестве специальных методов исследования были использованы гель-электрофорез, Вестерн-блот анализ с детекцией хемилюминесценции и полимеразная цепная реакция в реальном времени (ПЦР-РВ). Оценивали содержание белков OPA, DRP, VDAC1, TFAM, hOGG1 и уровень экспрессии гена OPA1 в тканях плаценты. В образцах цельной крови был проведен количественный анализ копийности мтДНК методом ПЦР-РВ. Количество ПЦР-продукта целевого гена – участка D-петли мтДНК (mtDNA D-loop), нормировали на количество ПЦР-продукта ядерного гена – β2-микроглобулина.
Статистическую обработку полученных данных проводили с помощью программы GraphPad Prism. Выборки проверяли на нормальность распределения тестов Шапиро–Уилка. В случае нормально распределенных данных использовали параметрические методы оценки (ANOVA, t-тест Стьюдента), в обратном случае – непараметрические методы (критерий Краскела–Уоллиса, тест Манна–Уитни).
Результаты исследования
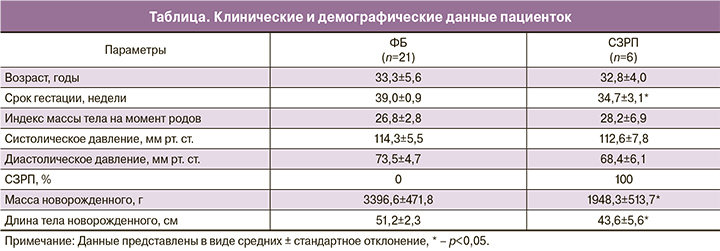
На первом этапе работы оценивали экспрессию основных факторов слияния (OPA1) и фрагментации (DRP1) митохондрий, а также структурно-функциональных белков VDAC1 и TFAM и белка системы репарации мтДНК (hOGG1) в образцах ткани плаценты. Клинические и демографические данные пациенток, вошедших в это исследование, представлены в таблице. В группе СЗРП наблюдали значимые различия с контролем по следующим параметрам: срок гестации (ФБ – 39,0±0,9 недель; СЗРП – 34,7±3,1 недель, * – р<0,05), масса тела новорожденного (ФБ – 3396,5±471,8 г; СЗРП – 1948,3±513,7 г, * – р<0,05) и длина тела новорожденного (ФБ – 51,2±2,3 см; СЗРП – 43,6±5,6 см, * – р<0,05).
ПЦР-анализ не выявил достоверных различий в уровне относительной экспрессии гена OPA1 в исследованных группах (рис. 1А). С этим результатом хорошо согласуются данные, полученные методом Вестерн-блот анализа – уровень обеих форм OPA1 (1-я полоса соответствует нерасщепленному белку, 2-я полоса – расщепленному белку; рис. 1Б) в группе с СЗРП также не изменялся по сравнению с ФБ (рис. 1В).
Анализ уровня белка DRP1 – важного фактора фрагментации митохондрий также не выявил статистически значимых различий между двумя группами (рис. 1Г). Таким образом, можно сделать вывод, что, по-видимому, при СЗРП в плаценте основные механизмы слияния и фрагментации митохондрий не затронуты.
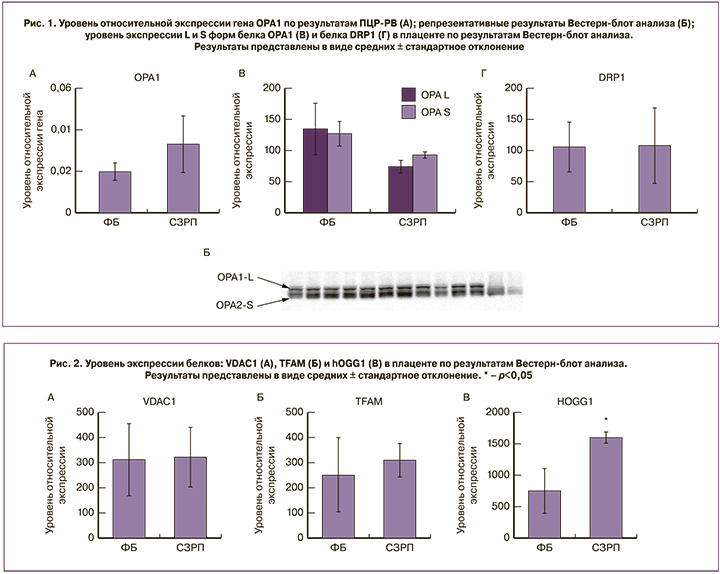
Содержание структурно-функционального белка внешней мембраны митохондрий – VDAC1 и активатора транскрипции и репликации мтДНК – белка TFAM, статистически значимо не различалось между группами (рис. 2А, Б). При этом уровень белка hOGG1 – фермента, ответственного за удаление окисленного гуанина при повреждении мтДНК в группе СЗРП оказался значимо выше, чем при ФБ (р<0,05, рис. 2В), что свидетельствует об активации системы репарации мтДНК.
Повышение содержания белка hOGG1 диктует необходимость исследовать копийность мтДНК, являющуюся важным маркером митохондриального биогенеза. В связи с этим на втором этапе работы мы оценивали этот показатель в цельной крови женщин исследуемых групп ФБ и СЗРП.
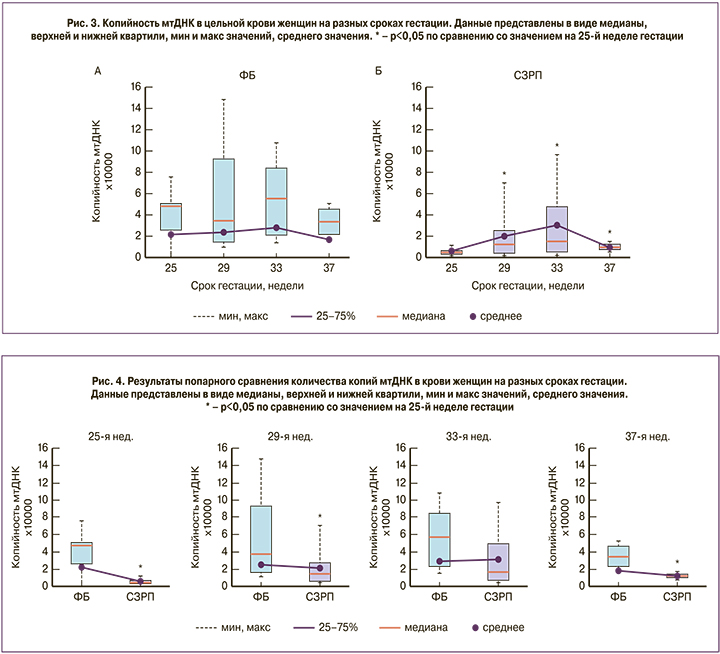
Применение одностороннего дисперсионного анализа Крaскела–Уоллиса не выявило достоверного влияния срока гестации на количество копий мтДНК в группе ФБ (рис. 3А), тогда как в группе СЗРП данный фактор оказывал значимое (p=0,02) влияние на копийность мтДНК в крови. Применение пост-теста критерия Данна для последующего множественного сравнения показало значимое увеличение содержания мтДНК на 29-й, 33-й и 37-й неделе по сравнению с 25-й неделей гестации в группе женщин с СЗРП (рис. 3Б). Таким образом, можно заключить, что копийность мтДНК не изменяется по мере прогрессирования беременности у женщин с неотягощенным акушерско-гинекологическим анамнезом, в то время как у пациенток с СЗРП наблюдается увеличение количества копий мтДНК в крови, начиная с 29-й недели гестации с достижением максимума на сроке 33-й недели.
Попарный анализ групп на разных сроках гестации с помощью критерия Манна–Уитни выявил, что на разных сроках гестации копийность мтДНК была достоверно ниже в группе СЗРП по сравнению с контролем (25 недель p=0,01; 29 недель p=0,04; 37 недель p=0,01; рис. 4).
Заключение
Полученные данные свидетельствуют, что при СЗРП в плаценте не происходят изменения в содержании белков, отвечающих за слияние и фрагментацию митохондрий. Однако мы обнаружили значимое повышение экспрессии фермента системы репарации мтДНК – hOGG1 в группе СЗРП по сравнению с контролем. Повышение экспрессии hOGG1 в группе СЗРП указывает на развитие окислительного стресса, усиление репарации поврежденной мтДНК, копийность которой достигает своего максимума на 33-й неделе беременности в этой группе.
Уровень мтДНК положительно коррелирует с количеством и размером митохондрий [9] и регулируется эндогенными и экзогенными факторами, такими как гипоксемия и стероидные гормоны [10]. Определение относительного уровня копийности мтДНК служит классическим тестом для анализа содержания митохондрий. Как правило, мтДНК располагается вблизи внутренней мембраны митохондрии и, в отличие от ядерной, не защищена гистонами, поэтому постоянно подвергается воздействию свободных радикалов, образуемых дыхательной цепью митохондрий [11, 12]. Поэтому мтДНК особенно чувствительна к повреждениям, вызванным окислительным стрессом.
Копийность мтДНК рассматривается в литературе как новый маркер системной митохондриальной дисфункции, поскольку отражает количество и качество митохондрий. Ранее было показано, что в крови женщин увеличение копийности мтДНК положительно коррелировало с вероятностью отслойки плаценты [13]. В нашей работе было выявлено, что у женщин с диагнозом СЗРП количество мтДНК в крови ниже практически на всех сроках беременности по сравнению с женщинами с нормально протекающей беременностью в те же сроки. Это может свидетельствовать о наличии системной митохондриальной дисфункции у пациенток с СЗРП, которая может служить одной из причин возникновения плацентарной недостаточности. С другой стороны, также отмечается положительная динамика роста количества мтДНК в крови матерей с СЗРП после 25-й недели беременности, сохраняющаяся вплоть до родов, что может свидетельствовать о запуске адаптивного ответа организма.
Дальнейшие исследования в данной области позволят разработать подходы к ранней диагностике СЗРП и прогнозированию исходов беременности при плацентарной недостаточности на базе анализа уровня мтДНК в крови.



