Преждевременные роды (ПР) являются основной причиной неонатальной заболеваемости и смертности во всем мире [1, 2], однако лежащие в их основе этиопатогенетические факторы продолжают представлять активный исследовательский интерес. Так, требуют дальнейшего изучения и детализации вопросы, связанные с развитием двух клинических фенотипов ПР: с интактными плодными оболочками и с преждевременным излитием околоплодных вод [3, 4]. Среди установленных причин воспаление, обусловленное восходящей инфекцией из нижних отделов генитального тракта и/или дисбалансом влагалищной микрофлоры (рост популяции Gardnerella vaginalis и/или Ureaplasma spp., сопровождающийся резким снижением содержания нормофлоры – Lactobacillus spp.), является наиболее изученным фактором ПР с доказанной причинно-следственной связью [5, 6]. Однако спонтанные ПР (сПР) могут быть ассоциированы с инфекционно-воспалительным процессом, локализованным вне влагалища, например, в ротовой полости, мочевыводящих путях, кишечнике, с микробиотой различных органов и систем [7, 8]. Результаты исследований последних лет подтверждают обоснованность комплексного изучения кишечной микробиоты матери с точки зрения не только инициации сПР, но и влияния на неврологический статус недоношенного новорожденного.
Более ста триллионов микроорганизмов обитают в кишечном тракте человека и объединены в единый континуум – кишечная микробиота (КМ) [9]. Известно, что кишечник является многофункциональным органом, а КМ в контексте сПР обладает иммуномодулирующим потенциалом [10]. Дисбаланс КМ способствует развитию пристеночного воспаления с формированием повышенной проницаемости кишечной стенки и последующей активной миграции микроорганизмов («дырявый кишечник», с англ. leaky gut) [9]. Высокая проницаемость способствует диссеминации микроорганизмов и их метаболитов, таких как липополисахариды (ЛПС), содержащихся в клеточной стенке грамотрицательных бактерий, которые вносят дополнительный вклад в системное воспаление, называемое метаболической эндотоксинемией (2–3-кратное повышение уровня циркулирующих эндотоксинов в крови) [11, 12]. Активация провоспалительного пути от физиологического до чрезмерного уровня может также вносить весомый вклад в развитие и других больших акушерских синдромов, в частности, задержки роста плода и преэклампсии [13, 14]. Микроорганизмы – типичные представители КМ были обнаружены в амниотической жидкости беременных с преждевременным разрывом плодных оболочек, что доказывает их роль, возможно, этиологическую, в развитии внутриутробной инфекции [15]. В настоящее время предложены две теории подобной микробной транслокации: циркуляция ЛПС с последующим их стимулирующим эффектом на синтез медиаторов воспаления и простагландинов и гематогенная диссеминация патогенов из кишечника («дырявый кишечник») в плаценту или матку [16].
Цель исследования – изучить потенциальное влияние КМ матери на реализацию ПР.
Материалы и методы
На базе акушерских отделений ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России проведено поперечное (cross-sectional) исследование. В соответствии с поставленной целью обследовано 40 женщин. Пациенты были разделены на 2 группы: I (основную) группу составили родильницы с сПР (средний срок беременности на момент родов составил 34,3 (1,6) недели); II (контрольную) группу – соматически здоровые женщины, родоразрешенные в доношенном сроке беременности (39,5 (1,1) недели).
У всех беременных, включенных в исследование, были детально проанализированы анамнестические и клинико-лабораторные данные: соматический и акушерско-гинекологический анамнез, течение беременности и родов, послеродовый период, показатели периферической крови и отделяемого генитального тракта. Проанализированы методы родоразрешения и неонатальные исходы. Проводилось анкетирование, включавшее вопросы, касающиеся особенностей диеты и характера стула во время и до беременности, наличия/отсутствия вредных привычек.
Критериями включения в I группу были одноплодная беременность, сПР до 366 недель (начало родовой деятельности и/или преждевременный разрыв плодных оболочек); во II группу – одноплодная беременность, завершившаяся своевременными родами. С целью минимизации влияния конфаундеров в обе группы при проведении исследования не были включены пациентки с тяжелой акушерской (за исключением наличия ПР, поздних выкидышей и привычного невынашивания в анамнезе) и экстрагенитальной патологией; носительницы Streptococcus agalactiae (стрептококк группы B). Критериями невключения пациентов являлись: многоплодная беременность, предлежание/врастание плаценты, длительный безводный промежуток (12 ч и более), антибактериальная терапия накануне (7 дней и менее) родоразрешения, диагностированные хронические воспалительные заболевания кишечника. Перед исследованием пациентки подписали добровольное информированное согласие; работа была одобрена комиссией по этике биомедицинских исследований ФГБУ «НМИЦ АГП имени академика В.И. Кулакова» Минздрава России.
Изучение состава КМ проведено методом культуромики с использованием расширенного набора селективных и неселективных питательных сред и инкубированием в аэробных, микроаэрофильных и анаэробных условиях. Образцы кала, собранные в стерильный пластиковый контейнер, в течение 2 ч доставляли в лабораторию, готовили 10-кратные разведения в физиологическом растворе и проводили посев подготовленного инокулюма (по 100 мкл) на питательные среды. Для выделения факультативно-анаэробных и аэробных микроорганизмов использовали колумбийский кровяной агар (Oxoid, Великобритания), хромогенную прозрачную среду Brilliance (Oxoid, Великобритания), маннит-солевой агар (Himedia, Индия), энтерококковый агар (ФГУН «ГИЦПМ и Б», Оболенск, Россия), агар Эндо-ГРМ (Оболенск), Сальмонелла-Шигелла-агар (Oxoid, Великобритания), декстрозный агар Сабуро (Oxoid, Великобритания). Лактобациллы выращивали на среде Лактобакагар (ФГУН «ГИЦПМ и Б», Оболенск, Россия). Строгие анаэробы культивировали на агаре для бифидобактерий (Himedia, Индия), прередуцированном агаре Шедлера (Oxoid, Великобритания) с необходимыми добавками, основном агаре для анаэробов (Oxoid, Великобритания), перфрингенс агаре (Oxoid, Великобритания), железо-сульфитном агаре (Oxoid, Великобритания). Видовая идентификация микроорганизмов проводилась методом MALDI-TOF-MS с использованием времяпролетного масс-спектрометра Autoflex III c программным обеспечением MaldiBioTyper (Bruker Daltoniks, Германия).
Статистический анализ
Статистический анализ полученных данных проводили с использованием методов описательной и вариационно-математической статистики программами GraphPad Prism 8.3 и IBM SPSS Statistics 22 с соблюдением общих рекомендаций для медицинских и биологических исследований. Описание количественных данных, имеющих нормальное распределение, представлено как среднее арифметическое и стандартное отклонение, при распределении, отличающемся от нормального, данные представлены в виде медианы и квартилей. Качественные показатели отражены в абсолютных и относительных (%) величинах. Для определения нормальности распределения использовали обобщенный тест Д’Агостино-Пирсона. Статистически значимыми считались различия при p<0,05. В работе были применены следующие методы обработки данных: тест χ2 с расчетом поправки на непрерывность для таблиц сопряженности 2×2 и критерий Фишера, отношение шансов (ОШ) с доверительным интервалом 95% (95% ДИ) для сравнения бинарных данных, сравнительный анализ переменных с помощью параметрического t-критерия Стьюдента для несвязанных совокупностей. При отсутствии нормального распределения данных применялись методы непараметрической статистики – U-критерий Манна–Уитни. Для исследования зависимостей между параметрами применяли корреляционный анализ по Пирсону.
Результаты
В исследование включены 40 пациенток; в зависимости от срока родоразрешения родильницы разделены на две группы (с преждевременными и своевременными родами (СР)), сопоставимые по возрасту, массо-ростовым показателям и индексу массы тела. Демографическая характеристика обследованных пациенток представлена в таблице 1.
При анализе течения беременности не отмечалось статистически значимых различий в частоте угрожающих ПР (р=0,75), токсикоза беременных (р=0,89), респираторных заболеваний (р=0,06), анемии беременных в III триместре (р=0,15). Однако у пациенток основной (I) группы статистически значимо чаще по сравнению со II группой отмечались ПР в анамнезе (р=0,04), истмико-цервикальная недостаточность (40% и 10% соответственно, р=0,029) с проведенной коррекцией в виде серкляжа (75%) или акушерского пессария (25%). Назначение антибактериальной терапии в III триместре беременности было более частым в основной группе сПР – у 7 из 20 беременных (35%), чем в контрольной – у 1 из 20 пациенток (5%, p=0,02). Вместе с тем при анализе данного показателя в I и II триместрах значимых различий не отмечено (р=0,9 и р=0,43 соответственно).
При сравнительном анализе особенностей родоразрешения, вне зависимости от гестационного срока, преобладающим методом в обеих группах были роды через естественные родовые пути (85% и 90% соответственно). Показанием к абдоминальному родоразрешению в I группе явилось начало родовой деятельности/преждевременный разрыв плодных оболочек у пациенток с рубцом на матке после предыдущей операции кесарева сечения. Частота преждевременного излития околоплодных вод (р=0,46), длительность безводного промежутка (р=0,32) и продолжительность родов (р=0,13) в обеих группах статистически значимо не различались.
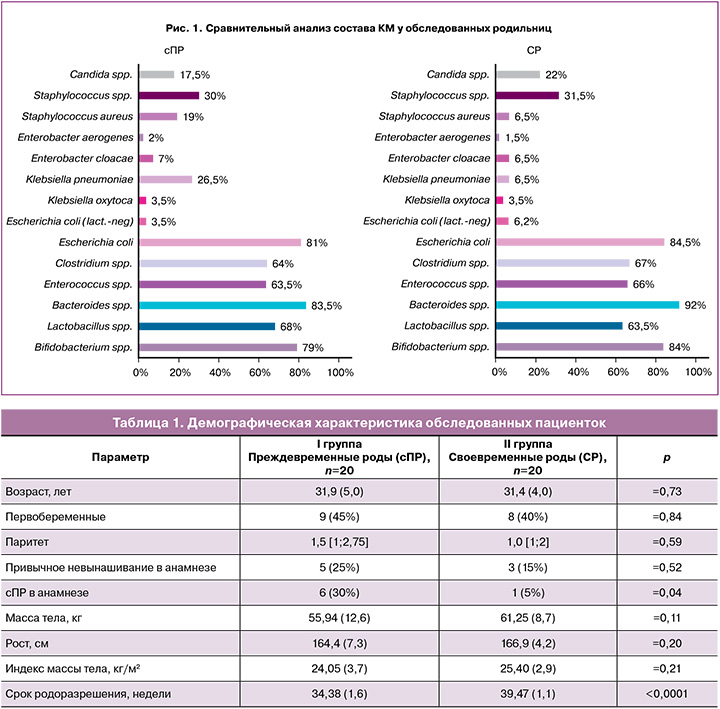
С целью изучения особенностей КМ при сПР проведен детальный анализ ее состава в сравниваемых группах. На рис. 1 представлен микробный состав КМ в сравниваемых группах. Следует отметить, что при одинаковом таксономическом разнообразии отмечается «обеднение» практически всех представителей нормальной КМ у пациенток с сПР. Доля микроорганизмов представлена в процентном соотношении.
Межгрупповые статистически значимые различия обнаружены в отношении Staphylococcus aureus (S. aureus), Klebsiella pneumoniae (Kl. pneumoniae) и бактерий семейства Bacteroidaceae (рис. 2). Так, у пациенток с сПР статистически значимо чаще с более высоким логарифмическим значением колониеобразующих единиц (КОЕ), по сравнению с группой СР, встречались такие патогены, как S. aureus (р=0,0331) и/или Kl. pneumoniae (р=0,0340); при этом наблюдается «обеднение» микробиоты облигатно-анаэробными бактериями семейства Bacteroidaceae (p=0,0416), что усиливает дисбиотические процессы, способствуя активации провоспалительного пути [17].
Для оценки взаимосвязей микроорганизмов в основной группе и понимания их взаимодействия между собой проведен множественный корреляционный анализ с использованием линейного коэффициента корреляции r Пирсона, результаты которого представлены в таблице 2.
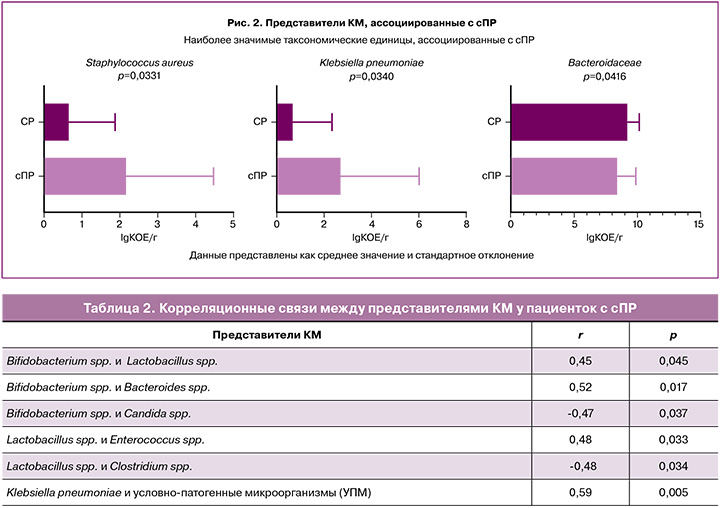
Полученные данные подтверждают потенцирующее (прямая зависимость) влияние представителей нормальной микрофлоры друг на друга: рост одних способствует росту других (r=0,45; p=0,045); в то время как рост УПМ создает благоприятную среду для размножения патогенов (r=0,59; p=0,005); а также отрицательное влияние (обратная зависимость) между нормальными симбиотами и УПМ, в частности, Candida spp. (-0,47; p=0,037) [18].
Для более детальной оценки других факторов риска, влияющих на КМ, нами проводилось анкетирование пациенток обеих групп. Не найдено значимых различий (р=0,74) в особенностях диеты (на выбор предлагалось 5 вариантов: разнообразное питание, в том числе вредные продукты (фастфуд, чипсы и т.д.); разнообразное правильное питание; исключение углеводов; исключение белков; исключение жиров); 70% респондентов в обеих группах выбрали ответ: разнообразное правильное питание. Нарушения стула по типу гипотонии (констипация) встречались несколько чаще в группе сПР, однако различия между группами были не значимы (р=0,75). По частоте вредных привычек (курение), наличию домашних животных обе группы статистически значимо не отличались (р=0,75 и р=0,31 соответственно).
Послеродовый период протекал в обеих группах без осложнений; пациентки выписаны в среднем на 4-е сутки. Уровень лейкоцитов для I группы составил 11,38±2,96×109/л и не отличался от такового для контрольной группы – 10,60±3,3×109/л (р=0,42). Инфекционных осложнений, характерных для пуэрперия, не отмечено. Однако у 7 новорожденных (35%) из группы сПР развились инфекционные осложнения (врожденная пневмония, инфекция мочевыводящих путей и т.д.), тогда как в контрольной группе таковых отмечено не было (р=0,0004). Процентное содержание лимфоцитов периферической крови на 1–2-е сутки жизни было значимо выше в I группе сПР (39,5±13,2%), чем в группе контроля – 27,50±7,78% (р=0,001).
Для оценки общего количества микроорганизмов с целью визуализации всего массива данных на платформе Displayr была построена тепловая карта (рис. 3). Представлены графическое изображение полученных данных и полный спектр микроорганизмов, обнаруженный у родильниц с ПР и СР (I и II группы). Каждая тонкая горизонтальная линия представляет собой состав КМ родильницы (n=40). Каждая ячейка отображает степень обсемененности микроорганизмами (метки сверху) в lgКОЕ/г.
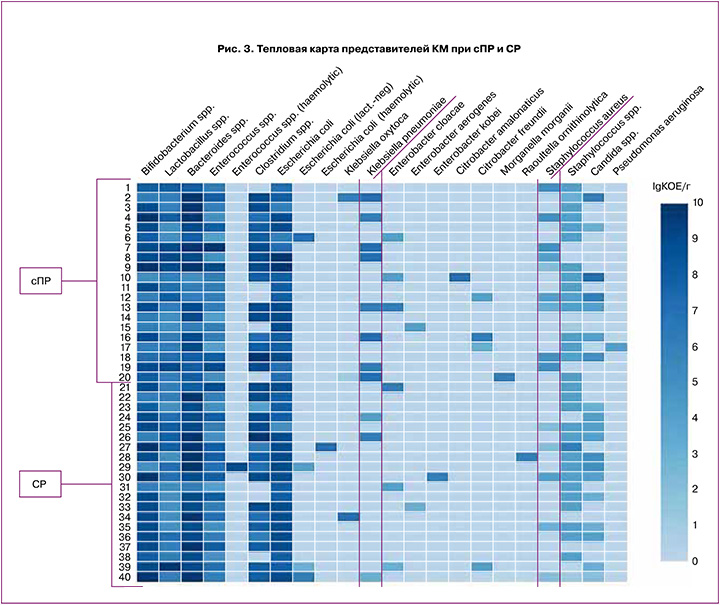
Согласно полученным данным, с сПР может быть ассоциирован рост УПМ в виде S. aureus, который встречался у 50% (10/20) пациенток с сПР и 25% (5/20) при СР; данные различия не имели статистической значимости (р=0,19). Однако обильный рост S. aureus (более 1×104 КОЕ) отмечен только у 5% (1/19) пациенток с доношенным сроком, при этом при сПР данный показатель составил 40% (8/20), что является статистически значимым (р=0,02; ОШ 12,67; 95% ДИ 1,8–146,6). Анализ встречаемости Kl. pneumoniae также не показал значимых отличий (р=0,16): в группе сПР рост был зафиксирован у 40% (8/10) женщин, в группе СР – у 15% (3/20). Обильный рост Kl. рneumoniae отмечен у 40% (8/20), то есть у всех пациенток в группе сПР, причем значение было не менее 1×106 КОЕ, в то время как у пациенток с СР она встречалась в 5% (1/19). Данные различия, аналогично S. аureus, были статистически значимыми (р=0,02; ОШ 12,67; 95% ДИ 1,8–146,6).
Обсуждение
В данном исследовании случай-контроль проанализированы показатели КМ 40 родильниц с сПР и СР. Известно, что в толстом кишечнике обитают более 50 типов микроорганизмов, но доминируют четыре основных типа: Firmicutes, Bacteroidetes, Actinobacteria и Proteobacteria [19]. Согласно полученным результатам, ведущими представителями КМ обеих групп были микроорганизмы родов Bifidobacterium (тип Actinobacteria), Bacteroides (тип Bacteroidetes), Lactobacillus, Enterococcus, Staphylococcus, Clostridium (тип Firmicutes) и Escherichia, Klebsiella (тип Proteobacteria). В соответствии с полученными данными все пациентки были ранжированы в зависимости от степени дисбиотических нарушений на три группы: нормоценоз, умеренно выраженные дисбиотические изменения (строгие анаэробы преобладают над факультативными анаэробами, рост УПМ менее 104 КОЕ/г) и выраженный дисбиоз (факультативные анаэробы преобладают над облигатными анаэробами, рост УПМ более 104 КОЕ/г) с повышенной генерацией S. aureus, Klebsiella spp. и Clostridium spp. У 90% (18/20) пациенток основной группы преобладали дисбиотические нарушения от умеренных до выраженных, что значимо выше по сравнению с контрольной группой (2/20 (10%), р=0,001); при этом частота выраженного дисбиоза была также выше (45% и 10% соответственно), что является статистически значимым (р=0,004).
Согласно полученным данным, с сПР может быть ассоциировано увеличение численности факультативно-анаэробной УПМ в виде S. aureus и/или Kl. pneumoniae, а также скудное количество облигатно-анаэробного компонента КМ – бактероидов. Снижение титров бактероидов и других облигатно-анаэробных микроорганизмов в составе КМ сопровождается нарушением продукции короткоцепочечных жирных кислот (ацетата, пропионата, бутирата), оказывающих влияние на здоровье толстой кишки, обеспечивая защиту от воспаления и нарушения барьерной функции. Здоровые эпителиальные клетки толстого кишечника истощают уровни кислорода в его просвете, на границе слизистой оболочки, через процессы бета-окисления, создавая, таким образом, анаэробную среду, а в случае воспаления – снижают способность к бета-окислению вследствие повышенной доступности кислорода, который приводит к дисбиотическим изменениям, ассоциированным с повышенной генерацией протеобактерий, в том числе энтеробактерий [20, 21]. Увеличение проницаемости клеток кишечника сопровождается возрастанием транспорта ЛПС клеточной стенки грамотрицательных бактерий из просвета кишечника в кровоток [22], вызывая эндотоксемию. Снижение содержания бактероидов в составе КМ пациенток с сПР в сочетании с увеличением популяции протеобактерий (Kl. pneumoniae), имевшее место в нашем исследовании, могло привести к повышенной продукции провоспалительных цитокинов и простагландинов и запустить каскад патогенетических механизмов, инициирующих развитие преждевременной родовой деятельности.
Роль КМ в развитии широкого спектра акушерской патологии, в том числе больших акушерских синдромов, активно изучается. Данное исследование, наряду с многочисленными данными современной литературы [10, 23, 24], свидетельствует о роли КМ как одного из потенциальных кофакторов в развитии сПР. По-видимому, «обеднение» КМ у пациенток основной группы может вызвать синдром системного воспалительного ответа, который приводит к повышенной секреции провоспалительных цитокинов и простагландинов и, соответственно, к ПР [8]. Вторым активно обсуждаемым направлением является перинатальное программирование; формирование и поддержание адекватного функционирования оси кишечник–мозг (gut–brain axis) [10] матери и плода невозможно в ситуациях дисбиоза.
Заключение
Таким образом, нормализация КМ, восстановление ее разнообразия и стабильности состава у беременных является одной из важных профилактических мер по снижению частоты ПР и, соответственно, неонатальных осложнений.



