Наружный генитальный эндометриоз (НГЭ) – хроническое воспалительное заболевание, характеризующееся наличием клеток эктопического эндометрия за пределами полости матки. Среди фертильных женщин частота встречаемости данного заболевания составляет в среднем 10–15%, тогда как среди женщин, страдающих бесплодием, – около 30–50% [1].
Несмотря на значительные успехи в области вспомогательных репродуктивных технологий (ВРТ), отсутствие наступления беременности у женщин с эндометриозом связано с активацией различных патогенетических механизмов, лежащих в основе бесплодия при НГЭ. У пациенток с эндометриоидными кистами наблюдается истощение пула примордиальных фолликулов в коре яичников, снижение ответа на стимуляцию функции яичников, что приводит к уменьшению количества и качества зрелых ооцитов по сравнению с аналогичной возрастной группой без НГЭ. Известно также, что НГЭ ассоциирован с нарушением трансформации эндометрия в лютеиновую фазу естественного или стимулированного цикла, что может снижать шанс имплантации эмбриона и наступления беременности в программах ВРТ [2].
НГЭ сопровождается местной воспалительной реакцией с активацией макрофагов, выбросом цитокинов и простагландинов, высвобождением активных форм кислорода (АФК), мобилизацией антиоксидантного ответа, формированием локального окислительно-восстановительного дисбаланса с последующим повреждением липидов, белков и нуклеиновых кислот [3]. Воздействие такой «токсичной среды» влияет и на качество гамет, и на сам процесс оплодотворения, снижая шансы не только на естественное зачатие, но и оказывая отрицательное влияние на качество эмбрионов и их способность к развитию в программах ВРТ [4]. Обсуждается роль АФК в нарушении образования веретен деления во время мейоза: полное созревание ядра зависит от формирования нормальных веретен деления, управляющих сегрегацией хромосом [5, 6]. Мейотические ошибки, имеющие материнское происхождение, являются основной причиной хромосомных анеуплоидий. Данные ошибки возникают на разных стадиях оогенеза, прежде всего, когда гомологичные хромосомы или сестринские хроматиды не подвергаются расхождению, что приводит к несбалансированному распределению генетического материала [6]. В связи с этим ооциты, полученные в результате стимуляции яичников женщин с НГЭ, могут быть хромосомно нестабильными, что может влиять на частоту анеуплоидий у эмбрионов в данной группе пациенток и приводить к ухудшению исходов программ ВРТ.
Анализ хромосомного статуса эмбриона с помощью преимплантационного генетического тестирования на анеуплоидии (ПГТ-A) направлен на оптимизацию выбора эмбрионов для переноса с целью повышения эффективности программ ВРТ [7]. В настоящее время одним из широко применяемых подходов для оценки хромосомного статуса эмбриона является высокопроизводительное секвенирование следующего поколения (NGS) [8].
Данные о влиянии НГЭ на генетический статус эмбрионов на сегодняшний день достаточно противоречивы. Однако результаты недавних исследований показали, что исходы программы ВРТ у пациенток с НГЭ и в контрольной группе женщин без НГЭ сопоставимы [9].
Цель настоящей работы заключалась в оценке частоты получения анеуплоидных эмбрионов у женщин с НГЭ по сравнению с соответствующей возрастной группой пациенток без НГЭ, проходивших лечение бесплодия в программах ВРТ.
Материалы и методы
Был выполнен ретроспективный анализ историй болезни, проанализированы и сопоставлены клинические данные 324 супружеских пар, обратившихся за лечением бесплодия в отделение ВРТ в лечении бесплодия им. проф. Б.В. Леонова ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава РФ с января 2018 по декабрь 2020 гг. Группу женщин с НГЭ составили 113 пациенток. В группу сравнения вошли 211 пациенток без НГЭ. Каждая группа была разделена на три подгруппы в зависимости от возраста женщины (<35 лет, 35–37 лет, >37 лет) для того, чтобы минимизировать влияние возрастного фактора на результаты исследования.
Диагноз НГЭ был поставлен на основании ультразвукового исследования органов малого таза (УЗИ ОМТ) либо на основании данных лапароскопии с гистологическим подтверждением. В исследование были включены женщины с НГЭ I и II степени тяжести. В группу сравнения вошли пациентки с трубно-перитонеальным фактором, бедным ответом, низким овариальным резервом, супружеские пары с идиопатическим бесплодием, а также пары с мужским фактором (МФ) бесплодия. Супружеские пары с тяжелым МФ бесплодия (отсутствие сперматозоидов в эякуляте, выраженная олигозооспермия (количество сперматозоидов <5 млн/мл), проведение аспирации сперматозоидов из яичка) были исключены из исследования ввиду возможной связи тяжелых форм патозооспермии с повышенным уровнем анеуплоидий в гаметах и получаемых эмбрионах в программах ВРТ [10]. Программы ВРТ с использованием донорских клеток были исключены из исследования.
Параметры спермограммы оценивали в ходе предварительного обследования супружеской пары перед программой ВРТ и в день трансвагинальной пункции яичников (ТВП). Сбор материала производился в стерильный контейнер после полового воздержания (3–5 дней). Сперматозоиды для ИКСИ были обработаны с помощью центрифугирования в градиенте плотности с последующей отмывкой в буфере. Идентификацию ооцит-кумулюсных комплексов (ОКК) и оценку степени зрелости ооцитов проводили под стереомикроскопом на нагретой поверхности стерильного ламинарного бокса. ОКК отмывали от фолликулярной жидкости и крови и помещали в стерильные планшеты (Nunc, Дания) с культуральной средой Continuous Single Culture (CSCM, Irvine Sc., USA) на 2–3 ч с целью предварительной инкубации при температуре +37,0°С и атмосфере с 6% СО2. Денудирование ооцитов проводилось в растворе гиалуронидазы в течение 20 с (Irvine Sc., USA). Далее ОКК отмывали в среде CSCM (Irvine Sc., USA) и возвращали в лунки. После проведения оплодотворения методом ИКСИ ооциты переносили в среду CSCM (Irvine Sc., USA) для дальнейшего культивирования. Оценку наступления стадии двух пронуклеусов проводили через 14–16 ч после оплодотворения. В случае отсутствия 2 пронуклеусов оплодотворение считали несостоявшимся. Все этапы культивирования проводили в мультигазовых инкубаторах СООК (Ирландия) в каплях по 25 мкл под маслом (Irvine Sc., USA). Среду CSCM (Irvine Sc., USA) не меняли в течение всего процесса культивирования. Бластоцисты, подходящие для генетического анализа, были оценены по классификации, принятой Стамбульским консенсусом по оценке качества эмбрионов в модификации, и соответствовали степени 3BB и выше [11]. Биопсия клеток трофэктодермы осуществлялась на 5 или 6-е сутки культивирования эмбрионов с последующей криоконсервацией биопсированных эмбрионов. Полученные клетки трофэктодермы переносили в пробирки типа Эппендорф, содержащие лизирующий буфер, для проведения молекулярно-генетической диагностики. Процедура ПГТ-А состояла из нескольких этапов: на первом этапе была проведена полногеномная амплификация и подготовка библиотеки для нанесения на чип. Для создания библиотеки к фрагментам ДНК присоединялись специальные молекулярные метки-баркоды, уникальные для каждого образца в постановке. Далее было выполнено ионное полупроводниковое секвенирование с последующим биоинформатическим анализом результатов и подготовкой заключения. В анализ были включены программы ВРТ, включающие перенос одного эуплоидного эмбриона в криопротоколе. Клиническая беременность регистрировалась через 21 день после переноса эмбриона при визуализации плодного яйца в полости матки с помощью УЗИ ОМТ.
Все пациенты прошли комплексное обследование перед проведением программы ВРТ, включающее оценку уровня фолликулостимулирующего гормона, уровень антимюллерова гормона (АМГ), а также УЗИ ОМТ для подсчета количества антральных фолликулов на 2–3-й день менструального цикла. Программа ВРТ проводилась согласно стандартной общепринятой методике и соответствовала рекомендациям, представленным в утвержденных клинических протоколах по ВРТ, у всех участников настоящего исследования [12]. Все пациенты, включенные в исследование, подписали информированное добровольное согласие, одобренное этическим комитетом, и согласие на обработку своих персональных данных. Начало стимуляции функции яичников приходилось на 2–3-й день менструального цикла по стандартному протоколу с использованием антагοнистов гонадοтропин-рилизинг-гормοна (ант-ГнРГ) и рекомбинантного фолликулостимулирующего гормона или менопаузального гонадотропина человека. Для предотвращения преждевременного пика лютеинизирующего гормона при достижении фолликулом диаметра 14 мм назначался препарат ант-ГнРГ в дозе 0,25 мг/сут. Для финального созревания ооцитов по достижении диаметра фолликулов ≥17 мм назначался человеческий хорионический гонадотропин в дозе 10 000 ΜЕ в качестве триггера овуляции. В случае риска развития синдрома гиперстимуляции яичников в качестве триггера финального созревания ооцитов был назначен трипторелин в дозе 0,2 мг. В условиях операционной под внутривенной анестезией через 35 ч после введения триггера овуляции была выполнена ТВП с забором фолликулярной жидкости и последующей оценкой качества ооцитов. Полученные эмбрионы были витрифицированы до получения результатов ПГТ-А согласно инструкции производителя культуральных сред для витрификации и разморозки эмбрионов (Kitazato, Япония) [13]. После получения результатов биопсии у пациенток осуществлялась подготовка эндометрия к переносу криоконсервированных эмбрионов с использованием циклической гормональной терапии (эстрадиола валерат в дозе 8 мг/сут с 4–5-го дня менструального цикла, микронизированный прогестерон 400–600 мг/сут с 15–16-го дня менструального цикла). Перенос эмбриона осуществлялся на 20–21-й день менструального цикла, размораживание эмбрионов проводилась согласно инструкции производителя культуральных сред для витрификации и разморозки эмбрионов (Kitazato, Япония) [13].
Статистический анализ
Статистическая обработка данных выполнялась с помощью таблиц Microsoft Excel и статистической программы SPSS Statistics 22 (США.) Для анализа количественных данных в группах определялся вид распределения данных (тест Колмогорова–Смирнова, графический анализ данных). Статистический анализ проводили с помощью χ2-теста для сравнения категориальных данных и теста Манна–Уитни при парном сравнении в случае, когда распределение не соответствовало закону нормального распределения. При распределении признаков, отличающемся от нормального, их описывали в виде медианы (Me) и квартилей Q1 и Q3 в формате Me (Q1;Q3). Величину порогового уровня значимости p принимали равной 0,05.
Результаты
Cравнение одновозрастных групп пациенток позволило получить наиболее объективную оценку влияния НГЭ на частоту анеуплоидий и этапы программ ВРТ.
В ходе сравнительного анализа двух групп было показано, что среднее количество ОКК, полученных в день ТВП, число зрелых ооцитов и число нормально оплодотворенных ооцитов (зигот 2PN2PB) в группе женщин с НГЭ было статистически значимо выше, чем аналогичные показатели в группе сравнения, что обусловлено определенными критериями отбора: в группу сравнения вошли женщины, как с трубно-перитонеальным фактором бесплодия, так и пациентки с бедным ответом и низким уровнем АМГ. Стоит отметить, что в группе сравнения большую долю составили пациенты старшего репродуктивного возраста (>37 лет, n=103) (табл. 1).
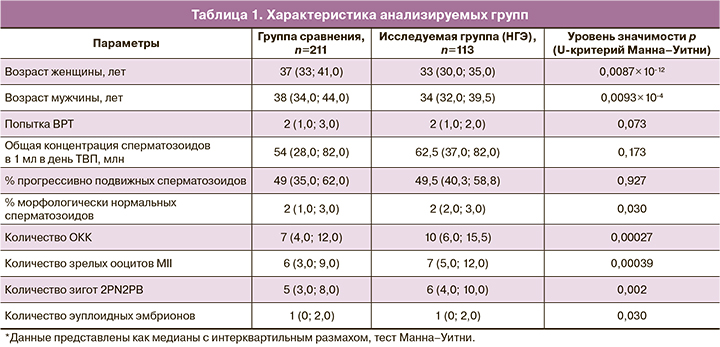
В подгруппе женщин старше 37 лет группы сравнения статистически значимо чаще встречались пациентки более старшего возраста, по сравнению с аналогичной возрастной подгруппой женщин с НГЭ. Количество попыток программ ВРТ статистически значимо было больше у пациенток в группе без НГЭ, по сравнению с группой с НГЭ в подгруппе пациенток моложе 35 лет. Анализ показателей эякулята в день ТВП показал, что в подгруппе пациенток <35 лет у мужчин группы сравнения процент морфологически нормальных сперматозоидов был ниже (2% против 3%), чем аналогичный показатель среди партнеров женщин в группе с НГЭ (p=0,001), что объясняется включением в данную группу супружеских пар с МФ бесплодия. В отношении других характеристик эякулята не было выявлено значимых различий. Сравнительный анализ эмбриологического этапа показал сходные параметры по количеству полученных ОКК и зрелых ооцитов, а также частоте оплодотворения между сопоставимыми по возрасту подгруппами женщин, как в группе с НГЭ, так и в группе без НГЭ (табл. 2).
При попарном сравнении других анализируемых характеристик между аналогичными по возрасту подгруппами в двух анализируемых группах не было выявлено статистически значимых различий (p>0,05).
Статистически значимых различий при сравнении анализируемых характеристик между двумя аналогичными по возрасту подгруппами двух анализируемых групп не было выявлено (p>0,05) (критерий χ2).
Статистически значимых различий при сравнении анализируемых характеристик между двумя аналогичными по возрасту подгруппами двух анализируемых групп не было выявлено (p>0,05) (критерий χ2).
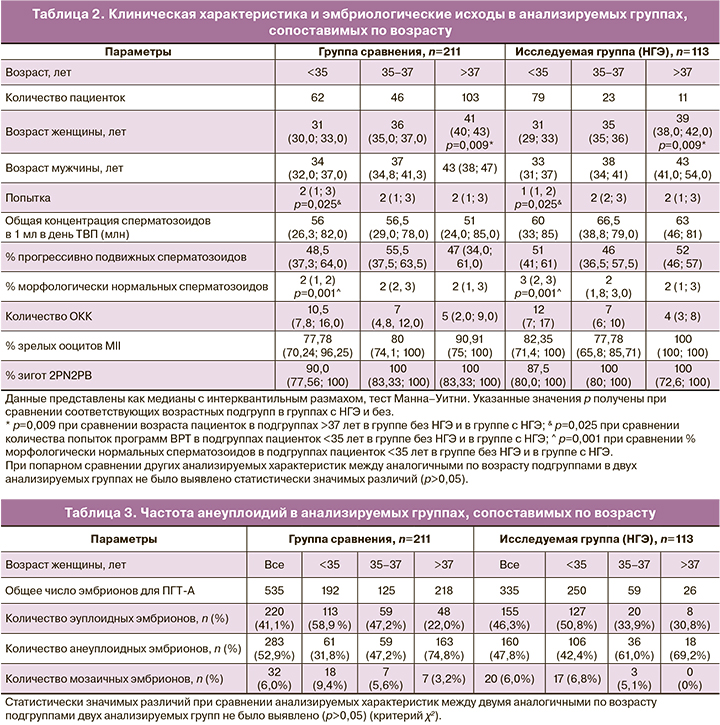
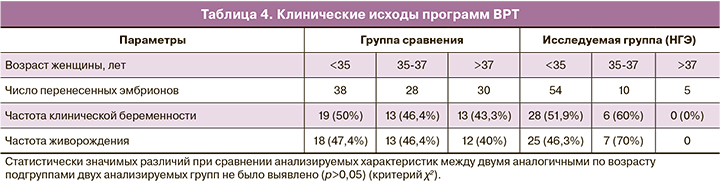
Результаты ПГТ-А показали, что в группе женщин без НГЭ частота анеуплоидий составила 52,9% (283/535) против 47,8% (160/335) в группе с НГЭ, что не имело статистически значимой разницы (табл. 3). Аналогичные результаты были получены при сравнении одновозрастных подгрупп пациенток. Однако стоить отметить, что частота анеуплоидий среди пациенток с НГЭ в подгруппах <35 и 35–37 лет была выше, чем в аналогичных по возрасту подгруппах женщин группы сравнения: 42,4 и 61% против 31,8 и 47,2% соответственно, но не имела статистически значимых различий. Частота имплантации в группе с НГЭ составила 49,3% (34/69), что было сопоставимо с аналогичным показателем в группе сравнения – 46,9% (45/96). В группе с НГЭ было описано 2 случая неразвивающейся беременности и 1 случай внематочной беременности. В группе сравнения было 2 случая прерывания беременности. Частота живорождения в группе женщин с НГЭ составила 46,4%, в том числе одна двойня, а в группе сравнения данный показатель составил 44,8%, что также не имело статистически значимой разницы (табл. 4).
Обсуждение
Эффективность программ ВРТ у женщин с НГЭ ниже, по сравнению с пациентками без НГЭ. Наличие НГЭ в анамнезе отрицательно влияет на качество и/или количество ооцитов и ведет к нарушению децидуализации эндометрия [1]. Существует большое количество противоречивых данных о механизмах патогенетического влияния очагов эндометриоза на эндометрий и качества/количество ооцитов в программах ВРТ. Активно обсуждается вопрос изменения хромосомной стабильности ооцитов под воздействием АФК при НГЭ, что связано с нарушениями сборки веретен деления, неравномерным расхождением хромосом и образованием анеуплоидных гамет. Результаты экспериментальных работ на моделях животных показали, что при наличии эндометриоза воздействие перитонеальной и фолликулярной жидкости на ооциты ведет к нестабильности микротрубочек и веретена деления и к высокой частоте мейотических аномалий в ооцитах [14]. Однако в работе Barcelos et al. не было обнаружено различий в аномалиях веретена деления в процессе in vitro дозревания незрелых ооцитов, полученных у пациенток с НГЭ и здоровых женщин [15]. В настоящей статье получены сопоставимые результаты по частоте анеуплоидий в соответствующих возрастных подгруппах (<35 лет, 35–37 лет, >38 лет) в группе сравнения и в группе с НГЭ (табл. 3). Но частота анеуплоидий в группе пациенток с НГЭ в подгруппах <35 и 35–37 лет была выше, чем в соответствующих подгруппах группы сравнения, что не имело статистически значимых различий, возможно, ввиду недостаточной выборки пациентов. Не было выявлено значимых отличий в отношении характеристик эмбриологического этапа при попарном сравнении одновозрастных групп пациенток.
Анализ результатов ПГТ-А 1880 эмбрионов, полученных от женщин с НГЭ, и 23054 эмбрионов контрольной группы в соответствующих возрастных подгруппах (<35 лет, 35–37 лет, 38–40 лет, 41–42 года, >42 лет) показал сопоставимую частоту анеуплоидий [16]. Аналогичные результаты были описаны коллективом авторов Vaiarelli et al., которые также не нашли значимых различий по частоте анеуплоидий и не обнаружили разницы в количестве полученных MII ооцитов, частоте оплодотворения и проценте криоконсервированных бластоцист [17]. Авторы исследований не отрицают потенциального влияния НГЭ на количество получаемых MII ооцитов в программах ВРТ, что подтверждается другими авторами, описавшими негативное влияние НГЭ на количество зрелых ооцитов [18].
Влияние НГЭ на рецептивность эндометрия является важным вопросом [1]. В ходе анализа исходов беременности и частоты живорождений после переноса эуплоидного эмбриона у женщин с НГЭ (250 эмбрионов) с двумя контрольными группами: пациенты, которым проводилась преимплантационная генетическая диагностика эмбрионов на генные и хромосомные патологии (225 эмбрионов), и супружеские пары с МФ бесплодия (1332 эмбриона) не было обнаружено различий у пациенток с НГЭ по сравнению с пациентами контрольных групп [19]. В нашем исследовании также не было выявлено значимых различий, ни по частоте наступления клинической беременности, ни по частоте живорождения, что согласуется с литературными данными [16,20]. В исследованиях с использованием донорских ооцитов у женщин с НГЭ не было обнаружено снижения рецептивности эндометрия при сравнении исходов программ ВРТ с группой контроля. Транскриптомный анализ 238 генов эндометрия у женщин с НГЭ в период имплантации не выявил каких-либо различий между женщинами с НГЭ и контрольной группой [21].
Неоднозначность получаемых данных в приведенных исследованиях может быть обусловлена разными критериями включения/исключения и недообследованностью когорты пациентов.
Неудачи программ ВРТ в группе женщин с НГЭ могут быть обусловлены морфофункциональными характеристиками получаемых ооцитов, на что может влиять степень тяжести эндометриоза (III–IV стадия) [22, 23]; цитоплазматические дефекты, например, нарушают скорость оплодотворения [24]. Было показано, что аномалии морфологии ооцитов чаще встречались среди пациенток с НГЭ, по сравнению с контрольной группой женщин с МФ бесплодия [25]. На качество ооцитов влияют разнообразные факторы: в клетках кумулюса и клетках гранулезы пациенток с НГЭ повышен уровень апоптоза, что приводит к потере основной поддержки, которую кумулюсные клетки оказывают ооциту (гормоны, ряд ростовых факторов). Сравнение спектральных данных методами инфракрасной и рамановской микроскопии показало глубокое изменение в структуре белков, активацию механизмов окислительного стресса, нарушение регуляции метаболизма углеводов и модификацию метилирования ДНК в клетках гранулезы женщин с НГЭ [26]. В фолликулярной жидкости женщин с НГЭ в анамнезе было отмечено снижение молекул-антиоксидантов и повышение маркеров окислительного стресса, что ведет к преждевременному «старению» клеток гранулезы, которое сопровождается дисфункцией митохондрий и повышенным стрессом эндоплазматического ретикулума. Транскриптомный анализ профиля генов ооцитов пациенток с НГЭ яичников по сравнению с донорскими ооцитами показал изменение экспрессии групп генов, участвующих в регуляции процессов метилирования, функции митохондрий, клеточной активности и роста, метаболизма стероидов, реакции на окислительный стресс [27].
Результаты представленных исследований позволяют сделать вывод в пользу того, что качество ооцитов у женщин, страдающих НГЭ, снижается. Однако, судя по результатам других исследований, данные нарушения не оказывают явного и очевидного клинического влияния на исходы программ ВРТ. Анализ больших регистров по исходам программ ВРТ, включающий около 350 000 циклов, показал, что наличие НГЭ у женщин ассоциировано с более слабым ответом яичников на стимуляцию, однако частота имплантации остается сопоставимой с группами пациенток без НГЭ [28]. Результаты данного исследования и ряда других работ продемонстрировали, что у женщин с НГЭ частота анеуплоидии в программах ВРТ не отличается от пациенток без НГЭ во всех возрастных подгруппах. При НГЭ средней/тяжелой степени тяжести и агрессивном течении для повышения эффективности программы ВРТ рекомендовано проведение ПГТ-А [29]. Программа ВРТ с проведением ПГТ-А позволяет не только оптимизировать выбор наиболее перспективного эмбриона для переноса, но и минимизировать финансово-экономические и временные затраты супружеской пары, которые могут потребоваться для получения эуплоидного эмбриона в программе ВРТ без проведения ПГТ-А.
Заключение
В ходе проведения данного исследования было показано, что НГЭ статистически значимо не влияет на частоту анеуплоидий эмбрионов, полученных в результате лечения бесплодия. Тем не менее доля анеуплоидных эмбрионов у пациенток в группе с НГЭ была выше, чем в группе сравнения. Частота имплантации и частота живорождения были также сопоставимы с группой сравнения. Одним из основных прогностических факторов качества ооцитов, получаемых при ТВП, является возраст женщины. У пациенток с НГЭ, наиболее вероятно, неудачи программ ВРТ ассоциированы с малым количеством получаемых клеток и, возможно, изменением морфофункциональных характеристик ооцитов. Бедный ответ на стимуляцию функции яичников и низкий овариальный резерв у женщин, страдающих НГЭ, в ряде случаев может быть следствием оперативного лечения. Возможно, пациенткам с НГЭ стоит рекомендовать витрификацию ооцитов до проведения операции с целью сохранения фертильности и реализации репродуктивной функции. Дополнительные исследования с адекватным объемом выборки будут иметь решающее значение для дальнейшего подтверждения полученных результатов. Тем не менее стоит подчеркнуть, что ПГТ-А рекомендовано при агрессивном течении НГЭ (III–IV стадии распространения) для выбора эуплоидного эмбриона.



