Рак шейки матки (РШМ) – актуальная медико-социальная проблема. В России заболеваемость РШМ является высокой (15,4 на 100 тыс. населения в 2016 г., в мире – 14,0 на 100 тыс.). Среднегодовой прирост заболеваемости составляет 1,8%, общий прирост за последние 25 лет — 46,1%. Смертность женщин репродуктивного возраста за этот же период выросла в 2 раза [1].
Организованный цервикальный скрининг может снизить заболеваемость РШМ на 75–80% [2]. В странах, где нет таких программ, регистрируется высокий уровень смертности от РШМ [3].
В ХМАО-Югра отлажена система вторичной профилактики (скрининг), но, несмотря на это, ситуация по РШМ неблагоприятная. В структуре онкологической заболеваемости среди женщин РШМ занимает 2-е место. За 5 лет (2013—2017 гг.) отмечено увеличение заболеваемости РШМ с 15,3 до 20,3 на 100 тыс. населения, или на 32,7%. Высока доля запущенных стадий (II–IV) – 38,3%, при этом удельный вес IV стадии увеличился с 9,5% в 2013 г. до 12,4% в 2017 г. (в РФ – 9,3% за 2017 г.). Летальность в течение первого года с момента установления диагноза увеличилась с 9,1 до 12,3%, а средний возраст умерших составил 57,3 и 54,0 года соответственно. Четко выражена тенденция роста заболеваемости РШМ в возрастной группе 30–55 лет [4].
Реализация скрининговой программы по РШМ в ХМАО-Югра затруднена в связи с тем, что размещение населения в округе носит в основном очаговый характер, так как населенные пункты городского типа тесно связаны с предприятиями нефте- и газодобывающих отраслей. Традиционные национальные поселения коренных малочисленных народов Севера, как правило, значительно удалены от медицинских учреждений и не имеют круглогодичного регулярного транспортного сообщения с городскими поселениями. Подобное расселение увеличивает радиусы обслуживания населения, затрудняет доступность медицинских и социальных услуг.
В периодической литературе отсутствуют данные о распространенности вируса папилломы человека (ВПЧ), факторах риска, частоте предраковых заболеваний и РШМ у аборигенов Севера России.
Цель исследования — оценить распространенность и возрастные пределы ВПЧ-инфекции высокоонкогенных типов и региональные особенности факторов риска ассоциированных заболеваний шейки матки среди женщин коренных малочисленных народов Севера (ХМАО-Югра).
Материалы и методы
Проведено одномоментное выборочное популяционное кросс-секционное исследование среди 299 женщин коренных малочисленных народов Севера (ханты и манси), проживающих на территории ХМАО-Югра.
Группу врачей-исследователей направляли в национальные поселения, где они осуществляли подворовый обход потенциальных участниц исследования (согласно избирательным спискам), согласившиеся на участие женщины подписали добровольное информированное согласие.
Врач-исследователь проводил анкетирование, информировал участниц о необходимости выполнения теста на ВПЧ и технологии забора материала с помощью набора Qvintip, после чего женщины самостоятельно выполняли взятие влагалищного отделяемого и передавали пробирку врачу-исследователю. Qvintip – клинически валидированный метод самостоятельного забора материала из влагалища с последующим анализом на ДНК ВПЧ высокого канцерогенного риска (ВКР) 12 типов. Повторный визит включал информирование пациенток о результатах ВПЧ-теста и оценку готовности к дальнейшему исследованию. В медицинском пункте поселения врачом выполнялись осмотр шейки матки в зеркалах, забор материала для определения инфекций, передаваемых половым путем (ИППП), и цитологического исследования.
Критерии включения: возраст 21–65 лет, принадлежность к коренным малочисленным народам Севера (аборигены 3 поколения и более), постоянное проживание в традиционных национальных поселениях, ведение традиционного для аборигенов Севера образа жизни.
 Критерии исключения: психические заболевания, отсутствие или пороки развития шейки матки и матки, стриктура влагалища, беременность, интравагинальное применение лекарственных препаратов или спермицидов менее чем за 1 неделю до проведения исследования, ранее установленный диагноз РШМ, невыполнение требований исследования, отказ от участия.
Критерии исключения: психические заболевания, отсутствие или пороки развития шейки матки и матки, стриктура влагалища, беременность, интравагинальное применение лекарственных препаратов или спермицидов менее чем за 1 неделю до проведения исследования, ранее установленный диагноз РШМ, невыполнение требований исследования, отказ от участия.
Лабораторные исследования выполняли в ОКБ г. Ханты-Мансийска. ВПЧ ВКР (12 типов) и ИППП (Tr. vaginalis, N. gonorrhoeae, Ch. trachomatis, M. genitalium) определяли методом полимеразной цепной реакции (ПЦР), наличие Сandida spp., G. vaginalis, A. vaginae и др. – с помощью микроскопии мазков, окрашенных по Граму, цитологию мазков с шейки матки оценивали по Bethesda system.
Исследование проводилось в соответствии с принципами 18-й Всемирной медицинской ассамблеи (Хельсинки, 1964), одобрено локальным этическим комитетом (Протокол №19/4 от 27.10.2016).
Данные подвергались статистической обработке при помощи программы Statistica 10.0 for Windows. Количественные показатели представлены в виде М (SD), где М – среднее значение, SD – стандартное отклонение. Для качественных признаков указывалась их абсолютная частота (n) и доля (%), значимость различий оценивалась по критерию χ2. Значимыми считали различия при р<0,05. Выявление сопряженности показателей цитологического исследования с факторами риска проведено путем анализа парных таблиц сопряженности с вычислением точного критерия Фишера и интенсивности связи анализируемых признаков (отношение шансов — ОШ, 95% доверительный интервал (ДИ) и коэффициент тетрахорической корреляции ρ). Для определения ассоциации социально-бытовых и клинических характеристик с фактом наличия ВПЧ провели факторный анализ методом максимального правдоподобия и варимаксного нормализованного вращения осей в факторном пространстве.
Результаты
Возраст обследованных совпадал с длительностью проживания в условиях Сервера и составил в среднем 44,1 (10,3) года. Общая медико-социальная характеристика обследованных представлена в табл. 1. В целом свои условия проживания 183 (61%) участницы оценили как хорошие и очень хорошие.
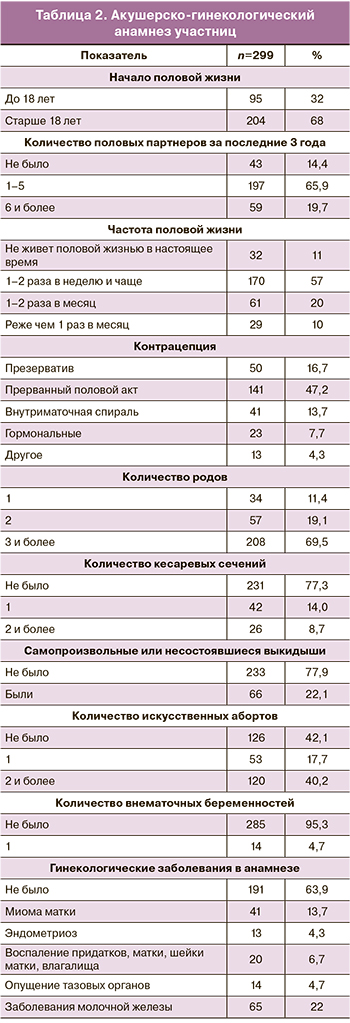 Акушерско-гинекологический анамнез представлен в табл. 2. Обращает на себя внимание высокий риск ИППП у 20% участниц исследования, многодетность (70%), высокая частота выкидышей (22%).
Акушерско-гинекологический анамнез представлен в табл. 2. Обращает на себя внимание высокий риск ИППП у 20% участниц исследования, многодетность (70%), высокая частота выкидышей (22%).
На соматические заболевания в анамнезе указали 79% (237/299) участниц. Анализ частоты ранее перенесенных заболеваний наружных половых органов, влагалища и шейки матки не выявил отличий от популяционных показателей либо она была ниже (ИППП, бактериальный вагиноз). Субъективную оценку своего здоровья как «хорошего» и «отличного» дали 225 (75%) опрошенных.
Большинство обследованных впервые прошли цитологическое исследование в возрасте младше 35 лет (64%, 190/299), ежегодно проходили его 81% (242/299). Получили вакцинацию от ВПЧ только 3 (1%) женщины.
ВПЧ выявлен у 13% (38/299) человек. Наиболее часто вирусы выявлялись у женщин в возрасте от 30 до 50 лет (60,5%, 23/38). Средний возраст составил 41,5 (11,4) года.
Структура выявленных типов вирусов представлена следующим образом (стратифицировано по частоте встречаемости в порядке убывания): 16 тип – 29% (11/38), 31 – 18,4% (7/38), 51 – 15,8% (6/38), 56 и 68 – по 13,2% (5/38), 39 – 10,5% (4/38), остальные 6 типов выявлены в менее 5% (по 1–2 случаев из 38). Среднее число типов ВПЧ на 1 женщину составило 1,4 (0,5).
При осмотре в зеркалах выявлены деформации и рубцовые изменения шейки матки у 5% (15/299) пациенток, эндометриоз – у 1% (3/299), полипы – у 0,3% (1/299), воспалительные процессы – у 10,4% (31/299).
При лабораторном обследовании выявлены микроорганизмы, представленные в табл. 3. Для сравнения обследованный контингент был разделен на две подгруппы – неинфицированные ВПЧ (ВПЧ–, n=261) и инфицированные ВПЧ (ВПЧ+, n=38).
Нормальный состав микробиоты влагалища имел место у 87,7% (262/299) обследованных, ИППП и инфекции, вызванные условно-патогенными микроорганизмами, выявлены у 12,3% (37/299). При этом у ВПЧ+ женщин этот показатель составил 31,6% (12/38) и в большинстве случаев был представлен микроорганизмами анаэробной группы (75%, 9/12).
Результаты цитологического исследования представлены в табл. 4.
Атипические изменения эпителия шейки матки различной степени тяжести среди всей популяции обследованных женщин выявлены у 5,7% (17/299), из числа инфицированных ВПЧ – у 29% (11/38), при этом HSIL – у 10,5% (4/38). ВПЧ в этих случаях были представлены 16 типом во всех случаях при ASCUS и LSIL, 16 и/или 31 типом – при HSIL. Случаев аденокарциномы и других злокачественных новообразований не выявлено.
Анализ факторов риска ВПЧ-инфекции и РШМ, выделенных экспертами ВОЗ (2019) [5], дал следующие результаты: наличие сопутствующих ИППП, таких как генитальный герпес, хламидийная инфекция и гонорея в анамнезе – 13% (39/299) и в настоящее время – 3% (9/299); количество родов в анамнезе 3 и более – 70% (208/299); курение табака – 24% (71/299); персистенция ВПЧ ВКР – 13% (38/299).
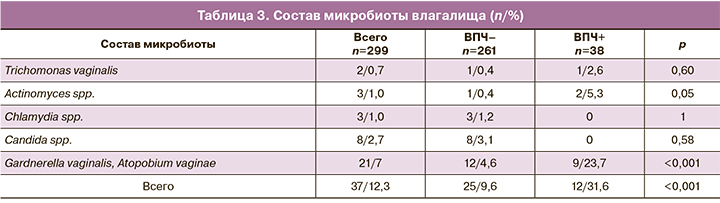
Анализ вклада факторов риска в развитие атипических изменений эпителия шейки матки у носительниц ВПЧ представлен в табл. 5, где видна сильная сопряженная связь с наличием бактериального вагиноза в анамнезе и в настоящее время, воспалительными заболеваниями нижнего отдела полового тракта и воспалительным типом мазка в настоящее время.
По результатам проведенного факторного анализа были выделены критерии, формирующие 3 латентных фактора, связанных с носительством ВПЧ. Первый был охарактеризован как «репродуктивный», с ним наиболее тесно коррелировали количество беременностей (0,867), он описывал 26% информации, характеризующей носительство ВПЧ у коренных жительниц Севера. Второй латентный фактор был обозначен как «фактор полового поведения», поскольку наиболее тесно с ним коррелировало количество половых партнеров (0,873) как в настоящее время, так и за последние 3 года (0,823), он описывал 24% информации. Третий латентный фактор – «репродуктивное здоровье» – формировали корреляции с гинекологическими заболеваниями в анамнезе (0,802) и операциями на половых органах (0,802), он описывал 23% информации.
Обсуждение
В настоящее время не существует лечения ВПЧ-инфекции, поэтому выяснение региональных особенностей инфицированности населения, вариаций генотипов ВПЧ и факторов риска необходимо для организации качественной ранней диагностики и профилактики РШМ.
Показатель распространенности ВПЧ-инфекции используют для количественной оценки пораженности населения ВПЧ-инфекцией. Установлено, что приблизительно у 12% женщин с нормальной цитологической картиной шейки матки определяется ВПЧ-инфекция [5].
Распространенность ВПЧ в разных странах колеблется в широких пределах, например, в Китае — 10% (n=1570), в Италии – 46% (n=654) обследованных. Российские данные значительно варьируют в зависимости от региона: носительство ВПЧ в Санкт-Петербурге выявлено в 29% случаев (n=309), в Челябинске — в 35% (n=1106), в Москве и Московской области — в 14% (n=8533), в Уральском регионе — в 4% (n=878), в других регионах (Омск, Петрозаводск, Томск) — у 9–50% пациентов. Чаще всего обнаруживаются 16, 18 типы, на 2-м и 3-м месте оказались ВПЧ 56 и 31 типов [6].
Настоящее исследование среди коренных народов Севера ханты и манси выявило распространенность ВПЧ в 13% случаев, что совпадает со средним мировым показателем. В структуре выявленных типов вируса преобладали 16, 31, 56 (суммарно – 42%), что также совпадает с данными литературы, кроме 18 типа, который встречался редко (3,7%).
По данным систематического обзора, выполненного J. Ting и соавт. [8], частота эпителиальных поражений высокой и низкой степени у женщин, инфицированных ВПЧ, составляет менее 10%, а у женщин без ВПЧ – менее 5% [7], распространенность инвазивного рака шейки матки – 1,7%.
Среди обследованных нами женщин общей популяции указанные поражения встретились в 5,7% случаев, а у пациенток с выявленным ВПЧ — в 29%, что оказалось в 3 раза выше, чем в исследованиях, представленных в обзоре J. Ting и соавт. Данное обстоятельство наводит на мысль о влиянии иных факторов риска, кроме ВПЧ, на частоту развития предраковых заболеваний шейки матки. Результаты исследований показывают, что сочетание биологических, социально-экономических факторов и факторов здоровья способствует возникновению РШМ. Среди них: географические особенности распространенности ВПЧ, инфицированность хламидиями и вирусами (ВИЧ, герпес), несколько сексуальных партнеров, высокий паритет, курение, ожирение (увеличение риска не менее чем в 2 раза) [9].
В настоящем исследовании были выделены такие факторы риска, как наличие бактериального вагиноза в анамнезе и в настоящее время, а также наличие заболеваний нижнего отдела полового тракта воспалительного характера. В свази с этим вызывает интерес роль микробиоты в инициации и/или прогрессировании атипических интраэпителиальных поражений шейки матки. Так, в исследовании Л.Д. Андосовой и соавт. [10] обнаружено, что при LSIL дисбиоз обнаруживается у 53% пациенток, а при HSIL – у 85% (р=0,01). Нарушения микробиоценоза влагалища (включая ИППП) среди народов ханты и манси составили всего 14% в общей популяции обследованных, а у ВПЧ-инфицированных – 31,6% и в большинстве случаев были представлены микроорганизмами анаэробной группы (75%). Кроме того, выявлены латентные факторы риска – количество родов в анамнезе, количество половых партнеров в настоящее время и за последние 3 года, наличие гинекологических заболеваний и операций на половых органах в анамнезе.
В России охват женского населения цитологическим скринингом колеблется от 10 до 25% [6], что не позволяет рассматривать его как эффективный. Новые программы скрининга, основанные на выявлении ВПЧ, позволят охватить скринингом необходимое количество женского населения – не менее 80%. При этом для женщин, проживающих в отдаленных и труднодоступных местах, альтернативой может служить самостоятельный забор материала для лабораторного исследования с помощью набора Qvintip, который был использован в настоящем исследовании.
В ходе исследования были отмечены основные преимущества данного теста – снижение прямых и непрямых затрат на обследование, простота использования, отсутствие дискомфорта, боли и неприятных ощущений в ходе процедуры забора материала, возможность использования в труднодоступных населенных пунктах. Т.Е. Белокриницкой и соавт. [11] было показано, что результативность обследования с помощью устройства Qvintip была выше, чем при заборе материала врачом. Использование устройства Qvintip, по мнению авторов, повышает шанс выявления ВПЧ ВКР в 4,75 раза (33,3% vs 9,5%). Н.В. Артымук и соавт. [12] отмечают, что чувствительность диагностики ВПЧ ВКР при взятии материала самостоятельно женщиной с помощью набора Qvintip составляет 78,3%, специфичность — 91,3%.
Заключение
Таким образом, распространенность ВПЧ-инфекции высокого онкогенного риска среди женщин коренных малочисленных народов Севера (ХМАО-Югра) составляет 13% с преобладанием типов 16, 31 и 51. Из числа инфицированных ВПЧ атипические интраэпителиальные поражения шейки матки выявляются у 29% обследованных, HSIL – у 10,5%.
К региональным особенностям факторов риска относятся наличие бактериального вагиноза в анамнезе и в настоящее время, заболеваний нижнего отдела полового тракта воспалительного характера, а также высокий паритет, большое количество половых партнеров, наличие гинекологических заболеваний и операций на половых органах в анамнезе.
Самостоятельный забор материала для лабораторного исследования на ВПЧ с помощью набора Qvintip является перспективным для охвата необходимого количества населения организованным скринингом.



