Демографическая ситуация в настоящее время характеризуется увеличением продолжительности жизни, а следовательно, и ростом популяции пожилых людей. В России количество женщин пери- и постменопаузального возраста составляет более 21 млн [1].
Климактерический период
Климактерический период — физиологический период, в течение которого на фоне возрастного снижения и последующего «угасания» функции яичников происходит биологическая трансформация различных функций женского организма, изменяется работа отдельных структур центральной нервной системы, активность вегетативной нервной системы, повышается риск развития сердечно-сосудистых осложнений, в значительной мере обусловленных снижением сосудистой эластичности [2], а также меняются структура костей (увеличивается риск снижения минеральной плотности костной ткани (МПКТ)) и body image (восприятие собственного тела). Оптимизм и принятие своего облика, по-видимому, являются важными факторами, которые могут повлиять как на физическое, так и психическое здоровье женщин в возрасте 50 лет и старше [3]. 40–60% женщин в течение «переходного» периода отмечают снижение познавательной функции мозга, нарушение сна, лабильность настроения в результате дефицита эстрогенов в организме в этот период [1]. В свою очередь, снижение познавательной функции мозга может оказывать влияние на все сферы жизни женщины, определяющие ее качество жизни: физическое здоровье, психологическое состояние, социальные взаимоотношения и духовные интересы.
Дефицит эстрогенов является одной из основных причин развития менопаузального метаболического синдрома (МС), который сам по себе может приводить к увеличению риска сердечно-сосудистых заболеваний у женщин в постменопаузальном периоде. У женщин, начиная с «переходного» периода и заканчивая постменопаузой, МС является более значимым фактором риска сердечно-сосудистых заболеваний, чем у мужчин в период андропаузы [4]. Не следует забывать, что у женщин чаще, чем у мужчин, развивается МС, и связано это как с «особенной» реакцией на стресс, так и более низким социально-экономическим статусом женщины [5].
Климактерический статус
С каждым годом появляется все больше данных по оценке качества жизни женщины с переходом в климактерий, а также проводятся сравнительные анализы влияния того или иного вида терапии в этом периоде жизни женщины. Сейчас все больше мы говорим о том, что климактерический статус – это комплекс биологических (например, симптомы климактерия, риск хронических заболеваний, снижение МПКТ), социальных (например, риск лишиться работы в связи с определенным возрастом) и психофизиологических (например, нарушение сна, психические нарушения) факторов [6]. В исследовании The Gender and Body Image (GABI) Study с включением 1849 женщин старше 50 лет было показано, что четыре проблемы, которые волнуют женщин с вступлением в менопаузу [7], это: 1) физический и психический дискомфорт в период «старения»; 2) социальная несправедливость, проблемы связанные со «старением»; 3) важность само- и взаимопомощи; 4) сохранение социальной роли в жизни.
Одно из крупнейших исследований, в которое были включены 19 028 женщин, продемонстрировало, что с менопаузой чаще ассоциированы биполярные расстройства, депрессия, тревожные расстройства и расстройства сна [8]. Скрининг в критические периоды в жизни женщины (менархе, беременность, послеродовый период, менопауза) через определенные промежутки может привести к раннему выявлению депрессии, профилактике и лечению и может предотвратить связанные с ней сопутствующие состояния [9].
Особенности психического статуса в климактерии
Следует помнить, что женщины в постменопаузе имеют статистически значимо больший балл в рамках диагностики депрессии, тревожного, биполярного, обсессивно-компульсивного расстройств и посттравматического стрессового расстройства в отличие от женщин в пременопаузе. Чем старше женщина, тем выше риск нарушений психологического статуса (p<0,001) [10].
В настоящий момент выдвинуты различные гипотезы и теории развития депрессивных и тревожных нарушений в менопаузе. Помимо основной из них – снижения уровня эстрадиола в организме женщины, существуют и другие гормональные объяснения этим нозологиям. Риск возникновения депрессивных нарушений максимален в течение 5–6 лет от последней нормальной менструации. Пики эстрадиола (Э2), которые характерны уже для перименопаузы, могут приводить к дисрегуляции гипоталамо-гипофизарно-надпочечниковой оси (ГГН-оси) и тем самым провоцировать нарушения настроения. В свою очередь, пики Э2 у пациенток с различными дистимиями1 приводят к повышению уровня кортизола, что усугубляет дисрегуляцию ГГН-оси [11]. Чем вариабельнее уровни Э2, тем эмоционально чувствительнее женщина и тем выше риск развития депрессивных расстройств [11].
В последние годы в профессиональной медицинской сфере активно сотрудничают психиатр и акушер-гинеколог при ведении пациенток в климактерии, так как менопауза – это период новых случаев депрессивных расстройств и усугубления ранее существующей патологии психологического статуса. Кроме того, дебют нарушений психологического статуса может быть уже у женщины в пременопаузе, что будет проявляться в виде атипичных депрессивных расстройств, таких как нарушения сна, увеличение веса, увеличение аппетита [12].
И именно акушер-гинеколог может провести скрининг и/или заподозрить эти нарушения и вовремя рекомендовать консультацию психоневролога/психиатра своей пациентке [12, 13]. Тандем гинекологии и психиатрии – тенденция с начала XX в. [13]. Психиатры активно изучают вопросы назначения МГТ и ее влияния на составляющие психологического здоровья женщины. Одно из крупнейших исследований показало, что назначение МГТ в рамках «терапевтического окна» снижает риск развития депрессивного синдрома, однако не влияет на риск развития большой депрессии [14].
Синдром хронической усталости [D86.9] – нозология, которая обсуждается специалистами различных специальностей всего мира, предпринимаются попытки выделения факторов риска и определения тактики ведения. Было показано, что риск и частота встречаемости синдрома хронической усталости выше при определенной гинекологической патологии: сам факт наступления менопаузы, преждевременная менопауза, обильные менструальные кровотечения, межменструальные кровянистые выделения, эндометриоз, использование неконтрацептивных гормональных препаратов, хроническая тазовая боль, гинекологические операции, особенно гистерэктомия [15].
Не следует забывать также, что степень тяжести вазомоторных симптомов, как правило, связана со степенью выраженности нарушений сна и усталости [16].
Прибавка массы тела и висцеральное ожирение
Прибавка массы тела – это одна из частых жалоб женщины, вступающей в период менопаузы, и именно это (после вазомоторной симптоматики) заставляет большинство женщин обращаться к акушеру-гинекологу в этот период. Уже с периода пременопаузы женщина замечает изменение композиционного состава тела [17]. Считается, что чем образованнее женщина (наличие высшего профессионального образования), тем ниже риск прибавки массы тела/ожирения у нее в климактерии [18]. В течение менопаузального перехода и ранней постменопаузы у женщины увеличение массы тела может составлять до 20–25% [19]. Снижение уровня эстрогенов в организме женщины – основная причина этих изменений. Эстроген подавляет аппетит, усиливая действие аноректических сигналов (холецистокинина, аполипопротеина A-IV, лептина, нейротрофического фактора головного мозга (BDNF)), а также снижает активность орексигенных сигналов (меланинконцентрирующего гормона и грелина) [20]. Второй причиной прибавки массы тела можно считать состояние относительной гиперандрогении, которое сопровождает женщину в течение климактерия. Яичники в постменопаузе продолжают выделять андрогены с более высокой биодоступностью вследствие уменьшения уровня глобулина, связывающего половые гормоны (ГСПС). Эти гормональные изменения в дальнейшем увеличивают инсулинорезистентность (ИР) и компенсаторную гиперинсулинемию и, соответственно, риск кардиометаболических событий [21].
Принципиальным моментом является то, что снижение уровня эстрогенов во время менопаузы приводит к сдвигу отложения жировой ткани в пользу висцерального депо. И несмотря на то, что превращение эстрогенных предшественников (андростендиона, вырабатываемого надпочечниками, и небольшого количества тестостерона из яичника) в эстрогены с помощью ароматазы происходит преимущественно в висцеральном депо (и эту ткань иногда называют третьим яичником – third ovary), общее количество эстрогена, вырабатываемого после менопаузы, намного меньше, чем в репродуктивном возрасте женщины [20, 22], и не спасает женщину от прибавки массы тела.
Вес-ассоциированная депрессия
Одной из важных причин (которой, к сожалению, уделяется меньше всего внимания со стороны как пациентки, так и лечащего врача) является нарушение психологического статуса. Психосоциальные факторы играют важную роль во взаимосвязи депрессивных симптомов и веса у женщины, и результаты исследований подчеркивают необходимость акцента внимания как на поведенческих факторах, так и на менопаузальном периоде. Стрессовая гиперфагия и менопауза значительно способствовали развитию вес-ассоциированной депрессии (depressive symptom-weight association) [23]. Количество висцерального жирового слоя независимо коррелирует с наличием депрессии у женщины (р=0,012), причем корреляция эта прямо пропорциональна [24].
В экономически развитых странах на протяжении последних лет отчетливо прослеживается тенденция к увеличению числа больных с нарушением пищевого поведения (НПП), сопровождающегося тяжелыми соматическими и эндокринными расстройствами, которые провоцируют развитие психосоциальной дезадаптации. Проведено мало исследований по сравнительному анализу психологических особенностей, мотивации поведения человека и их связи с НПП2 [25]. Расстройства пищевого поведения – это комплексы симптомов, которые возникают из-за длительного воздействия поведенческих, эмоциональных, психологических, межличностных и социальных факторов. Например, люди с НПП часто используют еду и контроль над едой как попытку компенсировать неосознаваемые негативные чувства и эмоции, как способ восстановить контакт со своим «Я». В некотором роде диеты, переедание и «детоксы» могут использоваться либо как способ справиться с тяжелыми чувствами, либо как способ чувствовать контроль над собственной жизнью. Но в конечном счете такое поведение вредит эмоциональному и физическому здоровью человека, снижает его самоуважение и заменяет истинное чувство компетентности и способности самоконтроля [26]. Гипотеза многих исследований: хронически переедающие женщины не имеют конструктивной внешней границы, зависят от мнения окружающих, не принимают свой телесный образ [27]. Стрессовая гиперфагия для женщины – это больше стремление съесть что-то и наличие факта еды, чем огромные порции и большие обильные приемы пищи. Ожирение у женщины – это, как правило, психологический аспект, чем какие-либо иные факторы избыточной массы тела [28]. Одним из факторов, который может быть связан с накоплением жировой массы и стрессовой гиперфагией, является активность лимбическо-гипоталамо-гипофизарно-надпочечниковой оси в условиях хронического стресса. Тем не менее исследования последних лет показывают, что важна роль половых и гонадотропных гормонов в физиологии ожирения и стрессового набора веса, и это более характерно для женщин, чем для мужчин [29].
Важно отметить, что если у женщины уже есть нарушение психологического статуса (например, депрессия, лабильность настроения, стрессовая гиперфагия), то во время отрицательных эмоций они преимущественно потребляют сладкую, жирную, энергетически емкую пищу, которая может обеспечить «защиту» от стресса, и что подтверждается угнетением ГГН-оси, хотя, с другой стороны, активация ГГН-оси может сама стимулировать аппетит в такой ситуации [30]. В свою очередь, сочетание ожирения и НПП – это дополнительный фактор риска развития сердечно-сосудистых заболеваний в сравнении с женщинами с ожирением и без НПП [31].
Вопросы прибавки массы тела у женщин в менопаузе – это уже проблема, которой очень активно занимаются неврологи и психиатры, так как, по данным крупнейшего метаанализа, который включил 19 исследований и 589 649 участников со средним возрастом 35–65 лет и средним индексом массы тела (ИМТ) ≥30 кг/м2, отмечено, что ожирение в середине жизни увеличивает риск развития деменции [32], а это, в свою очередь, будет усугубляться эстрогендефицитным состоянием в «переходном» возрасте женщины.
Несмотря на гормональные предпосылки прибавки массы тела у женщины в климактерии не стоит забывать, что образ жизни женщины вносит существенный вклад в эту проблему. Сидячий образ жизни (физическая активность 30 минут менее 3 раз в неделю) способствует более высокому значению окружности талии (ОТ) и более высокой распространенности ожирения. Как ожирение, так и патологический климактерический синдром, включая нарушение сна по типу бессонницы и наличие депрессии, были положительно связаны с сидячим образом жизни [33, 34].
Исследование Y. Ma и соавт. [35] с включением 71 809 женщин в постменопаузе, за которыми наблюдали в течение 3 лет, имело цель оценить взаимосвязь влияния депрессии, ИМТ, ОТ и риска развития сахарного диабета (СД) 2 типа и сердечно-сосудистых заболеваний. Выводы исследования таковы, что контроль за ИМТ среди женщин с нарушениями психологического статуса (в том числе с депрессией) может быть целесообразным для предотвращения развития СД 2 типа и сердечно-сосудистых состояний. Аналогичные результаты были получены в популяционном исследовании KORA-F3 Augsburg, где были обследованы 983 женщины в постменопаузе в возрасте 35–74 лет. Авторы показали, что у женщин в постменопаузе лабильность настроения (подавленность) может усиливать негативное влияние ожирения на качество жизни, в то время как СД 2 типа в совокупности с ожирением может быть предиктором нарушений когнитивного статуса качества жизни женщины [36]. Получается, что компенсация нарушений психологического статуса у женщины в постменопаузе может быть фактором, снижающим риск вес-ассоциированного развития СД 2 типа. А при наличии в постменопаузе СД 2 типа обязателен скрининг на депрессии и другие нарушения психологического статуса для улучшения качества жизни женщины [37].
Роль менопаузальной терапии
Очень интересная работа была опубликована в 2017 г., в ней авторы задали себе вопрос: «Ожирение в менопаузе – наша небрежность или неудачная неизбежность?» («Obesity in menopause – our negligence or an unfortunate inevitability?»), и в рамках рассуждения был сделан вывод, что эту проблему можно эффективно решать, реализуя принципы здорового образа жизни, а также, когда это целесообразно и возможно, применение МГТ [38].
Несмотря на то что МГТ – золотой стандарт терапии в климактерии, у врача-клинициста по-прежнему остается вопрос: назначать гормональную терапию пациентке или нет? Пусковым механизмом продолжающегося сопротивления медицинской общественности и самих женщин широкому использованию МГТ является публикация первых результатов исследования «Инициатива во имя здоровья женщин» (WHI) в 2002 г., продемонстрировавших неблагоприятный профиль пользы/риска в основном комбинированного режима терапии (конъюгированные эквинные эстрогены (КЭЭ) и медроксипрогестерона ацетат (МПА)) у женщин в постменопаузе достаточно широкого возрастного диапазона. Средний возраст участниц в исследовании WHI составлял 63 года, в то время как средний возраст наступления менопаузы в США и Европе близок к 51 году. В цели исследования WHI не входила оценка пользы/риска МГТ, назначенной для лечения вазомоторных симптомов и повышения качества жизни у женщин в постменопаузе, а только возможность ее профилактического влияния в отношении возрастных хронических заболеваний [39]. Повышенное внимание СМИ к этим результатам WHI и последовавшее бурное обсуждение медицинской общественностью привели к росту обеспокоенности женщин по поводу возможного повышения рисков сердечно-сосудистых заболеваний и особенно рака молочной железы при использовании МГТ, а в итоге – к драматическому снижению ее использования во всем мире [40]. Последующий углубленный анализ результатов WHI показал, что МГТ характеризуется благоприятным профилем пользы/риска у более молодых женщин, которые начинают терапию в близкие к менопаузе сроки [41].
При выборе МГТ с учетом повышения HRQoL3 в качестве ключевого результата в большинстве клинических случаев предпочтение можно отдать «линейке» препаратов, содержащих прогестаген дроспиренон (ДРСП) с уникальным сочетанием антиандрогенных и антиминералокортикоидных эффектов: низкодозированной комбинации 1 мг 17b-эстрадиола/2 мг ДРСП и ультранизкодозированной комбинации 0,5 мг Э2/0,25 мг ДРСП. Активация в климактерии ренин-ангиотензин-альдостероновой системы играет важную роль в развитии большинства негативных метаболических и сердечно-сосудистых эффектов и появлении тех изменений, которые могут «не нравиться» как самой пациентке, так и врачу-клиницисту, наблюдающему женщину: композиционное изменение тела и формирование висцерального ожирения, ИР, СД 2 типа, эндотелиальная дисфункция, дислипидемия, артериальная гипертензия и др. [43, 44]. Кроме того, не менее важным свойством ДРСП является его способность воздействовать на висцеральную жировую ткань и дифференцировку адипоцитов, что препятствует увеличению объема висцерального жира, нормализует чувствительность к инсулину и липидный обмен. Эти свойства крайне важны при профилактике МС и артериальной гипертензии у женщин в ранней постменопаузе [45].
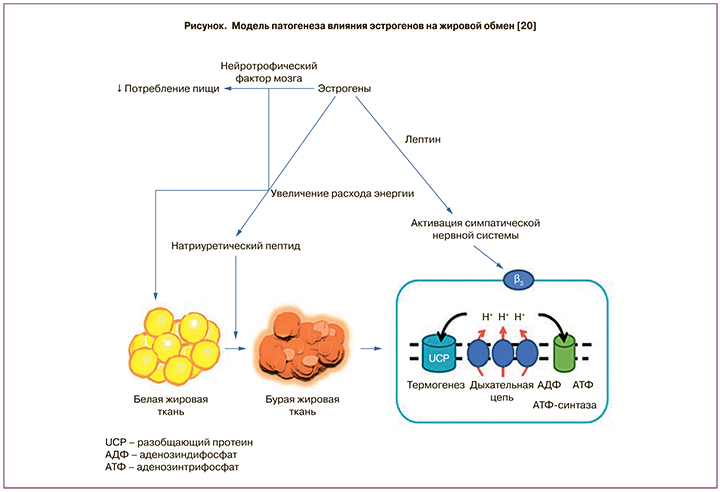
В исследование С.Н. Толстова и соавт. были включены 162 женщины периода ранней постменопаузы с различными проявлениями климактерического синдрома в возрасте 52,5 (48,0–56,0) года. Целью исследования стала оценка выраженности абдоминального ожирения и нарушений углеводного обмена у женщин в период ранней постменопаузы и возможности длительного использования комбинированной МГТ 1 мг Э2/2 мг ДРСП для коррекции выявленных нарушений. Авторы показали, что длительное применение комбинации 1 мг Э2/2 мг ДРСП ассоциировано с отчетливым уменьшением вероятности развития нарушений углеводного обмена (отношение шансов (ОШ) 0,42; 95% доверительный интервал (ДИ) 0,17–1,04). У женщин на фоне МГТ, в состав которой входили 1 мг Э2/2 мг ДРСП, к 12-му месяцу терапии достоверных изменений углеводного обмена выявлено не было: уровни базальной и постпрандиальной глюкозы крови, маркеры ИР (инсулин, индекс НОМА-IR) значимо не отличались от исходного уровня. Было показано снижение интенсивности ИР: уменьшение уровня инсулина, снижение индекса НОМА-IR, сочетающееся со снижением уровней базальной и постпрандиальной глюкозы крови. Авторы подчеркнули, что снижение показателей ИР сочеталось с уменьшением выраженности абдоминального ожирения. И совсем другие результаты получены во время анализа 2-й группы (группы контроля): по мере прогрессирования ожирения было отмечено повышение уровней инсулина и индекса НОМА-IR, а также – отчетливая тенденция к повышению уровня постпрандиальной глюкозы в сыворотке крови. При проведении корреляционного анализа установлены связи между уровнями инсулина и показателями ИМТ и ОТ у женщин. Таким образом, на фоне длительного применения комбинированной МГТ с составом ДРСП + 1 мг Э2 установлены положительные изменения углеводного обмена и ИР, уменьшение выраженности висцерального ожирения и снижение частоты новых случаев нарушений углеводного обмена [46]. Аналогичные выводы были сделаны Paoletti и соавт. в исследовании по сравнению двух видов МГТ: 1 мг Э2/0,5 мг норэтистерона ацетата, 1 мг Э2/2 мг ДРСП с плацебо в отношении изменения композиционного состава тела. Добавление ДРСП в состав МГТ более выраженно способствует снижению ИМТ и уменьшению отечного синдрома [47]. Объяснить такие изменения отчасти можно тем, что эстрогены защищают от ожирения благодаря подавлению аппетита и увеличению расхода энергии за счет активации эстрогеновых рецепторов в ядрах гипоталамуса (рисунок), и, как следствие, женщины в постменопаузе имеют более низкий уровень окисления жиров и расход энергии во время тренировок и сна по сравнению с женщинами в пременопаузе [20].
Одна из немногих работ, которая проведена для оценки влияния МГТ на когнитивную функцию, была выполнена в 2018 г. С.А. Гаспарян и соавт. Авторы провели оценку изменений когнитивной функции, показателей качества жизни женщин в менопаузе на фоне применения различных видов МГТ. В исследование были включены 80 женщин в постменопаузе с нейровегетативными, психоэмоциональными симптомами. Пациентки были разделены на 4 группы: 1-я группа получала 17-ß-эстрадиол 1 мг, ДРСП 2 мг, 2-я – 17-ß-эстрадиол 0,06% трансдермально, микронизированный прогестерон 200 мг внутрь, 3-я – монотерапию 0,06% 17-ß-эстрадиола трансдермально, 4-я – не получала МГТ. В 1-й группе достоверно повысился уровень NGF (nerve growth factor)4, улучшился нейровегетативный, психоэмоциональный статус в сравнении со 2-й группой. В 3-й группе не было динамики, а в 4-й группе когнитивные нарушения прогрессировали. Авторы сделали вывод, что системное введение 17-ß-эстрадиола 1 мг/ДРСП 2 мг эффективно восстанавливает когнитивную функцию, качество жизни в ранней постменопаузе в сравнении с 0,06% трансдермального геля 17-ß-эстрадиола, 200 мг микронизированного прогестерона внутрь или монотерапией эстрогенами [1].
Крупномасштабное контролируемое проспективное исследование с активным наблюдением EURAS-HRT (European Active Surveillance Study of Women) было проведено в 7 европейских странах (>30 000 участниц и >100 000 женщин-лет наблюдения) с целью сравнения безопасности комбинации 1 мг Э2/2 мг ДРСП с другими препаратами для непрерывного комбинированного режима МГТ [49]. На фоне этой комбинации была обнаружена статистически значимо более низкая частота неблагоприятных артериальных событий (артериальной тромбоэмболии, острого инфаркта миокарда, ишемического инсульта) по сравнению с другими препаратами для непрерывного комбинированного режима МГТ, при этом не было выявлено никаких различий в показателях венозной тромбоэмболии [49]. В ходе 2-летнего наблюдения за здоровыми женщинами в постменопаузе на фоне комбинации Э2 1 мг/ ДРСП 2 мг отмечено статистически значимое снижение не только веса, но и соотношения центральной/периферической жировой массы по данным двухэнергетической рентгеновской абсорбциометрии (ДЭРА) по сравнению с исходными данными [49]. Получение такой информации в ходе консультирования может повысить приверженность гормональной терапии женщин, опасающихся повышения АД или прибавки веса на ее фоне.
Заключение
В современном мире невозможно решать вопросы по ведению женщины в климактерии без учета ее психологического статуса. Крайне важно подойти к выбору терапии в этом периоде (например, МГТ, препараты по медикаментозному лечению ожирения, психотропные препараты), которая не просто не навредит женщине, а улучшит течение этого непростого этапа жизни.
Необходимо помнить, что психическое состояние женщины в постменопаузе может способствовать повышению риска кардиометаболических осложнений (СД 2 типа, усугубление проблемы избыточной массы тела, сердечно-сосудистые заболевания). Для решения комплекса постменопаузальных проблем сегодня используют МГТ как золотой стандарт терапии (взвесив все риски и пользу от данного вида лечения). На данный момент МГТ, содержащая в своем составе ДРСП, демонстрирует благоприятный профиль безопасности и эффективности при терапии не только классических симптомов климактерического расстройства, обусловленных дефицитом эстрогенов в постменопаузе, но и оказывает положительное влияние на нарушения жирового и углеводного обменов, а также способствует улучшению психоэмоционального статуса женщины.



