Внутриутробная задержка роста плода (ЗРП) – наиболее распространенное осложнение, затрагивающее до 5–10% беременностей. Одной из основных причин ее возникновения является плацентарная недостаточность, которая обусловлена метаболическими и гемодинамическими расстройствами в функциональной системе «мать-плацента-плод», вследствие чего снижается поступление питательных веществ и кислорода, приводящее к нарушению соматического роста плода [1, 2]. Данное нарушение можно оценивать количественно – вес плода меньше 10-го процентиля для соответствующего гестационного возраста в сочетании с ультразвуковыми признаками ЗРП и аномальными допплерометрическими показателями в пупочной и средне-мозговой артериях [1]. У маловесных плодов в четыре раза повышен риск: 1) перинатальной смертности; 2) развития респираторного дистресс-синдрома и некротизирующего энтероколита; 3) неблагоприятных неврологических исходов, связанных с нарушением объема и миелинизацией церебральных структур мозга [2, 3].
Механизмы, лежащие в основе ЗРП, изучены недостаточно, поскольку данная патология полиэтиологична. К основным факторам развития ЗРП относятся: 1) фетальный фактор (генетические и хромосомные аномалии); 2) плацентарный (нарушение процессов имплантации и плацентации); 3) материнский фактор (сосудистые заболевания, гипоксия, дефицит питания, воздействие токсинов и инфекционных агентов) [1]. Существенную роль в запуске патологических реакций, приводящих к гестационным осложнениям, в том числе к ЗРП, играет окислительный стресс (ОС), представляющий собой нарушение баланса в системах свободнорадикального окисления и антиоксидантной защиты [4]. ОС, возникающий вследствие плацентарной ишемии/реоксигенации, обусловленной материнско-плодовой сосудистой мальперфузией, оказывает высокотоксичные эффекты при образовании пероксидов и свободных радикалов, приводящие к структурным повреждениям клеток и тканей организма [4]. Активные формы кислорода оказывают влияние на экспрессию плацентарного (PLGF) и эндотелиального факторов роста (VEGF), а повышенная генерация супероксида и оксида азота с образованием пероксинитрита приводит к сосудистой дисфункции [5].
Возрастающий интерес к исследованию малых некодирующих РНК – микроРНК (мкРНК), выступающих в роли модуляторов значительного числа биологических процессов, открывает новые возможности понимания патогенеза нарушений, связанных с плацентарной недостаточностью. В частности, идентифицированы мкРНК (miR-518b, miR-1323, miR-516b, miR-515-5p, miR-520h, miR-519d и miR-526b), экспрессия которых снижена при ЗРП [6, 7]. Показано участие членов семейства miR-200, miR-21, miR-23a/b в сосудистой дисфункции, опосредованной ОС [7, 8], а miR-210 является индикатором гипоксии и ключевым участником в митохондриальном метаболизме, поскольку ее повышенная экспрессия способствует образованию активных форм кислорода [7, 9]. Следует отметить, что большинство проводимых исследований по экспрессии мкРНК при гестационных патологиях, патогенез которых обусловлен, в том числе, ОС, были сосредоточены, в основном, на преэклампсии. Так, в ряде работ представлены дифференциально экспрессирующиеся мкРНК, ассоциированные с ОС, а именно: miR-1, miR-16, miR-20a, miR-26b, miR-29b, miR-126-3р, miR-144-3р, miR-146b-5р, miR-155, miR-181, miR-182, miR-195, miR-204, miR-210, miR-335 и miR-451а [7, 10, 11]. В связи с чем, в настоящей работе была оценена экспрессия мкРНК, как регулирующих работу антиоксидантных ферментов, так и модулирующих производство активных форм кислорода при ранней и поздней ЗРП.
Материал и методы исследования
Формирование клинических групп пациентов
В исследование были включены беременные, находившиеся под наблюдением в Национальном медицинском исследовательском центре акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздрава РФ. Общая выборка из 32 пациенток репродуктивного возраста была разделена на 4 группы: 1) группу с ранней ЗРП составили беременные, родоразрешение которых было проведено до 34 недели гестации (n=7); 2) в группу с поздней ЗРП вошли беременные, родоразрешение которых было проведено после 34 недели гестации (n=6); 3) и 4) контрольные группы, соответствующие основным группам по срокам гестации (7 беременных с преждевременными родами до 34 недели (30±2); 12 беременных с доношенным сроком (37±1) и физиологически протекавшей беременностью) (таблица). Ультразвуковую допплерометрию плода и определение маркеров плацентарной дисфункции у беременных в контрольных группах не проводили.
В исследование не были включены беременные с многоплодными беременностями и наступившими в результате ЭКО, отягощенным соматическим анамнезом, наличием генетической патологии у матери и плода.
ЗРП устанавливали на основании расчетного веса плода ниже 10-го процентиля для соответствующего гестационного возраста. Состояние кровотока в артерии пуповины, средне-мозговой артерии плода и маточных артериях определяли с помощью допплерометрического исследования. В дополнение к весу плода принимали во внимание аномальный индекс пульсации в пупочной и средне-мозговой артериях, дефицит амниотической жидкости (олигогидрамнион и ангидрамнион). Родоразрешение беременных проходило с помощью операции кесарева сечения. Проведено патоморфологическое исследование плацент для подтверждения ишемических изменений.
Все исследования проведены с информированного согласия пациентов и одобрены этическим комитетом ФГБУ «НМИЦ АГП» им. В.И. Кулакова МЗ РФ.
Выделение суммарной РНК/мкРНК из ткани плаценты
В качестве экспериментальных образцов использовали образцы ткани плаценты, которые после промывки в 0,9% растворе хлорида натрия помещали в жидкий азот и переносили на -75°С для хранения. Затем образец ткани гомогенизировали в «QIAzol Lysis Reagent» и выделяли суммарную РНК («miRNeasy MicroKit», QIAGEN, Германия) с последующим обогащением низкомолекулярной фракцией мкРНК («RNeasy MinElute Cleanup Kit», QIAGEN, Германия). Проверку качества выделенных образцов проводили на биоанализаторе Agilent 2100 («Agilent Technologies») с помощью набора RNA 6000 Nano Kit, а концентрацию измеряли на флуориметре Qubit 3.0 («Invitrogen»). Полученные образцы хранили при -75°C для последующего использования.
Метод количественной полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) в реальном времени
Реакцию обратной транскрипции проводили с использованием «miScript II RT Kit». Для определения уровня экспрессии мкРНК в ткани плаценты проводили количественную ПЦР («miScript SYBR Green PCR Kit») с использованием прибора StepOnePlus («Applied Biosystems») и следующих специфичных к РНК смысловых праймеров: hsa-miR-16-5p MIMAT0000069 (5ʹ-TAGCAGCACGTAAATATTGGCG), hsa-miR-26b-5p MIMAT0000083 (5ʹ- TTCAAGTAATTCAGGATAGGT), hsa-miR-100-5p MIMAT0000098 (5ʹ-AACCCGTAGATCCGAACTTGTG), hsa-miR-125b-5p MIMAT0000423 (5ʹ-TCCCTGAGACCCTAACTTGTGA), hsa-miR-146a-5p MIMAT0000449 (5ʹ-TGAGAACTGAATTCCATGGGTT), hsa-miR-182-5p MIMAT0000259 (5ʹ-TTTGGCAATGGTAGAACTCACACT), hsa-miR-199a-5p MIMAT0000231 (5ʹ-CCCAGTGTTCAGACTACCTGTTC), hsa-miR-221-3p MIMAT0000278 (5ʹ-AGCTACATTGTCTGCTGGGTTTC), hsa-miR-451a MIMAT0001631 (5ʹ-AAACCGTTACCATTACTGAGTT), hsa-miR-574-3p MIMAT0003239 (5ʹ-CACGCTCATGCACACACCCACA), SNORD68 (5’- ACATTCTCCGGAATCGCTGT). Все этапы осуществляли в соответствии с протоколами фирмы-производителя QIAGEN. За пороговый уровень экспрессии принимали Ct<34. Уровень экспрессии мкРНК определяли методом 2-ΔΔCT, используя в качестве референсной РНК SNORD68.

Статистический анализ полученных данных
Статистическую достоверность отличия уровней мкРНК в сравниваемых группах оценивали методом Вилкоксона-Манна-Уитни с помощью скриптов, написанных на языке R [12].
Результаты исследования и обсуждение
Поскольку ключевым моментом в развитии ЗРП является нарушение маточно-плацентарного кровотока, вследствие аномального ремоделирования спиральных артерий и дисфункции сосудистого эндотелия, обусловленное несбалансированной работой про- и антиоксидантной системы, нами были отобраны мкРНК, которые играют важную роль в патогенезе сердечно-сосудистых заболеваний по данным литературы [13–15]. Акцент был сделан на следующих мкРНК: miR-16-5p, miR-26b-5p, miR-100-5p, miR-125b-5p, miR-146a-5p, miR-182-5p, miR-199a-5p, miR-221-3p, miR-451a и miR-574-3p.
Анализ дифференциальной экспрессии показал, что в ткани плаценты в группе беременных с ранней ЗРП (р<34) уровни экспрессии miR-221-3p и miR-451a относительно группы сравнения (N<34) были достоверно снижены (р<0,03), а экспрессия miR-125b-5p и miR-574-3р, напротив, значимо повышалась (р<0,03) (рис. 1).
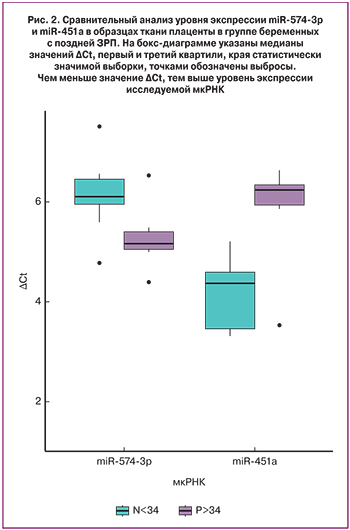
В группе беременных с поздней ЗРП (р>34) только две мкРНК – miR-574-3p и miR-451a показали достоверные отличия (рис. 2). При этом их экспрессия также, как и в группе с ранней ЗРП, изменялась разнонаправленно: значимое повышение уровня экспрессии miR-574-3p (р<0,04) и понижение miR-451a (р<0,006) относительно группы контроля (N>34).
Интересно отметить, что miR-125b-5p и miR-221-3p изменяли свою экспрессию только при ранней ЗРП. Специфичность этих изменений требует проверки на более многочисленной выборке беременных с ЗРП.
 В исследованиях, проведенных Hromadnikova с соавторами, была оценена экспрессия ряда мкРНК в плацентарной ткани и пуповинной крови в группах беременных с артериальной гипертензией, преэклампсией и ЗРП [13, 14].
В исследованиях, проведенных Hromadnikova с соавторами, была оценена экспрессия ряда мкРНК в плацентарной ткани и пуповинной крови в группах беременных с артериальной гипертензией, преэклампсией и ЗРП [13, 14].
При ранней ЗРП показано снижение экспрессии miR-125b-5p,-199a-5p, -221-3p и -574-3p в плацентарной ткани [13]. Авторы отметили, что при ранней преэклампсии с тяжелым течением экспрессия miR-199a-5p, -221-3p и -574-3p также была снижена в периферической крови беременных, а miR-199a-5p ассоциирована с ЗРП вне зависимости от срока гестации и степени тяжести состояния плода (олигогидрамнион/ангидрамнион) [15]. Кроме этого, при оценке уровня экспрессии miR-221-3p в пуповинной и периферической крови матери при ЗРП была установлена отрицательная корреляция с индексом пульсации в артерии пуповины (r=−0.390, p=0.017) [14].
В нашем исследовании не было обнаружено статистически значимых изменений уровня экспрессии miR-16-5p, miR-26b-5p, miR-100-5p, miR-146a-5p, miR-182-5p и miR-199a-5p в плацентарной ткани при ЗРП, в отличие от данных других авторов, выявивших дифференциальную экспрессию указанных мкРНК при артериальной гипертензии, преэклампсии и ЗРП [13–15]. Необходимо отметить, что некоторое расхождение в полученных нами данных по уровням экспрессии мкРНК с данными других исследователей могут объясняться, по всей видимости, различиями в: 1) способе взятия материала для исследования; 2) гестационных сроках сопоставляемых групп; 3) сопутствующей патологии у матери.
В работе Chen с соавторами выявлено прямо противоположное регуляторное воздействие miR-221/222 на пролиферацию и миграцию гладкомышечных и эндотелиальных клеток, обусловленное разнонаправленной экспрессией генов-мишеней (p27, p57, c-kit, eNOS, Ets-1) miR-221/222 в анализируемых клеточных культурах [16]. Известно также, что сверхэкспрессия miR-221/222, индуцированная гипоксией, приводит опосредованно к снижению уровня эндотелиальной синтазы оксида азота (eNOS) [8]. NOS экспрессируется в плацентарном синцитиотрофобласте, в эндотелии сосудов плаценты и пуповины, где синтезируемый NO способствует низкому фетоплацентарному сосудистому сопротивлению [17]. Вероятно, наблюдаемое в настоящей работе снижение уровня экспрессии miR-221-3p при ранней ЗРП, предполагает ее существенную роль в регуляции кровотока в плаценте и обеспечении адекватного поступления кислорода для роста и развития плода, о чем свидетельствуют измененные показатели церебро-плацентарного соотношения у беременных при ранней ЗРП (таблица).

Помимо взаимодействия miR-221/222 с вышеперечисленными целевыми генами сосудистой системы, ее известной мишенью является мощный эффектор апоптоза – проапоптотический белок PUMA, который инициирует каспаза-зависимый митохондриальный путь апоптоза. В исследовании Zhang с соавторами, было показано, что miR-221/222 в трансфецированных эпителиальных опухолевых клетках ингибирует клеточную пролиферацию путем индукции апоптоза [18].
Выявленный в настоящей работе повышенный уровень экспрессии miR-125b при ранней ЗРП играет важную роль в регуляции сбалансированной работы про- и антиоксидантной системы. Так, при церебральной ишемии/реперфузии in vitro, на модели кислородно-глюкозной депривации/реоксигенации (OGD/R) в клетках нейрональной линии PC-12 обнаруженная высокая экспрессия miR-125b приводила к снижению уровня протеинкиназы 2, активациии НАДФH-оксидазы (NOX2 и NOX4) и, как следствие, к увеличению уровня свободных радикалов и апоптоза нейронов [19]. В исследовании других авторов на модели окклюзии средне-мозговой артерии (MCAO) было продемонстрировано влияние сверхэкспрессии miR-125b-5р на снижение уровня цистатионин-β-синтазы (CBS) – основного белка, катализирующего производство H2S в головном мозге. Напротив, подавление экспрессии miR-125b-5р в клетках линии PC-12 способствовало повышенной выработке H2S, снижению уровней лактатдегидрогеназы (LDH), малонового диальдегида (MDA), супероксида и пероксида, уменьшению числа апоптотических клеток [20]. Известно, что протективное действие H2S при гипоксическом повреждении коррелирует с уменьшением количества активных форм кислорода и повышением уровня антиоксидантов [21]. В свою очередь, главным регулятором экспрессии miR-125b-5р является ядерный транскрипционный фактор NRF2 – важный инициатор транскрипции генов антиоксидантных белков (гемоксигеназы 1, глутатиона, глутатионтрансферазы, тиоредоксинредуктазы 1) [22]. В связи с чем, можно сделать вывод, что увеличение экспрессии miR-125b-5р в плацентарной ткани приведет к сдвигу баланса между образованием антиоксидантных белков и свободных радикалов в сторону последних. В ряде исследований проанализировали показатели ОС и общего антиоксидантного статуса в плацентарной ткани, амниотической жидкости и плазме крови беременных с ЗРП. В частности, Mert с соавторами наблюдали значительное увеличение, как уровня свободных радикалов, так и антиоксидантов в плазме крови беременных с ЗРП и преэклампсией [23]. В настоящее время проведены исследования по оценке взаимосвязи уровня малонового диальдегида (MDA) и каталазы (CAT) , как в сыворотке крови матери и пуповинной крови, так и в тканях миометрия и плаценты беременных с ЗРП и преэклампсией [24].
В нашем исследовании, как при ранней, так и при поздней ЗРП, была выявлена сниженная экспрессия miR-451а – другой немаловажной молекулы, участвующей в защите клеток от ОС. В частности, в работе Wang с соавторами доказан ее кардиопротективный эффект при развитии ОС в условиях ишемии [25]. Отсутствие экспрессии miR-451а обуславливало повышенную восприимчивость эритроцитов к действию окислителей в связи с изменением уровня фосфосерин/треонинсвязывающего белка 14-3-3zeta (KCIP-1) – ингибитора транскрипционного фактора FoxO3, являющегося положительным регулятором антиоксидантных генов в эритроцитах [26]. Кроме того, известным модулятором экспрессии miR-451а в культуре нейрон-подобных клеток SH-SY5Y является эритропоэтин, вызывающий антиоксидантные, антиапоптотические и нейропротективные эффекты за счет повышения экспрессии некоторых генов-мишеней miR-451а, в том числе, матриксной металлопротеиназы 9 (MMP9), циклинзависимой киназы 2 (CDK2), рецептора эритропоэтина (EpoR), регулятора клеточного апоптоза (BCL2) [27].
Что касается miR-574-3p, повышенный уровень которой был обнаружен нами в ткани плаценты при ЗРП, в литературе отсутствуют данные об ее участии в ОС, хотя показано повышение уровня экспрессии miR-574-3p при сердечно-сосудистой патологии, в частности, инфаркте миокарда [28].
Проведенный анализ баз данных (miRWalk, miRDB, miRTarbase, DAVID) позволил определить прогнозируемые мишени miR-125b-5p, miR-221-3p, miR-451а и miR-574-3p, которые связаны с различными осложнениями беременности, в том числе ЗРП, и детерминированы в качестве важных участников в регуляции ряда биологических путей, представленных на рисунке 3.

Таким образом, для обеспечения физиологического течения беременности необходима многоуровневая регуляция сбалансированной работы систем свободнорадикального окисления и антиоксидантной защиты, в которой немаловажную роль играет мкРНК. Изменение концентрации последней приводит к сдвигу баланса в ту или иную сторону, обуславливая патологическое окислительное повреждение тканей плаценты и, связанное с ним последующее нарушение роста и развития плода.
Заключение
В последнее время возрастает интерес к исследованию циркулирующих мкРНК в качестве неинвазивных маркеров диагностики различных акушерских синдромов, а прогнозирование осложнений беременности на ранних сроках с использованием подобных маркеров является актуальным для мониторинга состояния матери и плода. В связи с чем, перспективы продолжения настоящего исследования заключаются в оценке диагностического потенциала тканевых мкРНК в плазме пуповинной крови и крови беременных с ЗРП с последующим поиском корреляций с белковыми маркерами тканевого ОС и антиоксидантного ответа, а также с ультразвуковыми допплерометрическими показателями состояния плода.



