В настоящее время в литературе обсуждается роль оксидативного стресса в патогенезе невынашивания беременности (НБ) [1, 2]. По некоторым данным уже в I триместре гестации у здоровых беременных женщин и женщин с осложнениями беременности наблюдается развитие оксидативного стресса [3, 4]. В качестве одного из инициаторов свободно-радикальных реакций при НБ и, в частности НБ инфекционного генеза, могут выступать фагоциты, являющиеся эффекторами врожденного иммунитета. В результате взаимодействия фагоцитов с высоко консервативными структурами патогенных микроорганизмов, так называемыми патоген-ассоциированными молекулярными паттернами, к которым относятся компоненты грибковой и бактериальной стенки, такие как зимозан, липополисахарид (ЛПС), пептидогликан, липопротеины, гликолипиды и другие структуры [5], происходит активация фагоцитов [6]. Ключевая роль в распознавании указанных структур фагоцитами принадлежит Toll-подобным рецепторам (TLRs Toll-like receptors) [7]. При взаимодействии TLRs с патоген-ассоциированными молекулярными паттернами микроорганизмов секретируются провоспалительные факторы, биологически активные соединения, в том числе и активные формы кислорода (АФК) [8, 9]. В условиях патологии АФК, продуцируемые фагоцитами, могут приводить к повреждению различных тканей и органов матери и эмбриона, нарушению процессов имплантации и плацентации [1], и как следствие этого, возможному НБ. Однако, пусковые механизмы, приводящие к развитию НБ, остаются еще малоисследованными. При этом наименее изученным и наиболее важным для исследования является первый триместр гестации, поскольку он определяет дальнейшее течение беременности.
Исходя из вышесказанного, целью нашей работы явилось исследование продукции активных форм кислорода полиморфно-ядерными лейкоцитами периферической крови, стимулированными лигандами Toll-подобных рецепторов, у женщин с невынашиванием беременности инфекционного генеза на ранних сроках гестации по сравнению со здоровыми беременными женщинами.
Материалы и методы
В данное исследование включено 75 женщин в возрасте 18–42 лет (средний возраст 30,2 (5,2) лет), проходивших обследование на клинических базах кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. Предварительно у всех исследуемых женщин было взято письменное информированное согласие на диагностическую манипуляцию.
Все женщины были распределены на 3 группы: 1-я группа – здоровые небеременные женщины (n=25); 2-я группа здоровые беременные женщины (n=25); 3-я группа женщины с НБ инфекционного генеза (n=25). В качестве критериев включения в 3-ю группу были взяты срок беременности от 5 до 12 недель, эпизоды прерывания беременности в анамнезе – не менее 2 выкидышей, наличие урогенитальной инфекции на момент обследования или в анамнезе. Критериями исключения явились многоплодная беременность, индуцированная беременность, эндокринные заболевания, тромбофилические нарушения, аутоиммунные нарушения, обострение хронических воспалительных заболеваний.
Все беременные женщины находились в I триместре гестации (5–12-я неделя).
Возрастная характеристика обследованных групп, критерии включения и исключения из групп представлены в таблице 1.

В 3-й группе женщин с НБ инфекционного генеза методом полимеразной цепной реакции выявлены урогенитальные инфекции вирусного (CMV, Herpes simplex virus II) и бактериального (Chlamydia trachomatis, Ureaplasma urealyticum, Gardnerella vaginalis, Mycoplasma hominis) генеза. Наиболее часто выявлялась Ureaplasma urealyticum – 72%; CMV и Herpes simplex virus II встречались в 64 и 52% соответственно.
В работе были использованы зимозан A (Sacchoromyces cerevisiae) (Sigma, США) и липополисахарид (ЛПС) (E. Coli 0127:B8) (Sigma, США), которые соответственно распознаются TLR2 и TLR4 [10, 11].
Для исследования продукции АФК проводили измерение люминол-зависимой хемилюминесценции полиморфно-ядерных лейкоцитов (ЛХЛ ПЯЛ) [3] периферической крови на хемилюминометре Lum-5773 (ООО «ДиСофт», Москва).
Интенсивность ЛХЛ ПЯЛ периферической крови рассчитывали, как разность между максимальной интенсивностью индуцированного и спонтанного свечения.
Статистический анализ
Статистический анализ проводился с использованием программы STATISTICA 6.0 (STATISTICA 6.0 StatSoft Inc., Талса, штат Оклахома, США). Полученные в исследовании данные подчиняются нормальному закону распределения. Проверка характера распределения на нормальность проводилась с помощью W-теста Шапиро–Уилка. Для сравнения исследуемых групп применяли параметрический метод с использованием t-критерия Стьюдента. Различия между группами считались значимыми при р<0,05. Исследование значимости различия между средними значениями интенсивности ЛХЛ ПЯЛ периферической крови у здоровых беременных женщин и женщин с НБ инфекционного генеза проводили с помощью дисперсионного анализа (ANOVA). Данные представлены в виде среднего значения (М) и стандартного отклонения (SD) в формате М (SD).
Результаты и обсуждение
На первом этапе исследования для выявления максимально действующей концентрации лигандов нами с использованием крови здоровых небеременных женщин была изучена зависимость интенсивности ЛХЛ ПЯЛ от концентрации добавляемого лиганда при постоянном количестве клеток. В различных исследованиях для изучения функциональной активности клеток методом ЛХЛ используется разное количество зимозана и ЛПС. Так, в работе Makni-Maalej K. et al. [12] нейтрофилы активировали зимозаном в концентрации от 10 до 500 мкг/мл в реакционной среде, содержащей 5×105/л клеток, 10 мкМ люминола. Авторы Braga P. et al [13] исследовали функциональную активность ПЯЛ периферической крови методом ЛХЛ, стимулируя клетки зимозаном в концентрации 50 мкг/мл. В работе Wagner D.R. [14] концентрация ЛПС в реакционной среде, содержащей 5×106/мл ПЯЛ, 100 мкМ люминола, составляла 2,5 мкг/мл. А Remer K. et al. [15] стимулировали клетки ЛПС в концентрации 4 мкг/мл. Полученные нами результаты представлены на рисунке 1.
Обнаружено дозозависимое изменение интенсивности ЛХЛ ПЯЛ. Максимальное значение интенсивности наблюдалось при концентрации зимозана, равной 100 мкг/мл, а ЛПС – 200 мкг/мл.
Из данных литературы [12], а также нашего экспериментального опыта известно, что если использовать малые концентрации лиганда, то должный ответ клеток на стимуляцию можно пропустить. И наоборот, если стимулировать клетки излишне большими концентрациями, то это может привести к угнетению ответа клетки на стимуляцию. Поэтому необходимо было определить именно тот интервал концентрации лиганда, в котором клетки ответят на стимуляцию этим лигандом. Из рисунка 1 видно, что увеличение концентрации лигандов – зимозана от 1 до 100 мкг/мл, и ЛПС от 1 до 200 мкг/мл – приводит к повышению интенсивности ЛХЛ ПЯЛ у здоровых небеременных женщин. Дальнейшее увеличение концентрации лигандов до 250 мкг/мл приводит в случае зимозана к незначительному снижению интенсивности ЛХЛ, которое можно объяснить отсутствием мест связывания с рецепторами клеток. В случае же ЛПС наблюдается резкое падение свечения и это, возможно, обусловлено токсическим действием больших концентраций лиганда и как следствие – угнетением ответа клетки на стимуляцию.
Для выявления различий в ответах клеток исследуемых групп пациенток на основании полученных результатов были выбраны следующие концентрации зимозана и ЛПС: 5, 50 и 100 мкг/мл.
Далее у здоровых беременных женщин и женщин с НБ инфекционного генеза было изучено влияние этих лигандов на интенсивность ЛХЛ ПЯЛ (рис. 2).
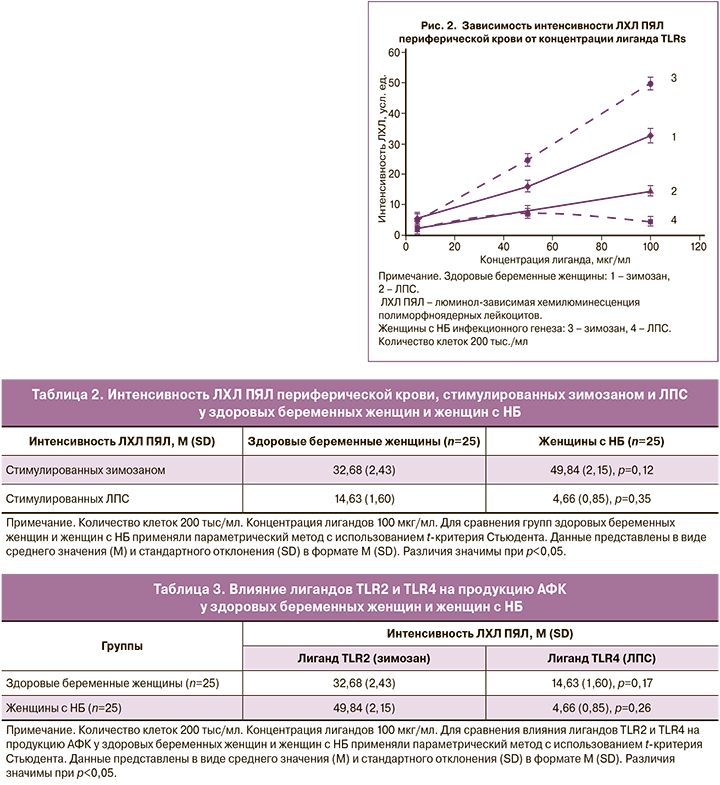
Как видно из данных, представленных на рисунке 2, интенсивность ЛХЛ ПЯЛ возрастает в обеих группах пациенток с увеличением концентрации зимозана от 5 до 100 мкг/мл. При этом у женщин с НБ инфекционного генеза интенсивность ЛХЛ клеток при их стимуляции зимозаном в концентрации 100 мкг/мл больше по сравнению с ЛХЛ клеток у здоровых беременных женщин (р=0,12). Количественные данные представлены в таблице 2.
В случае стимуляции клеток ЛПС с увеличением концентрации лиганда в исследуемых группах пациенток наблюдается выраженное различие в ответах клеток. Возрастание интенсивности ЛХЛ ПЯЛ с увеличением концентрации ЛПС от 5 до 100 мкг/мл наблюдается только у здоровых беременных женщин. У женщин с НБ инфекционного генеза интенсивность ЛХЛ ПЯЛ возрастает лишь при концентрациях от 5 до 50 мкг/мл, а дальнейшее увеличение концентрации ЛПС до 100 мкг/мл приводит к снижению интенсивности ЛХЛ ПЯЛ. При этом интенсивность ЛХЛ ПЯЛ, стимулированных ЛПС в концентрации 100 мкг/мл у женщин с НБ инфекционного генеза меньше, чем интенсивность ЛХЛ ПЯЛ у здоровых беременных женщин (р=0,35). Выраженное угнетение выработки АФК в последнем случае может быть связано со снижением экспрессии рецепторов на мембране клеток.
Ранее нами было показано, что в I триместре гестации у здоровых беременных женщин и женщин с осложнениями беременности наблюдается развитие оксидативного стресса, при этом наличие урогенитальной инфекции у беременных женщин способствует еще большему дисбалансу между интенсивностью свободнорадикальных реакций и активностью антиоксидантной системы в сторону усиления продукции прооксидантов и активации свободнорадикальных реакций [3]. В работе [16] показали явный сдвиг в пользу окислительных реакций и генерации АФК, а также значительное снижение соотношений антиоксидантов (восстановленного глутатиона)/окислителей (окисленного глутатиона) в цельной крови и ткани плаценты у пациенток с невынашиванием беременности по сравнению с таковыми у здоровых беременных женщин. Гестационный возраст здоровых беременных женщин и женщин с невынашиванием беременности составлял 12,6 (2,8) недели. Al-Sheikh Y.A. et al. [17] выявили увеличение маркеров окислительного стресса (малонового диальдегида, супероксид-анионов и перекиси водорода) как в плазме, так и в тканях плаценты при невынашивании беременности в конце первого триместра, начале второго триместра гестации по сравнению с количеством этих маркеров у здоровых беременных женщин. В работе [18] изучена генерация активных форм кислорода гранулоцитами крови у женщин с привычными абортами в анамнезе (2–3 самопроизвольных аборта в первом триместре, неразвивающиеся беременности). Уровень спонтанной ЛХЛ нефракционированной периферической крови был повышен в этой группе пациенток по сравнению с уровнем ЛХЛ нефракционированной периферической крови у женщин с нормальной репродуктивной функцией, что свидетельствует о предрасположенности к окислительному стрессу и плохой цитотоксической функции гранулоцитов у женщин с привычными абортами.
В настоящей работе также обнаружено развитие оксидативного стресса в первом триместре гестации у пациенток с осложнениями беременности. Интенсивность ЛХЛ ПЯЛ, стимулированных зимозаном, выше у женщин с НБ инфекционного генеза по сравнению с ЛХЛ ПЯЛ у здоровых беременных женщин.
В случае стимуляции клеток ЛПС в концентрации 100 мкг/мл, интенсивность ЛХЛ ПЯЛ у женщин с НБ инфекционного генеза меньше по сравнению с ЛХЛ ПЯЛ у здоровых беременных женщин. На основании данных литературы [12] можно предположить, что одной из причин уменьшения продукции АФК ПЯЛ, стимулированных большими концентрациями ЛПС, у женщин с НБ инфекционного генеза по сравнению со здоровыми беременными женщинами является снижение экспрессии TLR4 на мембране этих клеток. При хронической инфекции постоянная стимуляция рецептора инфекционными агентами, возможно, вызывает угнетение TLR4, снижает экспрессию этого рецептора и уже на следующий стимул этими же лигандами наблюдается лишь угнетение клеточного ответа, уменьшается продукция АФК. В результате происходит снижение бактерицидной активности ПЯЛ у женщин с НБ инфекционного генеза, что может являться одним из механизмов развития НБ.
В работе Yaroustovsky M. et al. [19] также обсуждается, что при инфекции в результате длительного поступления в кровоток больших доз ЛПС нейтрофилы не могут вступать в реакции с иммунными комплексами, поскольку рецепторы заняты или клетки истощены длительной активностью с последующим снижением экспрессии рецепторов.
При проведении сравнительного анализа влияния лигандов TLR2 и TLR4 на продукцию АФК наблюдается следующее различие (табл. 3): максимальное значение интенсивности ЛХЛ ПЯЛ у здоровых беременных женщин при стимуляции их свечения ЛПС в концентрации 100 мкг/мл ниже по сравнению со стимуляцией клеток зимозаном (р=0,17).
У женщин с НБ инфекционного генеза это различие существенно: интенсивность ЛХЛ ПЯЛ, стимулированных ЛПС в концентрации 100 мкг/мл значительно ниже по сравнению со стимуляцией клеток зимозаном такой же концентрации (р=0,26). Нельзя исключить, что заметный вклад в общую продукцию АФК фагоцитами крови у женщин с НБ инфекционного генеза может вносить TLR2-опосредованная продукция АФК.
Заключение
Полученные результаты показывают, что у женщин с НБ инфекционного генеза и у здоровых беременных женщин на фоне развития оксидативного стресса в первом триместре гестации продукция АФК ПЯЛ периферической крови, стимулированными зимозаном или ЛПС, распознающимися TLRs, может зависеть от экспрессии этих рецепторов на мембране клеток. Это можно рассматривать как один из механизмов развития невынашивания беременности.



