Преэклампсия (ПЭ) остается одной из актуальных проблем в акушерстве [1, 2] со спорными вопросами патогенеза, профилактики и лечения. Одним из перспективных направлений решения этих задач является изучение роли обеспеченности женщин витамином D.
Дефицит витамина D является общепризнанной пандемией. В настоящее время не менее 30–50% населения планеты имеют низкую обеспеченность витамином D. Согласно современным представлениям, витамин D оказывает влияние на многие физиологические процессы, превращаясь в организме в активные метаболиты [3–6].
В тканях яичников, матки, плаценты и гипофиза обнаружены рецепторы витамина D (VDR) и 1a-гидроксилаза – фермент, превращающий 25(OH)2D3 в биологически активный гормон кальцитриол 1,25-дигидроксивитамин D – 1,25(OH)2D3. Витамин D взаимодействует со специфическими ядерными рецепторами (VDR) и проявляет свои биологические эффекты как стероидный гормон. VDR является белком, который с высокой аффинностью и специфичностью связывает 1α-гидроксилазу и 25(OH)2D3 [7–10], играя значимую роль в развитии плода [11–13], стимуляции выработки инсулина, ангиогенезе и продукции ренина, регуляции артериального давления, иммунотропном и нейропротекторном действии [14, 15].
Ген VDR кодирует ядерный гормональный рецептор, который связывает кальцитриол – активный метаболит витамина D3, регулирует активность генов минерального обмена и секрецию паращитовидного гормона, контролируя, таким образом, гомеостаз кальция и фосфора. Полиморфизм T>C (FokI полиморфизм; Met1Thr, международный код – rs2228570) обусловлен наличием 2-аллельных вариантов, кодирующих в нормальном состоянии аминокислоту метионин (аллель Т), в вариабельном – треонин (аллель С). Подобная нуклеотидная замена, по имеющимся данным, характерна для модулирования генов и изменения их функций [16]. Полиморфизм генов VDR связан с различной обеспеченностью витамином D (табл. 1) [17–21].

В начале 1990-х гг. была высказана мысль о том, что дефицит витамина D в первой половине беременности является фактором риска развития ПЭ. Показано, что дефицит витамина D обусловливает неполноценную инвазию трофобласта, которая, наряду с эндотелиальной дисфункцией, общепризнана как ключевой фактор патогенеза ПЭ [22]. По данным Ших Е.В., Милотова Н.М. [23], активация VDR-рецепторов при достаточном уровне витамина D снижает активность ренин-ангиотензиновой системы, действуя на рецепторы ангиотензина II и минералокортикоидов, и предотвращает развитие эндотелиальной дисфункции. Витамин D рассматривают как мощный эндокринной супрессор биосинтеза ренина, уровня инсулина в крови и фактор, улучшающий эндотелиально-зависимую вазодилатацию [24], что снижает антикоагулянтную активность и является важным компонентом противовоспалительных иммунных реакций в плаценте [25].
Ключевым фактором в профилактике ПЭ, по мнению Faulkner J. и соавт. [26], Song J. и соавт. [27] и Zhu H. и соавт. [28], является статус витамина D на самых ранних сроках беременности – концентрация 25(OH)D не менее 100 нмоль/л (40 нг/мл) [26]. На очень раннем этапе беременности реализуется связь дефицита витамина D и его способность изменять развитие плаценты и имплантацию эмбрионов [27, 28]. Несмотря на значительные успехи в изучении влияния витамина D на биологические процессы в организме, остаются спорными подходы к выбору доз витамина у беременных, сроков и длительности их назначения [29–32].
Цель исследования – изучить роль полиморфизма генов, участвующих в метаболизме витамина D при ПЭ у женщин с обоснованием оптимальной дозы витамина для снижения риска и тяжести ПЭ.
Материалы и методы
В исследование вошли 226 пациенток: из них 30 женщин с физиологическим течением беременности в 37–40 недель (группа сравнения), 35 – с реализованной ПЭ на тех же сроках, 131 – из группы высокого риска ПЭ (63 беременных на сроке 14–16 недель и 68 женщин, планирующих беременность). У всех пациенток было изучено содержание 25(OH)D в крови иммуноферментным методом – наборы фирмы BIOMEDICAGRUPPE (Германия). Исследования повторяли в динамике через 1 месяц после начала терапии и при родоразрешении. Обеспеченность витамином D оценивалась согласно клиническим рекомендациям Российской ассоциации эндокринологов (2015 г.): норма 30–100 нг/мл, недостаточность 20–30 нг/мл, дефицит менее 20 нг/мл, глубокий дефицит – 10 нг/мл и менее.
Было проведено генотипирование следующих генов: GC rs2282679; CYP2R1 rs2060793; VDR rs2228570. Выделение ДНК проводили из лейкоцитов периферической крови методом фенол-хлороформной экстракции с последующим осаждением 96% этанолом. После высушивания ДНК разводили в дистиллированной воде и использовали в качестве матрицы для постановки полимеразной цепной реакции (ПЦР). Генотипирование осуществляли методом ПЦР в реальном времени с использованием TaqMan зондов согласно протоколу фирмы-производителя (ООО «СибДНК», Новосибирск).
Как было отмечено выше, генотип ТС гена VDR ассоциирован с пониженным уровнем содержания 25-гидроксивитамина D (наиболее распространенной формы этого витамина) в крови. Люди с генотипом СС или ТС по генетическому маркеру могут быть более предрасположенными к низкому уровню содержания витамина D по причине сниженной способности транспорта витамина D в организме. При генотипе TT обеспечивается нормальный уровень витамина D .
Ген GC принадлежит к семейству генов альбумина и кодирует витамин D-связывающий белок. Это многофункциональный белок, он связывается с витамином D и его метаболитами в плазме и транспортирует их к тканям. Люди с генотипом СС или AC по генетическому маркеру rs2282679 могут быть более предрасположенными к низкому уровню содержания витамина D в связи со сниженной способностью транспорта витамина D в крови.
Ген CYP2R1 кодирует фермент (член суперсемейства цитохрома P450) – микросомальную витамин D гидроксилазу, которая преобразует витамин D в активный лиганд к рецептору витамина D. Генотипами полиморфизма rs2060793, определяющими предрасположенность к низкому уровню содержания витамина D, являются варианты СС или CT [16, 33].
Для описания количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (М), стандартное отклонение (SD), которые были представлены в формате М (SD). Качественные показатели учитывали как в абсолютных, так и в относительных величинах.
Статистическую обработку результатов исследования проводили c помощью пакетов программы Statistica for Windows (версия 6.1). Различия между независимыми группами по количественным параметрам оценивали по t-критерию Cтьюдента. В случае неправильного распределения (отсутствия нормальности распределения и одинаковых дисперсий сравниваемых показателей) либо числа наблюдений в одной из независимых групп менее 30 использовали непараметрический U-критерий Манна–Уитни. Различия между группами по относительным величинам оценивали по критерию хи-квадрат, если одно из значений было менее 5, применяли точный критерий Фишера. За критический уровень значимости принято значение р=0,05.
Результаты и обсуждение
При обследовании пациенток с развившейся ПЭ (33–36 недель беременности) содержание 25(OH) D в крови в среднем составило 10,3 (0,6) нг/мл, что следует трактовать как глубокий дефицит. У пациенток с физиологическим течением беременности (33–36 недель) содержание 25(OH)D в крови в среднем составило 24,4 (1,2) нг/мл. Проведенный генетический анализ позволил выявить у этих женщин вариации изучаемых генов, обусловливающих дефицит витамина D, причем у женщин с тяжелой степенью ПЭ были обнаружены вариации сочетания всех трех генов, связанных с витамин D-дефицитным состоянием (табл. 2).

Как показал анализ, среди женщин с физиологически протекающей беременностью генотип, обеспечивающий физиологический метаболизм витамина D по гену VDR, – TT обнаружен у 22, по гену CYP2R1 – TT – у 19, по гену GC – АА – у 23. Сочетание генотипов TT-TT-AA генов VDR, CYP2R1 и GC, ассоциированных с наиболее эффективным метаболизмом витамина D, определено у 17 (56,6%) пациенток.
В группе женщин с ПЭ 31 (88,5%) имели различные сочетания генотипов, неспособных обеспечить физиологический метаболизм витамина D. Благоприятный генотип TT по гену VDR установлен у 6 женщин этой группы, генотип TT гена CYP2R1 – у 4, генотип АА гена GC – у 5. Сочетанный полиморфизм этих генов наблюдался у 4 (11,4%) пациенток.
Отдельную группу пациенток, обследование и наблюдение за которыми проводилось на протяжении всей беременности, составили женщины высокого риска развития ПЭ. В эту группу вошли 22 женщины с хронической артериальной гипертензией (АГ), 21 – болезнями мочевой системы, 16 – ожирением (индекс массы тела (ИМТ) >35 кг/м2), 2 – гипертензивными расстройствами в предыдущей беременности, 2 – АФС. При обследовании пациенток на сроках 14–16 недель уровень 25(ОН)D в крови был равен 15,7 (0,6) нг/мл, при этом у беременных с ожирением – 8,4 (1,1) нг/мл, при АФС – 7,9 (1,2) нг/мл, что свидетельствовало о тяжелом дефиците витамина D. Проведенное исследование генов в этой группе показало, что число пациенток с генотипом, не обеспечивающим физиологический метаболизм витамина D, так же как и при развившейся ПЭ, было очень высоким (табл. 3) – у 56 (88,9%) женщин.
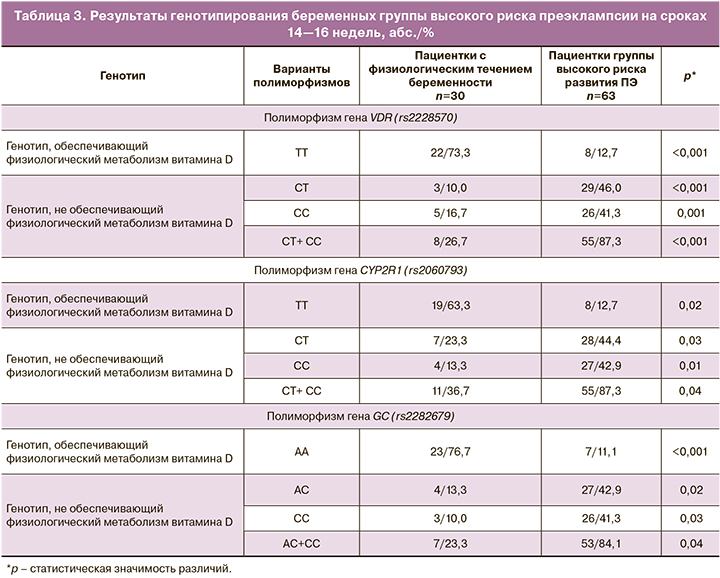
Из приведенных данных следует, что генотип TT гена VDR, обеспечивающий нормальный метаболизм витамина D, установлен у 8, генотип TT гена CYP2R1 – у 8, генотип AA гена GC – у 7 и сочетание генотипов – у 7 (11,1%) беременных.
По результатам генотипирования 33 женщинам этой группы был назначен витамин D, 30 – витамин D не получали. У беременных с сочетанием всех благоприятных «гомозигот» (TT-TT-AA) применяли дозу 2000 МЕ в день, при предрасположенности к дефициту витамина D (сочетанный полиморфизм генов VDR, CYP2R и GC, не обеспечивающий физиологический метаболизм витамина D) – 4000 МЕ. Использовали препарат витамина D – Аквадетрим (Акционерное общество «Химико-фармацевтический комбинат «АКРИХИН», Россия), который содержит максимально эффективную, стабильную и хорошо абсорбируемую в кишечнике форму витамина D в каплях. Препарат хорошо переносился пациентками, побочных эффектов не было отмечено.
Результаты наблюдений за беременными группы высокого риска показали, что обеспеченность витамином D перед родоразрешением у них составила 29,6 (0,6) нг/мл, при этом умеренная ПЭ была диагностирована у 2 (6,1%) из 33 пациенток, тогда как из 30 женщин, не принимавших витамин D, ПЭ развилась у 5 (16,7%): тяжелой степени – у 1 (3,3%), умеренной – у 4 (13,3%). Уровень витамина D в крови не превышал 13,8 (0,6) нг/мл, несмотря на то, что различные поливитаминные комплексы были назначены всем женщинам с момента взятия на учет в женской консультации.
Проведенные наблюдения позволили сделать вывод, что срок 14–16 недель является поздним началом приема витамина, не позволяющим добиться адекватной обеспеченности в крови (не менее 30 нг/мл).
В связи с этим проведена прегравидарная подготовка у 38 женщин с высоким риском ПЭ с учетом результатов полиморфизма генов VDR, CYP2R1, GC. В эту группу вошли 14 пациенток с хронической АГ, 12 – болезнями мочевой системы, 8 – ожирением, 2 – гипертензивными расстройствами в предыдущей беременности, 2 – АФС. Исходная обеспеченность витамином D составила 16,6 (1,2) нг/мл. В группу сравнения вошли 30 пациенток также из группы высокого риска ПЭ, не получавших препараты витамина D. У здоровых пациенток, планирующих беременность, обеспеченность витамином D составила 31,6 (1,2) нг/мл. Результаты генотипирования женщин этой группы представлены в табл. 4.
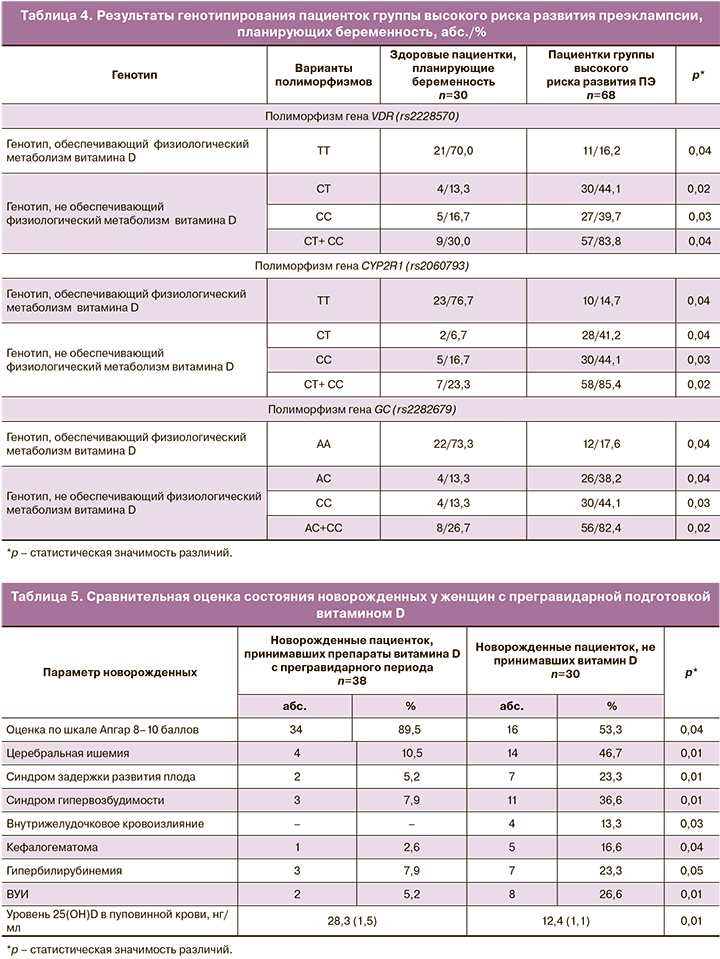
Результаты исследования вновь подтвердили, что подавляющее большинство женщин – 59 (86,9%) с высоким риском ПЭ вне беременности имеют сочетанный полиморфизм, не обеспечивающий физиологический метаболизм витамина D, остальные (7– 13,1%) имели полиморфизмы с физиологическим эффектом витамина D.
Так же как и в предыдущей группе, витамин D назначался дифференцированно: при генотипе, обеспечивающем физиологический метаболизм витамина D, – 2000 МЕ и с сочетанным генотипом, ассоциированным с низкой обеспеченностью витамином, – 4000 МЕ препарата Аквадетрим. Все они продолжили прием витамина D в назначенной дозе во время беременности. Содержание 25(ОН)D в сыворотке крови на ранних сроках беременности составило 27,5 (1,3) нг/мл, в 27–28 недель– 32,4 (1,4) нг/мл; у не принимавших витамин D – 15,8 (1,3) нг/мл и 15,9 (1,1) нг/мл соответственно (статистическая значимость в обоих случаях р<0,05). На фоне дотации к моменту родоразрешения уровень витамина D в крови вырос до 39,6 (1,2) нг/мл, тогда как в подгруппе сравнения его содержание составило 14,7 (1,4) нг/мл (различия статистически значимы, р<0,05).
Среди 38 женщин, принимавших Аквадетрим с учетом генотипирования с периода прегравидарной подготовки (не менее 2 месяцев), случаев развития ПЭ не зарегистрировано. Осложнения беременности отмечены у 7 (18,4%): ранний токсикоз – у 1, угроза прерывания – у 3, плацентарная недостаточность – у 2, синдром задержки развития плода (СЗРП) – у 1. Роды у 1 пациентки закончились экстренной операцией кесарева сечения (КС) в связи с упорной слабостью родовой деятельности, в плановом порядке операция КС была проведена у 2 – в одном случае показанием явилась миопия высокой степени с периферической хориоретинодистрофией сетчатки, в другом – крупный плод в сочетании с узким тазом 1 степени. Остальные беременные самостоятельно родили в срок с оценкой по шкале Апгар 8–9 баллов и средней кровопотерей в родах 234 (45) мл без учета кровотечения в 1 случае.
Осложнения беременности у пациенток, не принимавших витамин D (30 женщин), развились в 26 (86,6%) случаях: ранний токсикоз – у 2 (6,7%), плацентарная недостаточность – у 16 (53,3%), СЗРП – у 7 (23,3%), ПЭ – у 10 (33,3%), из них у 2 (6,7%) – тяжелая, у 8 (26,6%) – умеренная. Операцией КС завершена беременность у 14 женщин, плановой – у 4 (13,3%), экстренной – у 10 (33,3%). Показаниями к плановой операции явились СЗРП в сочетании с ПЭ. Экстренно оперативно были родоразрешены женщины в связи с преждевременной отслойкой нормально расположенной плаценты – 1 (3,3%), упорной слабостью родовой деятельности – 2 (6,7%), угрожающей асфиксией плода – у 2 (6,7%), нарастанием тяжести ПЭ – 5 (16,7%) женщин. Средняя кровопотеря в родах составила 480 (65) мл, оценка по шкале Апгар 5–8 баллов.
В позднем послеродовом периоде отмечались субинволюция матки, эндометрит, анемический синдром – у 7 (23,3%) пациенток.
Оценка состояния новорожденных показала, что назначение витамина D женщинам с периода прегравидарной подготовки и в течение всей беременности с учетом полиморфизма генов, участвующих в метаболизме витамина D, приводит к значительному снижению ранних неонатальных осложнений (табл. 5). Приведенные группы сопоставимы по исходному преморбидному фону.
Как следует из табл. 5, все возможные осложнения в периоде новорожденности статистически значимо снижены у детей, рожденных женщинами с дотацией витамина D с периода прегравидарной подготовки и в течение всей беременности, в отличие от новорожденных из группы риска ПЭ, матери которых не принимали препараты витамина D, но периодически использовали мультивитаминные комплексы.
Проведенные исследования показали, что женщины с высоким риском развития ПЭ (хронической АГ, заболеваниями почек, ожирением, гипертензивными расстройствами во время предыдущей беременности, АФС) и, тем более, с развившейся ПЭ имеют выраженный дефицит витамина D, который генетически детерминирован в подавляющем большинстве (86%) случаев. У этих женщин выявлены полиморфизмы в генах ядерного рецептора витамина D (VDR), микросомальной гидроксилазы, превращающей витамин D3 в активную для рецепторного захвата форму для последующего переноса (CYP2R1 rs2060793), и гена, кодирующего витамин D-связывающий белок (GC rs2282679).
Профилактической дозой препарата витамина D у женщин группы высокого риска развития ПЭ может быть 2000 МЕ при условии определения генотипа, обеспечивающего физиологический метаболизм витамина D (13,1% женщин), в остальных случаях – 4000 МЕ с этапа прегравидарной подготовки. Подобранные дозы препаратов витамина D в зависимости от полиморфизма генов запатентованы (Патент на изобретение РФ №2663593) [32].
Назначение препарата с конца I триместра возможно, так как осложнения беременности развиваются реже, но доза витамина D должна быть не менее 4000 МЕ для достижения оптимального уровня в крови не ниже 40 нг/мл. Меньшая доза не позволяет достичь рекомендуемой обеспеченности витамином. Индивидуально подобранные дозы витамина D c периода прегравидарной подготовки в зависимости от генотипа в 2000 МЕ или 4000 МЕ позволяют предотвратить ПЭ, уменьшить частоту плацентарной недостаточности в 11 раз, СЗРП – в 9 раз, снизить частоту экстренных операций КС в 4 раза.
Заключение
Эффективным препаратом для применения у беременных является препарат Аквадетрим, с хорошей переносимостью и высокой комплаентностью по отзывам женщин, успешно используемый нами в практике на протяжении многих лет.



