В последние 30 лет отмечается устойчивая тенденция к изменению метаболического профиля беременных, проявляющаяся в смещении обменных процессов в сторону патологического анаболизма, снижении адаптационных ресурсов, несостоятельности механизмов компенсации, на фоне которых все чаще возникает гестационная гипергликемия [1–4].
Согласно концепции Н.Л. Гармашевой и Н.И. Константиновой [5], с наступлением беременности формируется функциональная система «мать-плацента-плод» (ФСМПП), однако данная концепция не учитывает важный признак подсистемы «плод» – его половую принадлежность. Как показывают некоторые исследования, пол плода может влиять на адаптационные процессы в ФСМПП и способствовать формированию акушерской патологии [6, 7]. Известно, что ряд хромосомных аберраций связан с полом плода [8, 9]. Мужской пол плода признан фактором риска угрозы преждевременных родов [10], плацентарной дисфункции [7, 11], фетальной пиелоэктазии и гиперэхогенности кишечника [12]. Женский пол плода способствует формированию токсикоза первой половины беременности и преэклампсии. При этом тяжелые формы преэклампсии чаще согласуются с мужским полом плода [13]. По мнению Sheinег Е. et al. (2004) [14], гестационный сахарный диабет (ГСД) чаще встречается у беременных, вынашивающих мальчиков. Но все эти факты неоднозначны и требуют дальнейшего изучения.
Одним из основных патогенетических механизмов формирования ГСД является нейрогуморальная дисфункция в организме беременной женщины, которая проявляется относительной гиперреактивностью симпатоадреналовой системы. В результате такого функционирования симпатоадреналовой системы возникает повышенный синтез ряда биологически активных медиаторов (адреналина (Adr), норадреналина (NorA), нейропептида Y (НПY) и др.) [15], напрямую и через эндотелий (ангиотензин II (At II), эндотелин-1 (Et-1) и др.) меняющих сосудистый тонус, вызывая вазоконстрикцию, трансформируя чувствительность тканей к инсулину и митотическую активность клеток через активацию синтеза инсулиноподобных факторов роста и их белков-переносчиков [15–20]. Эти дисфункциональные процессы касаются всех звеньев ФСМПП и приводят к возникновению гипоксии, оксидативного стресса, формированию акушерской и плодовой патологии [2, 4, 15–17]. Вместе с тем крайне ограничены научные данные о роли половой принадлежности плода в формировании ГСД.
Цель исследования: определить уровни некоторых гормонов, нейромедиаторов, вазоконстрикторов, про- и контринсулярных факторов в материнском организме в зависимости от пола вынашиваемого плода и установить роль полового диморфизма в генезе ГСД и эндотелиальной дисфункции.
Материалы и методы
Исследования проводились в 2013–2018 гг. на базе Научно-исследовательского института акушерства и педиатрии ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России и одобрены Этическим комитетом (Протокол № 23/1 от 25.04.2017 г.). У всех беременных получено утвержденное («Правила проведения качественных клинических испытаний в РФ» от 29.12.1998.) информированное согласие.
В I группу – «ГСД» – были включены 517 женщин. Из них 253 вынашивали плоды женского пола (БПЖП) (Iа группа) и 264 – мужского пола (БПМП) (Iб группа). II группа – «физиологическая беременность» (ФБ) включала 584 беременных и была разделена на IIа группу (280 – БПЖП) и IIб группу (304 – БПМП).
Общими критериями включения для обеих групп стали: одноплодная беременность и возраст 18–28 лет. При включении в I группу также учитывался уровень глюкозы, являющийся диагностическим для постановки диагноза ГСД, согласно критериям, изложенным в клинических рекомендациях Минздрава РФ от 17.12.2013 г. № 15-4/10/2-9478 «Гестационный сахарный диабет: диагностика, лечение, послеродовое наблюдение»; при включении во II группу – беременность без осложнений, отсутствие эндокринной патологии и экстрагенитальной заболеваемости в стадии декомпенсации и обострения.
Критерии исключения: многоплодная и индуцированная беременность, хромосомные аберрации и врожденные аномалии развития плода, врожденные пороки развития у женщин, декомпенсация экстрагенитальных заболеваний и эндокринопатий (кроме ГСД для I группы), а также нежелание женщин участвовать в исследовании.
Для определения частоты обнаружения ГСД в зависимости oт пола плода проанализированы 14 256 карт беременных. Рандомизация клинических групп осуществлялась при помощи методов случайных чисел и «Монета» [18]; группы были количественно сопоставимы. Необходимое количество наблюдений рассчитывалось исходя из критериев «Общей теории статистики» [19]. В ходе исследований соблюдались условия последовательности, кратности и времени их проведения.
В плазме крови глюкозооксидазным методом определялся базальный уровень глюкозы набором «Глюкоза» (Bandox, Англия), иммуноферментным методом – иммунореактивный инсулин (DRG Insulin ELISA EIA-2935, Германия); далее высчитывался индекс инсулинорезистентности НОМА-IR (глюкоза натощак (ммоль/л)×иммунореактивный инсулин (мкЕД/мл)/22,5). Значение индекса более 2,77 указывало на наличие инсулинорезистентности.
В сыворотке крови методом иммуноферментного анализа определяли уровни определенных гормонов, нейромедиаторов, вазоконстрикторов, а также про- и контринсулярных факторов на фотометре Тесаn Sunrise (Австрия). Для определения уровней Adr и NorA (нг/мл) использовали набор IBL (Германия), уровня инсулиноподобного фактора роста-1 (IGF-1; мкг/л) – набор IDS (США), уровня белка, связывающего инсулиноподобный фактор роста-1 (IGF_BP-1; нг/мл), – набор Mediagnost (Германия), уровня рецептора конечных продуктов гликозилирования (RAGE; пг/мл) – набор R&D Systems (США), уровня пролактина (ПРЛ; нг/мл) – набор AccuBind INC (США), уровня ретинолсвязывающего белка (RBP4; мкг/л) – набор IMMUN DIAGNOSTIK (Европа), уровня At II (нг/мл) – набор RayBio (Европа), уровня Et-1 (ммоль/мл) – набор BIOMEDICA GRUPPE (Германия), уровня НПY (нг/мл) – набор ВАСНЕМ GROUP (США).
Статистический анализ
Статистическую обработку данных проводили с использованием непараметрических критериев Краскела–Уоллиса для независимых выборок и U-критерия Манна–Уитни. Обработка исходных признаков осуществлялась с использованием пакетов прикладных программ MS OFFICE Excel 2010 и IBM SPSS 25.0.0.2. Различия показателей считали статистически значимыми при уровне значимости p<0,05.
Результаты и обсуждение
Оценка гликемического статуса у беременных групп сравнения проводилась в I и II триместрах беременности; в I триместре – у 124 беременных (23,9%). Значения гликемии натощак в I и II триместрах значимо выше были (р=0,01 и р=0,01 соответственно) в Iб группе (6,31 ммоль/л [5,01–6,38] и 6,64 ммоль/л [5,58–6,71] соответственно) относительно Iа (I триместр – 5,48 ммоль/л [4,81–5,60] и II триместр – 5,51 ммоль/л [5,21–6,03]). Все пациентки II группы имели нормальные уровни гликемии (менее 5,1 ммоль/л). Однако на уровне тенденции у матерей мальчиков ее значения были выше, чем у матерей девочек (I триместр – 4,55 ммоль/л [4,46–5,01] и 4,21 ммоль/л [4,08–4,46] (р=0,20), II триместр (4,68 ммоль/л [4,29–4,81] и 4,05 ммоль/л [3,72–4,33] (р=0,68) соответственно). При оценке уровней инсулинорезистентности (ИРИ) в клинических группах статистически значимых различий установлено не было. Однако во II триместре при межгрупповом сравнении у беременных с ГСД уровни ИРИ были выше (БПЖП – 10,88 мкЕД/мл [9,23–12,04] и БПМП – 13,62 мкЕД/мл [12,36–13,85]), чем в группе сравнения (БПЖП – 7,04 мкЕД/мл [6,45–8,31] и БПМП – 7,62 мкЕД/мл [6,28–9,11], р=0,25 р=0,17 соответственно). ИРИ в группе с ГСД во II триместре установлена у 136 пациенток (26,3%): Iа – у 52 (20,5%) и Iб – у 84 (31,8%), причем у БПМП ее индекс (3,58 [3,24–3,96]) достоверно выше (р=0,02) по сравнению с БПЖП (2,93 [2,85–3,41]). То есть можно утверждать, что более выраженные сдвиги в углеводном обмене наблюдаются у БПМП.
В последние годы все большее внимание уделяется изучению центральных регуляторов пищевого поведения при нарушениях углеводного обмена. В аркуатном ядре гипоталамуса расположена одна из основных структур, регулирующих пищевое поведение, – меланокортиновая система, нейроны которой синтезируют НПY [23]. НПY относят к орексигенным нейропептидам. Ингибируя нейроны, экспрессирующие меланокортиновые рецепторы 4-го типа, он способствует гиперфагии и снижению расхода энергии [24], стимулирует пролиферацию и отложение жира, а также является эндогенным стабилизатором α-адренорецепторов. Данные литературы свидетельствуют о том, что беременность способствует активной секреции этого нейропептида за счет смены центро-периферических приоритетов в результате формирования новых гормонпродуцирующих «единиц» (децидуальная ткань, цитотрофобласт, плацента и синтициобласт) [25]. Благодаря гравидарной перестройке усиливается секреция еще одного из важных регуляторов энергетического баланса, чувства насыщения, жирового и углеводного обменов – ПРЛ. Высокие уровни этого гормона при беременности способствуют лептинорезистентности, ИРИ и гиперинсулинемии. Помимо прочего, ПРЛ ответственен за модуляцию иммунологического ответа матери на развивающийся плод и обеспечивающие его жизнедеятельность околоплодовые структуры [26, 27].
Результаты исследования показали, что уровень НПY довольно постоянен на протяжении всей беременности и ни пол плода, ни состояние углеводного обмена не влияют на его продукцию. Однако они являются определяющими в секреции ПРЛ. В I триместре установлено статистически значимое преобладание его уровня в I группе у БПМП на 40,1% в сравнении с БПЖП, а также у БПМП в I группе (на 70,9%) относительно группы контроля. Для всех беременных было характерно статистически значимое увеличение его уровня к родам (табл. 1).
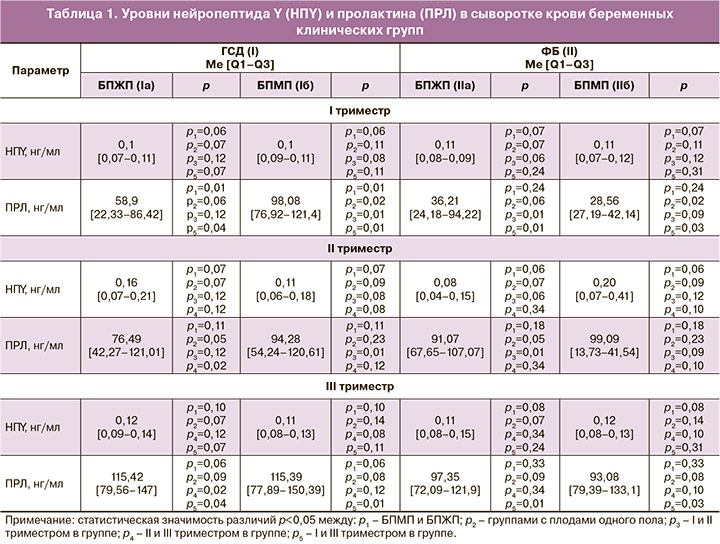
Плацента является не только барьерным органом, но и гестационной железой внутренней секреции, в которой активно происходят обменные процессы между матерью и плодом. Имеет различную пропускную способность для биологических факторов и вместе с маточной активностью входит в состав маточно-плацентарной «помпы», регулирующей кровоснабжение в ФСМПП [1, 3, 15]. Автономность маточно-плацентарно-плодового кровотока обеспечивается сменой активности специфических субстанций – вазоконстрикторов и вазодилататоров. Как известно, при ГСД на фоне преобладания симпатоадреналовой нервной регуляции этот баланс смещается и преобладает синтез вазоконстрикторов, что в итоге потенцирует дизрегуляторные процессы и приводит к осложненному течению беременности [4, 15, 16].
В таблице 2 отображены уровни важных регуляторов сосудистого тонуса (At II, Et-1, NorA, Adr) в крови обследуемых.

Анализ данных показал, что в случае ГСД уровень At II был достоверно выше в I триместре у БПЖП и БПМП (на 21,2% и 38,3% соответственно) и в III триместре – у БПМП (на 27,6%) относительно группы ФБ. Причем у БПМП он был достоверно выше в I (на 38,3%) и III (на 36,6%) триместре, чем у БПЖП. Во II триместре ситуация менялась, и его уровень статистически значимо был выше у БПЖП в случае ФБ (на 31,5%).
Аналогичная динамика показателей установлена в содержании Et-1. В I триместре его уровень значимо преобладал в группе с ГСД (у БПЖП – на 38,9%, у БПМП – на 79,8%) в сравнении с ФБ и у БПМП (на 64,7%) по сравнению с БПЖП.
Уровень NorA значимо преобладал в группе с ГСД, особенно во II триместре. Adr в I триместре также достоверно был выше в группе с ГСД (на 11,5% в Iа и на 20,8% в Iб) по сравнению с ФБ.
Полученные результаты свидетельствуют, что наибольшие уровни At II, Et-1 и Adr характерны для матерей мальчиков с ГСД. Однако по мере приближения родов уровень At II у них повышался, а Et-1 и Adr – снижался. При ФБ отмечалась обратная зависимость. Значения NorA были наибольшими и повышались к родам в группе контроля у БПЖП. Такая выработка вазоконстрикторов, возможно, связана с их биологически целесообразными влияниями на сосудистый тонус и углеводный обмен в процессе гестационной перестройки. Возможно, относительно высокие уровни Et-1 связаны с повреждением эндотелия сосудов, его дисфункцией и нарушением перфузии плаценты при ГСД [16]. Это подтверждается высокими значениями еще одного вазоконстриктора – At II, который, как известно, является активатором экспрессии Et-1 и снижает чувствительность клеток к инсулину [28]. Swiderski S. et al. (2010) в своих работах показали, что у беременных с сахарным диабетом имеется снижение чувствительности к рецепторам Et-1 [17]. Преобладающие же уровни Adr в начале беременности у БПМП могут быть объяснены более выраженной стрессированностью организма матери в случае вынашивания плодов мужского пола, а также в связи с реализацией его контринсулярных влияний. А вот NorA, хотя и является гормоном надпочечников, все же в большей степени выступает в роли нейромедиатора и за счет своего большего сродства к альфа-адренорецепторам подготавливает мускулатуру матки к родам. Этим и могут быть объяснены его более высокие уровни у беременных группы контроля, вынашивающих плодов-девочек, а также нарастание его концентрации к родам. Таким образом, прослеживаются механизмы физиологической подготовки беременной матки к родовому акту. Кроме того, очевидно, что в случае мужского пола плода у беременных регистрируются более выраженные признаки углеводной и эндотелиальной дисфункции.
Перестройка метаболизма беременной, направленная на формирование физиологической ИРИ [1, 3, 15], может стать триггером и для патологической ИРИ, если у беременной имеются сопутствующие нарушения (например, ожирение, полиморфизм генов, ответственных за процессы регулирования углеводного и жирового обмена, и др.). Известны контр- и проинсулярные факторы, определяющие адекватность реализации инсулином его биологических эффектов [2, 18, 19], к которым относят IGF-1, IGF_BP-1, RAGE и RBP4. Многое известно об их роли в регуляции углеводного обмена вне беременности, однако имеется мало информации, касающейся ГСД, акушерских осложнений и влияния пола плода на них.
Нами установлено, что уровни IGF-1 и RBP4 значимо преобладали в I группе у БПМП (на 44,9% и 21,5%) по сравнению с БПЖП во II триместре. Также для этих сроков было характерно достоверное увеличение значений IGF-1 (на 28,5%) и RBP4 (на 13,3%) в группе Iб относительно уровней группы IIб, а также отмечено значимое их повышение у БПМП к родам на 60,4% и 16,3% соответственно (табл. 3).

Напротив, уровни RAGE в I и III триместрах достоверно выше были вo IIб группе (на 11,9% и 15,7% соответственно) в сравнении с Iб и во II триместре – в Iа (на 17,6%) по сравнению с Iб. Но все же максимальные его значения при беременности определены у БПЖП с ФБ. Также имело место его снижение к родам в Iа (на 29,3%), IIа (на 43,9%) и IIб (на 17,5%) группах.
IGF_BP-1 был достоверно выше в I триместре во IIа группе (на 17,2%) против IIб и значимо нарастал к родам в Iб (на 43,2%) и IIа (на 11,8%) группе. Причем на уровне тенденции максимальные его значения получены у беременных Iа группы.
Более высокие уровни IGF-1 у беременных с ГСД, вынашивающих плодов-мальчиков, можно объяснить присутствующей у них эндотелиопатией, на которую косвенно указывают преобладающие уровни Et-1, At II и Adr, которые также способствуют и снижению чувствительности рецепторов к инсулину. Присутствующая эндотелиопатия, влияя на функцию биосинтеза в печени, нарушает в ней образование, в частности, IGF_BP-1, который инактивирует в среднем 95% IGF-1 [18], что также обеспечивает увеличение концентрации свободных (активных) форм IGF-1. Считается, что одним из первых событий, связанных с избыточным накоплением висцерального жира, является развитие воспаления, сопровождаемого гормональной дисфункцией жировой ткани, включая избыточную продукцию RBP4. Снижение уровня инсулинзависимого белка-переносчика глюкозы GLUT-4 рассматривается как прямая причина стимуляции выброса RBP4 адипоцитами в кровоток. Циркулирующий RBP4 ингибирует сигнальные пути, стимулируемые инсулином в клетках скелетных мышц, что приводит к развитию резистентности к инсулину. Популяционные исследования показали, что повышенная секреция RBP4 стимулирует экспрессию молекул адгезии в эндотелиальных клетках, способствуя развитию эндотелиопатии [19]. Доказана тесная связь ИРИ и эндотелиопатии с высокими уровнями этого белка. В частности, Du X. et al. (2019) показали, что RBP4 может быть предложен как ранний маркер ГСД в связи с высокими корреляционными связями индекса ИРИ и RBP4 у беременных с ГСД, а также установили у них его значимое повышение к родам, в отличие от беременных с нормальным углеводным обменом [20]. Результаты нашего исследования согласуются с их данными. Однако в дополнение к имеющимся знаниям об этом белке стало известно, что одним из определяющих факторов в развитии ИРИ и эндотелиопатии является пол плода, как выяснилось, – мужской.
Отмеченные у БПМП с ГСД более низкие уровни RAGE и их преимущественное снижение по мере приближения срока родов свидетельствует в пользу наличия у беременных (на фоне более высокого содержания конечных продуктов гликозилирования белков) окислительного стресса, усиления процессов катаболизма и воспалительной реакции в эндотелиальных клетках, что, по-видимому, связано с прогрессированием эндотелиальной дисфункции, которая является субстратом для нарушения плацентогенеза. Полученные данные о содержании RAGE согласуются с данными Nakamura K. et al. (2007) и Matsui T. et al. (2017), которые в своих исследованиях также показали и доказали связь экспрессии этих рецепторов с развитием эндотелиопатии у больных ГСД и диабетом других форм, а также с маркерами воспаления [29, 30].
В процессе клинической оценки течения беременности установлено, что в 71,0% случаев ГСД преобладал у женщин, вынашивающих мальчиков, независимо от паритета. Акушерские осложнения преобладали у женщин с ГСД, вынашивающих плодов-мальчиков: плацентарная дисфункция – в 2,1 раза (р=0,03), преждевременные роды – в 1,5 раза (р=0,01), гестационная гипертензия – в 2,2 раза (р=0,01), диабетическая фетопатия – в 1,8 раза (р=0,01) чаще. Из-за более высокого уровня акушерских осложнений эти беременные в 1,4 раза чаще (р=0,04) родоразрешались оперативно.
Таким образом, мужской пол плода является одним из возможных «участников» биохимических процессов, нарушающих углеводный баланс и функцию эндотелия сосудистой стенки.
Заключение
Установлено статистически значимое влияние пола вынашиваемого плода на вероятность развития нарушений углеводного обмена и формирования эндотелиальной дисфункции в организме матери, что подтверждается повышением уровней ПРЛ, At II, Et-1, Adr, IGF-1, RBP4 и снижением уровней IGF_BP-1, RAGE. Такая биохимическая «рокировка» способствует усугублению уже существующей физиологической ИРИ и развитию ГСД преимущественно у матерей мальчиков.
БПМП могут быть отнесены к группе риска по развитию ГСД и осложнений беременности (фето-плацентарной недостаточности, угрожающих преждевременных родов, гестационной артериальной гипертензии, диабетической фетопатии).
Полученные результаты определяют перспективу разработки мероприятий, направленных на возможный пересмотр клинических алгоритмов врачебного диагностического и профилактического сопровождения бе-ременных с ГСД с учетом пола вынашиваемого плода.



