Взаимосвязь ожирения и нарушений в работе репродуктивной системы женщины в течение многих десятилетий привлекает внимание исследователей; тем более, что проблема ожирения в современном обществе становится все более актуальной [1–3]. Негативное влияние характерных для ожирения инсулинорезистентности и компенсаторной гиперинсулинемии на обмен андрогенов, метаболизм инсулиноподобных факторов роста и процессы апоптоза уже ни у кого не вызывает сомнений [4–9]. Не исключается влияние адипокинов, особенно лептина [10, 11], не только на синтез гонадолиберина и вообще на активность гипоталамуса, но и непосредственно на стероидогенез, а также на состояние эндометрия, особенно на полноценность процессов децидуализации и рецептивность, а возможно, и на другие протекающие в нем процессы. Значение имеет и нарушение механизмов обратной связи в регуляции менструального цикла, особенно из-за изменения продукции транспортных белков [4]. Накопление избытка жировой ткани в организме влияет на активность надпочечников, может приводить к уменьшению продукции кортизол-связывающего глобулина и интенсификации превращений кортизола в малоактивный кортизон (с последующим компенсаторным увеличением синтеза кортизола). Все это в связи с контринсулярным действием глюкокортикоидов усугубляет инсулинорезистентность и приводит к усилению продукции андрогенов в яичниках. Предполагается, что ожирение оказывает негативное влияние на процессы мейоза и эмбрион в фазе имплантации [12, 13].
Клиническая картина нарушений в репродуктивной системе при накоплении избытка жировой ткани различна. Более того, ожирение, являясь важнейшим фактором риска, не всегда приводит к формированию гинекологической патологии. Обсуждается вопрос о вероятной защитной роли генетически детерминированного повышенного клиренса половых стероидов и депонирования их избытка в жировой ткани. Не исключено также влияние на состояние репродуктивной системы различной активности ферментов жировой ткани, осуществляющих экстрагландулярные превращения половых стероидов, что также детерминировано генетически [14–17].
Можно предположить наличие и других механизмов влияния ожирения на репродуктивную систему, определяющих разнообразие клинических проявлений. С современных позиций, когда в исследованиях все шире применяется метаболомный подход, следует помнить о большом количестве ролей любой молекулы в организме человека. Большой интерес вызывает изучение роли оксидативного стресса, то есть накопления в организме чрезмерного количества активных форм кислорода. В физиологических условиях активные формы кислорода принимают участие в противовоспалительной и противоопухолевой защите. Однако в некоторых ситуациях происходит чрезмерное их образование, и доминировать начинает повреждающий эффект в отношении собственных тканей вследствие активации перекисного окисления липидов, изменения активности ферментов, окислительной модификации белков и ДНК. Ожирение является одной из причин хронического окислительного стресса в организме человека [17–24].
Цель исследования: изучить показатели оксидативного стресса во взаимосвязи с параметрами обмена веществ у пациенток с ожирением и нарушением менструального цикла.
Материалы и методы
В исследование были включены 24 женщины с ожирением и нарушением менструального цикла в возрасте от 20 до 35 лет, средний возраст – 29,1 (26,3;33,4) года – основная группа. Контрольную группу составили 15 женщин того же возраста, средний возраст – 28,7 (25,3;32,9) года с ожирением и регулярным менструальным циклом. Критериями исключения были гиперпролактинемия, гипотиреоз, надпочечниковая гиперандрогения и сахарный диабет.
Измеряли рост и массу тела для подсчета индекса массы тела. Выполняли исследование липидного спектра сыворотки крови (колориметрическим фотометрическим методом), концентрации инсулина (иммунохемилюминесцентным методом) и глюкозы (фотометрическим биохимическим методом) натощак и после стимуляции в пероральном тесте толерантности к глюкозе. Методом хемилюминесцентного иммуноанализа в сыворотке крови определяли содержание общего тестостерона, глобулина, связывающего половые гормоны (ГСПГ). Рассчитывали концентрацию свободного тестостерона. Для оценки уровня оксидативного стресса методом высокоэффективной жидкостной хроматографии определяли концентрации в сыворотке крови малонового диальдегида, 8-OH-дезоксигуанозина, коэнзима Q-10 и глутатиона (восстановленного) [23, 24].
Статистический анализ
Статистическую обработку проводили с помощью пакета прикладных программ STATISTICA 10. Критическое значение уровня статистической значимости при проверке нулевых гипотез принималось равным 0,05. Описательная статистика количественных переменных представлена медианой и межквартильным размахом, где Q1 – 25-й квартиль, Q3 – 75-й квартиль. Распределение всех указанных параметров отличалось от нормального. Применялся тест Манна–Уитни для сравнения количественных переменных.
Результаты и обсуждение
В основной группе у 14 пациенток (58,33%) была опсоменорея, у 10 (41,66%) – гиперполименорея или состоявшееся аномальное маточное кровотечение; у 6 (25%) имелись единичные интрамурально расположенные узлы миомы не более 5 см в диаметре. У 9 (37,5%) женщин в анамнезе были роды (в том числе трое (12,5%) забеременели после стимуляции овуляции), у 2 (8,33%) − невынашивание беременности, у 4 (16,66%) − бесплодие. Диагноз «синдром поликистозных яичников (СПКЯ)» (по Роттердамским критериям) был установлен 16 женщинам (66,66%) в основной группе, в том числе у 7 (29,16%) имел место фенотип А.
Индекс массы тела составил от 30,8 до 41,2 кг/м2 у пациенток основной группы и от 29,7 до 40,9 кг/м2 – в контрольной группе, то есть группы были сравнимы по данному параметру.
Основная и контрольная группы не имели статистически значимых отличий по таким показателям липидограммы, как концентрации общего холестерина, триглицеридов, холестерина липопротеинов низкой плотности (ХС-ЛПНП), липопротеинов высокой плотности (ХС-ЛПВП) (табл. 1). В обеих группах были пациентки с нарушениями в липидограмме. Лишь содержание в сыворотке крови липопротеинов очень низкой плотности (ХС-ЛПОНП) было незначительно, но статистически значимо выше у пациенток основной группы, что представляет интерес, поскольку со значительной долей вероятности предполагает наличие эндотелиальной дисфункции [18]. Статистически значимых отличий между группами не обнаружено нами и в показателях обмена углеводов: наблюдения тощаковой и постстимуляционной гиперинсулинемии отмечены в обеих группах, а несколько более высокое содержание инсулина в сыворотке крови после нагрузки в тесте толерантности к глюкозе у пациенток основной группы имело характер тенденции. Отличия в концентрациях тестостерона, в том числе свободного, а также ГСПГ также имели характер тенденции. Возможно, несколько иной результат был бы получен при использовании методов прямого определения свободного тестостерона (использованный нами расчетный метод не принимает во внимание связь небольшого количества гормона с альбумином).
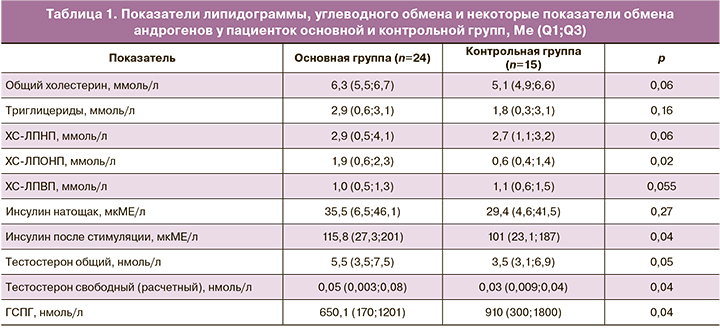
Среди исследованных нами показателей оксидативного стресса (табл. 2) небольшие, но статистически значимые отличия между основной и контрольной группами были обнаружены по содержанию малонового диальдегида – вещества, образующегося в результате метаболизма арахидоновой и других полиненасыщенных жирных кислот; его концентрация была выше в основной группе. Малоновый диальдегид вступает во взаимодействие с фосфолипидами, аминокислотами и нуклеиновыми кислотами. Определение концентрации этого вещества в настоящее время используется в оценке прогноза и контроле терапии при ишемической болезни сердца, а также некоторых нефрологических, инфекционных, онкологических заболеваниях, в клинической практике антивозрастной медицины. В доступной литературе имеются работы об обнаружении повышенной концентрации этого вещества у пациенток с СПКЯ [22, 25]. Считается, что концентрация этого маркера оксидативного стресса связана с нарушениями липидограммы. Обнаруженное нами повышение его концентрации, параллельное повышению в основной группе концентрации ХС-ЛПОНП, подтверждает это утверждение [19].
Концентрация основных антиоксидантов – восстановленного глутатиона и коэнзима Q10 – не отличалась у пациенток основной и контрольной групп. То же самое можно сказать о концентрации 8-OH-дезоксигуанозина – модифицированного нуклеозида, образующегося в молекуле ДНК в результате воздействия активных форм кислорода.
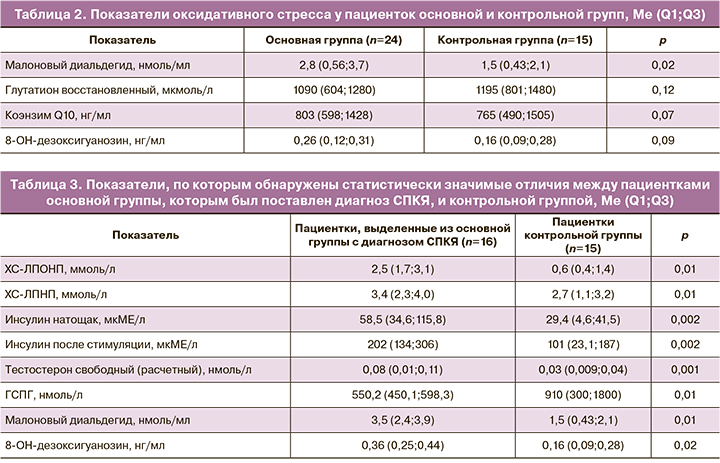
На следующем этапе мы выделили из основной группы женщин с СПКЯ (n=16) и провели сравнение с контрольной группой. В таблице 3 представлены только те показатели, отличия по которым оказались статистически значимыми.
Пациентки с СПКЯ отличались наиболее выраженными нарушениями обмена липидов и углеводов (инсулинорезистентностью), что соответствует данным литературы. Снижение продукции ГСПГ у таких женщин закономерно приводило к более высоким расчетным показателям концентрации свободного тестостерона.
Отличия по содержанию малонового диальдегида между пациентками с СПКЯ из основной группы и контролем были более значительными, чем между основной и контрольной группой. Также оказалось, что при СПКЯ имеется некоторое превышение содержания в сыворотке крови 8-OH-дезоксигуанозина – модифицированного нуклеозида, образующегося в молекуле ДНК в результате воздействия активных форм кислорода. Он обладает мутагенными свойствами и рассматривается в качестве маркера оксидативного стресса и риска канцерогенеза.
Заключение
Полученные данные позволяют предполагать, что оксидативный стресс может играть определенную роль в формировании нарушений менструально-овариального цикла, воздействуя на различные уровни регуляции репродуктивной системы. Уточнение механизмов этого негативного влияния может помочь в разработке индивидуализированных патогенетических методов лечения. Нами изучены лишь некоторые из доступных показателей. В то же время известно, что антиоксидантная система включает в себя множество составляющих – ферментов и низкомолекулярных веществ, в том числе витаминов. Исследование у пациенток с нарушениями менструального цикла всего доступного спектра этих показателей для определения диагностически и прогностически значимых представляется перспективным.
Наиболее значительные отклонения были обнаружены нами в группе пациенток с СПКЯ. Строго говоря, именно за счет показателей женщин с этим заболеванием в основном сформировались отличия между группами. Вопрос о том, являются ли пациентки с СПКЯ более чувствительными к оксидативному стрессу, или само это заболевание способствует его формированию, остается открытым. Инсулинорезистентность при СПКЯ тканеспецифична: она в основном имеет отношение к периферическим тканям (например, мышечной), а ткани яичника сохраняют нормальную и даже повышенную чувствительность к инсулину. Это может быть как генетически детерминированной особенностью, так и следствием, например, действия на ткани активного кислорода или медиаторов воспаления. Вполне вероятно, что негативное влияние оксидативного стресса на репродуктивную систему может иметь место с раннего возраста. Возможно, в тех наблюдениях, в которых диагноз СПКЯ сложен, показатели оксидативного стресса могут рассматриваться в качестве вспомогательного диагностического критерия.



