В последние годы особое внимание уделяется подбору оптимальных параметров культивирования эмбрионов человека в программах вспомогательных репродуктивных технологий (ВРТ) [1–4], поскольку при развитии вне организма матери эмбрион постоянно подвергается стрессовым воздействиям, которые он не испытал бы в естественных условиях. К ним относятся изменение рН среды, температурные колебания, воздействие атмосферных концентраций кислорода, естественного и искусственного света [5]. Для улучшения систем культивирования эмбрионов человека проводится подбор оптимального состава культуральной среды [6–8], однако большинство систем культивирования представляют собой относительно небольшой (до 1 мл) и полностью статичный объем культуральной среды [9–11]. Очевидно, что эти условия далеки от тех, в которых находится эмбрион человека в условиях in vivo [12].
В естественных условиях оплодотворение и преимплантационное развитие эмбриона происходят в маточной трубе. В это время эмбрион находится в постоянном движении за счет перистальтических сокращений мышечной стенки маточной трубы и биения ворсинок ее слизистой оболочки. Мышечные сокращения необходимы для обволакивания гамет и, в последующем, эмбриона секретом маточных труб, что способствует нормальному процессу оплодотворения и продвижению эмбриона по направлению к матке [13].
Помимо секреторного эпителия, слизистая оболочка маточной трубы представлена клетками ворсинчатого эпителия, ворсинки которых постоянно колеблются с частотой от 4,9±0,2 Гц в пролиферативную фазу до 5,8±0,3 Гц в секреторную фазу менструального цикла [14, 15]. По данным Исаченко и соавт. [16], в естественных условиях эмбрион находится под постоянным воздействием вибрации с частотой до 20 Гц. Цилиарные сокращения, вызывая колебания секрета маточной трубы, не только способствуют улучшению диффузии питательных веществ, но и оказывают непосредственное механическое воздействие на эмбрион. Это приводит к активации различных внутриклеточных каскадов [17] и является важным фактором в регуляции преимплантационного развития эмбриона [18].
Таким образом, при развитии в организме матери эмбрион находится в постоянном и весьма сложном динамическом взаимодействии со своим микро- и макроокружением. Сокращение мышц матки, а также маточных труб, вместе с постоянными сокращениями ворсинок эпителиальной выстилки создают уникальные условия для продвижения гамет, оплодотворения и последующего развития эмбриона [19, 20]. Влияние динамического микроокружения на развитие эмбриона как в естественных условиях (in vivo), так и при культивировании in vitro в программах ВРТ не вызывает сомнений [12].
Новым подходом к улучшению условий культивирования эмбрионов человека в программах ВРТ может стать сочетание представленных выше систем культивирования с микровибрацией [16, 21, 22]. Цель исследования – оценить влияние контролируемой механической микровибрации эмбрионов человека первых 5 суток развития на частоту наступления беременности в программах ВРТ.
Материалы и методы
В проспективное исследование были включены 375 супружеских пар без наличия противопоказаний и развития осложнений в ходе проведения программ ВРТ. Перед включением в протокол экстракорпорального оплодотворения (ЭКО) пациентки были обследованы согласно приказу Минздрава Российской Федерации от 30.08.2012 №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [23]. Учитывая пилотный характер исследования, из 375 пациенток 75 пациенток вошли в группу микровибрации, 300 пациенток составили группу контроля.
Критериями невключения в исследование были: невозможность переноса эмбриона в связи с необходимостью проведения преимплантационного генетического тестирования, использование ооцитов донора, возраст пациентки старше 45 лет, плановая криоконсервация всех полученных ооцитов или эмбрионов. Критериями исключения из исследования были: получение менее двух ооцитов стадии развития MII, экстренная криоконсервация всех полученных ооцитов или эмбрионов, отмена переноса эмбриона в связи с риском развития синдрома гиперстимуляции яичников, патологией эндометрия, обострением соматического или инфекционного заболевания, а также желание пациентки прекратить участие в исследовании. Все пациентки подписали добровольное информированное согласие на участие в исследовании. Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Стимуляцию функции яичников проводили по протоколу с антагонистами гонадотропин-рилизинг-гормона (ГнРГ). В качестве триггера овуляции использовали хорионический гонадотропин (ХГЧ) или агонист ГнРГ. Применяли одноэтапное культивирование эмбрионов. Морфологическую оценку эмбрионов по классификации Гарднера (Gardner D.K., 1999) проводил эмбриолог через 120–122 ч после оплодотворения. Перенос эмбрионов в полость матки проводили в нативном цикле на 5-е сутки культивирования. Наступление беременности оценивали по уровню β-ХГЧ в крови пациенток через 14 суток после переноса эмбриона.
При культивировании в условиях механической микровибрации инкубатор помещали на платформу ArisTT180-s (K&S Advanced Systems Ltd, Израиль) в режиме активной вибрации с частотой 40 Гц в течение 30 с с интервалом покоя 30 мин. Культивирование в условиях микровибрации осуществляли на протяжении всего срока от получения ооцитов до проведения переноса (или криоконсервации) эмбриона. Оценку реальной частоты и амплитуды проводили при помощи встроенного осциллографа.
Для статистического анализа и построения графиков использовали пакет статистических программ GraphPad Prism (GraphPad Software, США). Для определения нормальности распределения использовали обобщенный тест Д’Агостино–Пирсона. Для непараметрических количественных данных рассчитывали медиану и интерквартильный размах, использовали тест Манна–Уитни. Для качественных данных рассчитывали абсолютное значение и %, использовали точный тест Фишера и тест Кохрана–Армитажа для линейных трендов с одной степенью свободы. Различия считали статистически значимыми при p<0,05.
Результаты
Пациентки, включенные в исследование, не различались по возрасту, индексу массы тела (ИМТ) и клинико-анамнестическим данным. Так, возраст пациенток группы микровибрации составил 33 (30–39) года, контрольной группы – 34 (30–38) года (p=0,77); возраст супруга составил 35 (31–38) лет в группе микровибрации и 34 (32–38) года в группе контроля (p=0,99). ИМТ пациенток составил 22,3 (20,9–25,6) против 21,8 (20,1–24,3) кг/м2 соответственно (p=0,36). Для 39 (52,0%) пациенток группы микровибрации и 159 (53,0%) пациенток группы контроля данная попытка ЭКО была первой (p=0,49). Пациентки не различались по общему числу попыток овариальной стимуляции и переноса эмбрионов в анамнезе, которое колебалось от 0 до 9 и в среднем составило 0 (0–1) для обеих групп (p=0,77). Средняя продолжительность бесплодия также не различалась в группах сравнения и составила 5 (3–9) и 5 (3–7) лет соответственно (p=0,19).
Не имели беременностей в анамнезе и обратились с жалобами на первичное бесплодие 39 (52,0%) пациенток группы микровибрации и 157 (52,3%) пациенток контрольной группы (p=0,53). Среди пациенток с вторичным бесплодием число беременностей в анамнезе в группе микровибрации составило 2 (1–2), в контрольной группе – 1 (1–2), p=0,31. Среднее число родов, абортов, внематочных беременностей и неразвивающихся беременностей совпадало в обеих группах и для каждого из исходов беременностей составило 0 (0–1), p=0,68, 0,77, 0,77 и 0,66, для вышеперечисленных исходов родов соответственно.
В группе микровибрации цикл овариальной стимуляции закончился переносом одного эмбриона у 52 (69,3%) пациенток, двух эмбрионов – у 11 (14,7%) пациенток. Перенос был отменен в связи с отсутствием эмбриона для переноса у 12 (16,0%) пациенток. В контрольной группе цикл овариальной стимуляции закончился переносом одного эмбриона у 206 (68,7%) пациенток (p=0,52), двух эмбрионов – у 42 (14,0%) пациенток (p=0,50). Перенос был отменен в связи с отсутствием эмбриона, пригодного для переноса, у 52 (17,3%) пациенток (p=0,47).
Частота наступления беременности в расчете на цикл овариальной стимуляции составила 42,7% (n=32) в группе микровибрации против 33,7% (n=101) в группе контроля (p=0,09). Частота наступления беременности в расчете на перенос эмбриона(ов) составила 50,8% в группе микровибрации против 40% в группе контроля (p=0,097). При переносе одного эмбриона беременность наступила у 27 (52,0%) из 52 пациенток группы микровибрации и у 85 (41,3) из 206 пациенток контрольной группы (p=0,11). При переносе двух эмбрионов – у 5 (45,5%) из 11 пациенток группы микровибрации и у 16 (38,1%) из 42 пациенток группы контроля (p=0,46).
Кроме того, мы проанализировали частоту наступления беременности в зависимости от числа перенесенных эмбрионов вне зависимости от способа их культивирования. Частота наступления беременности при переносе одного эмбриона в полость матки составила 43,4%, при переносе двух эмбрионов – 39,6% (p=0,36).
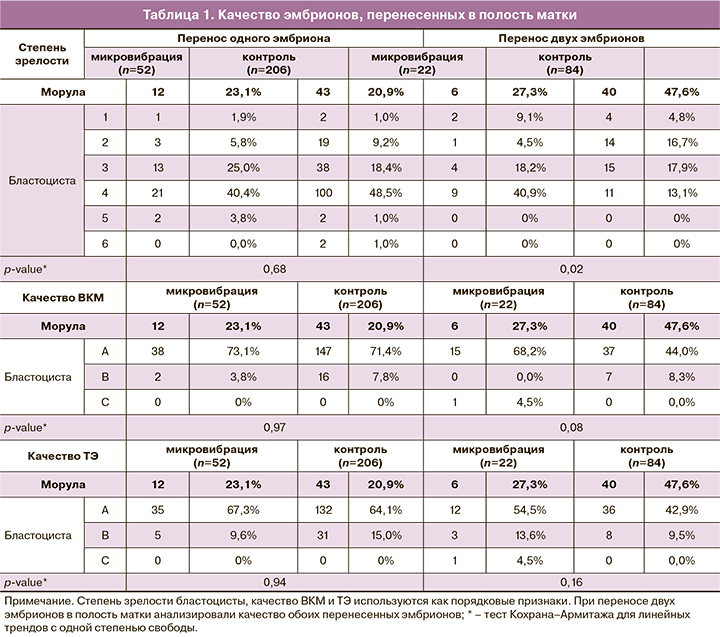
При переносе одного эмбриона степень зрелости эмбриона по классификации Гарднера, качество внутренней клеточной массы (ВКМ) и трофэктодермы (ТЭ) эмбриона, перенесенного в полость матки, не различались в группах сравнения (табл. 1). При переносе двух эмбрионов в полость матки степень зрелости эмбрионов в группе микровибрации была выше, чем в контрольной группе (p=0,02). Качество ВКМ перенесенных эмбрионов также было несколько выше в группе микровибрации (p=0,08), тогда как качество ТЭ не различалось в группах сравнения (p=0,16).
В группе микровибрации 45 (60%) пациенток имели эмбрионы, пригодные для криоконсервации, в группе контроля – 165 (55%) пациенток (p=0,258). Среднее число криоконсервированных эмбрионов было несколько выше в группе микровибрации – 3 (1,5–5) против 2 (1–3) в группе контроля (p=0,06).
Обсуждение
В исследовании мы сравнили эффективность программ ВРТ при культивировании эмбрионов человека в стандартных условиях и при культивировании в условиях контролируемой механической микровибрации, цель которой – максимально возможное приближение условий культивирования эмбриона к естественным. Была проанализирована частота наступления беременности у 375 супружеских пар без наличия противопоказаний и развития осложнений в ходе проведения программ ВРТ.
Пациентки, включенные в исследование, не различались по возрасту, ИМТ и клинико-анамнестическим данным. Также группы были сопоставимы по числу эмбрионов, перенесенных в полость матки. Частота отмены переноса эмбриона также была сопоставима.
Согласно полученным данным, частота наступления беременности в расчете на цикл овариальной стимуляции была на 9% выше при культивировании эмбриона в условиях микровибрации, а в расчете на перенос эмбриона(ов) в полость матки – на 10,8% выше. Полученные данные согласуются с данными других авторов, изучавших применение данной методики для повышения эффективности программ ВРТ. Так, по данным Hur Y.S. и соавт. (2016), применение контролируемой механической микровибрации позволяет повысить частоту наступления беременности на 5,2% [24], по данным Isachenko V. и соавт. (2017) – на 6–9% (в зависимости от возраста пациенток) [25].
Частота наступления беременности не различалась в зависимости от числа перенесенных эмбрионов, что лишь отчасти может быть объяснено более низким качеством эмбрионов при неселективном переносе [26, 27]. При этом эффективность микровибрации была несколько выше при селективном переносе эмбриона, хотя нам не удалось достичь статистической значимости различий из-за уменьшения объема выборки при раздельном анализе селективного и неселективного переносов.
Примечательно, что при переносе двух эмбрионов в полость матки степень зрелости эмбриона по классификации Гарднера, а также качество ВКМ переносимых эмбрионов были выше при культивировании эмбрионов в условиях микровибрации. При этом при переносе одного эмбриона в полость матки данные различия не прослеживались. Это может быть объяснено более выраженным влиянием механической микровибрации на эмбрионы низкого и среднего качества, однако для подтверждения данной гипотезы необходимы дальнейшие исследования с иным дизайном научной работы [12, 24, 25, 28]. Кроме того, в пользу положительного влияния контролируемой механической микровибрации свидетельствует повышение среднего числа эмбрионов, пригодных для криоконсервации с 2 (1–3) до 3 (1,5–5).
Заключение
Использование систем культивирования эмбрионов человека с применением контролируемой механической микровибрации позволяет повысить частоту наступления беременности в программах ВРТ. Тем не менее для внедрения данного способа культивирования эмбрионов в широкую клиническую практику необходимы дальнейшие исследования с оценкой частоты рождения живого и здорового ребенка и отдаленных исходов.



