1) ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, Москва, Россия;
2) ФГБУН «Институт химической биологии и фундаментальной медицины» СО РАН, Новосибирск, Россия;
3) ГБУЗ НСО «Новосибирский городской клинический перинатальный центр», Новосибирск, Россия
Цель. Оценить переносимость введения экстрацеллюлярных микровезикул (ЭМВ) мезенхимальных стромальных клеток (МСК) плацентарного происхождения во время абдоминального родоразрешения и в течение послеоперационного периода.
Материалы и методы. В исследование были включены две группы родильниц, которым проводилось кесарево сечение. Основную группу составили 23 пациентки, которым в ходе абдоминального родоразрешения и после ушивания нижнего сегмента однорядным непрерывным викриловым швом вводилось 500 мкл ЭМВ МСК. В группу сравнения (контрольную) вошли 30 пациенток с традиционным ушиванием матки однорядным непрерывным викриловым швом.
Результаты. У всех родильниц основной группы послеоперационный период протекал без осложнений, и они раньше выписывались из акушерского стационара (послеоперационный койко-день – 4,26+0,09 в сравнении с группой контроля, в которой послеоперационный койко-день составлял 5,33+0,38, p<0,05). Все пациентки основной группы планировали в течение ближайших 2–3 лет повторно реализовать свою генеративную функцию, и в этой связи они были включены в реестр по последующему самопроизвольному родоразрешению с рубцом на матке после кесарева сечения. У пациенток основной группы не было гнойно-септических осложнений, в то время как в группе сравнения послеродовый период осложнился в 2 случаях (6,7%) метроэндометритом и в 1 случае – лохиометрой (3,3%).
Заключение. Таким образом, полученные данные указывают на хорошую переносимость и более высокую эффективность интраоперационного введения ЭМВ по сравнению с традиционным ведением послеродового периода. Первые результаты клинического применения экзосом открывают новые горизонты их использования. Они позволяют надеяться на улучшение репарации миометрия и прогнозировать в перспективе самопроизвольные роды у пациенток с рубцом после кесарева сечения.
экстрацеллюлярные микровезикулы
экзосомы
абдоминальное родоразрешение
Последнее десятилетие ознаменовалось радикальной сменой приоритетов для повторного и последующего абдоминального родоразрешения, поскольку наличие рубца миометрия после перенесенного в анамнезе кесарева сечения переместилось на первое место. Вот почему назрела настойчивая необходимость в поиске новых методов повышения эффективности репарации миометрия после перенесенной операции, чтобы спустя 2–3 года интергенетического интервала женщины смогли родить самопроизвольно. Для повышения регенерации тканей в клинической медицине на протяжении 15 лет с успехом используются клеточные технологии [1–3]. Тем не менее существуют определенные трудности для их широкого внедрения [4–7]. К одному из интересных механизмов действия стволовых клеток можно отнести их способность взаимодействия и обмена как белковым, так и генетическим материалом посредством секреции микровезикул, которые перспективны в плане улучшения репарации тканей, поскольку могут участвовать в передаче межклеточной информации и работать в качестве модулятора [8–13].
Основываясь на вышеизложенном, мы предполагаем, что использование экстрацеллюлярных микровезикул (ЭМВ) позволит улучшить течение послеоперационного периода и в дальнейшем родить самопроизвольно пациенткам с рубцом на матке после кесарева сечения, а системе родовспоможения – снизить частоту абдоминального родоразрешения. Тем более что проведенные экспериментальные исследования на модели кесарева сечения у лабораторных крыс инбредной линии Wag показали способность экзосом находиться в миометрии как интактных животных, так и после произведенного кесарева сечения не менее 8 суток (рис. 1–3) [14, 15].
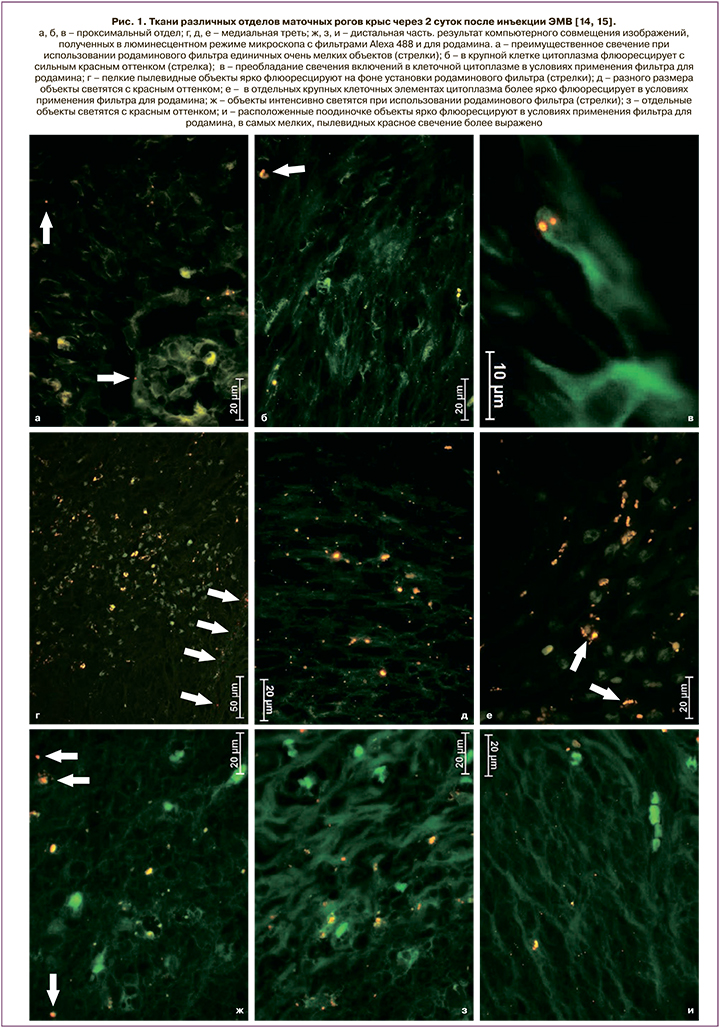
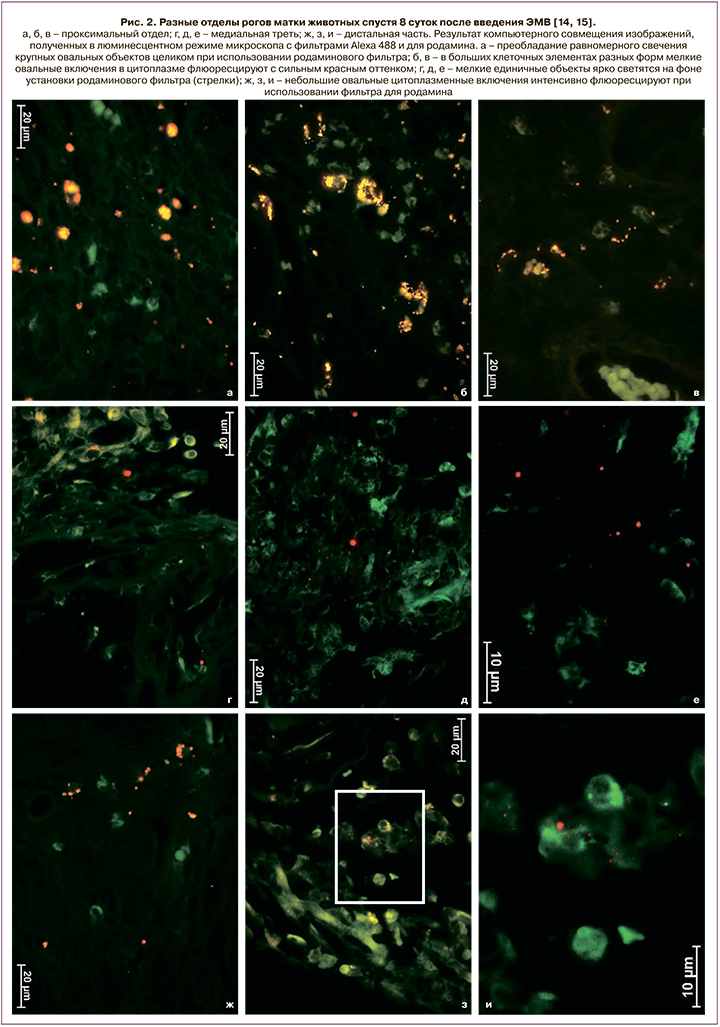
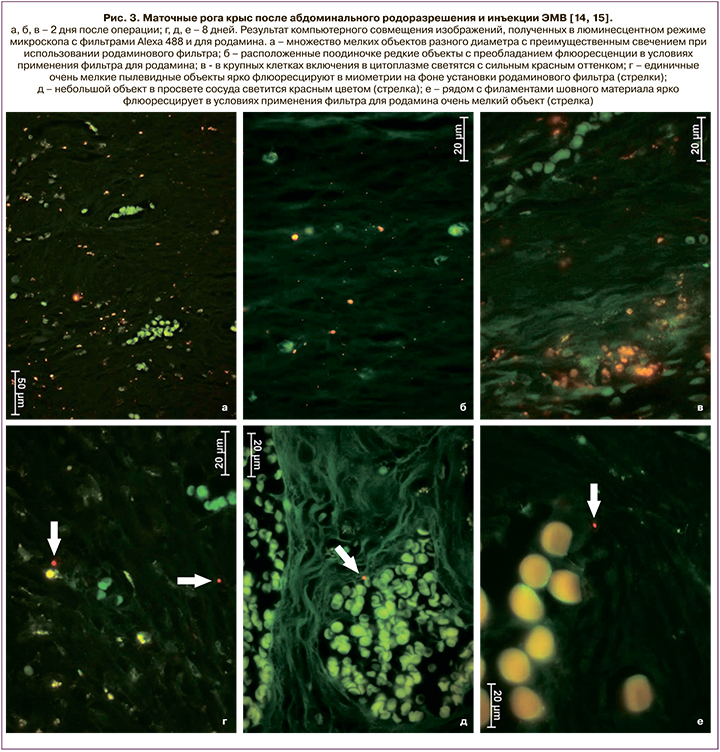
Цель исследования: оценить переносимость введения ЭМВ мезенхимальных стромальных клеток (МСК) плацентарного происхождения во время абдоминального родоразрешения и в течение послеоперационного периода.
Материалы и методы
Обследованы и родоразрешены 53 пациентки. В зависимости от ведения послеоперационного периода все они были разделены на 2 группы: I группа (основная) – 23 беременные и роженицы, которым в ходе кесарева сечения после ушивания матки однорядным непрерывным викриловым швом в область разреза вводилось 500 мкл ЭМВ (экзосом) МСК, полученных в лаборатории клеточных технологий ФГБУ НМИЦ АГП им. В.И. Кулакова [14, 15]. II группа (контрольная) – 30 беременных и рожениц, которым в ходе кесарева сечения проводилось традиционное ушивание нижнего сегмента матки однорядным непрерывным викриловым швом.
Возрастная характеристика беременных и рожениц представлена в таблице 1.
Как видно из представленной таблицы, пациентки были молодыми, и возраст в группах сравнения значимо не различался.

Информация о перенесенных соматических заболеваниях у пациенток из групп сравнения представлена в таблице 2. Что касается соматической патологии, то у беременных и рожениц из группы сравнения не было обнаружено значимых отличий. Практически каждая вторая страдала хроническим тонзиллитом (от 50 до 56,5%). Более чем у 40% диагностировано хроническое воспаление почек и у 17% – бронхов.
При этом инфекционный индекс (отношение общего числа инфекционных заболеваний к числу обследованных) у беременных и рожениц основной группы составил 1,3, а у пациенток из группы сравнения – 1,2 (табл. 2).
В социальном плане практически половина беременных, родоразрешенных путем кесарева сечения, не работали и занимались домашним хозяйством – от 46,6% до 47,8% (табл. 3).
Исходы предыдущих беременностей у пациенток групп сравнения представлены в таблице 4.
Заслуживает внимания, что практически каждая четвертая пациентка, 6 (26,1%) из основной и 7 (23,3%) из группы сравнения, имели в анамнезе прерывание беременности путем артифициального аборта по желанию, что в последующем могло спровоцировать самопроизвольное прерывание беременности у 4 (17, 4%) и 6 (20%) женщин из I и II группы соответственно.

Большое количество абортов находилось в прямой связи с низким уровнем контрацептивного образования включенных в исследование женщин. Фактически только каждая десятая пациентка (8,7%), которой в ходе абдоминального родоразрешения вводились 500 мкл экзосом, использовала какой-либо из методов предупреждения беременности. В группе сравнения показатель принципиально не отличался – 3 (10%).
Возраст менархе у пациенток был стандартным для российских женщин и составлял в среднем 13 лет (табл. 5), существенно не отличаясь в группах сравнения (p>0,05).
При анализе генитальной патологии (табл. 6.) выявлена высокая частота воспалительных заболеваний, что могло спровоцировать бесплодие, на которое предъявляла жалобы практически каждая 8-я беременная из основной – 3 (13,1%) и каждая 10-я – 3 (10%) из контрольной группы.
Таким образом, выполненный анализ клинического материала беременных и рожениц не выявил значимых различий в группах сравнения.
Статистический анализ
Для статистической обработки данных использовали электронные таблицы Microsoft Excel и пакет программ GraphPad Prism 6 (GraphPad Software, USA). При описании количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (M) и стандартное отклонение (SD). При анализе параметрических данных рассчитывали среднее значение и среднеквадратичное отклонение, использовали парный t-test (для связанных данных). Различия считали значимыми при p<0,05.
Результаты и обсуждение
Подавляющее большинство пациенток основной группы – 21 (91,3%), которым интраоперационно вводилось 500 мкл ЭМВ, были первородящими без отягощенного акушерского анамнеза, желающими через 2–3 года родить повторно и самопроизвольно. 10 беременным (43,5%) было выполнено плановое кесарево сечение, учитывая наличие смешанного ягодичного предлежания. В 2 случаях (8,7%) операция выполнялась по поводу краевого предлежания плаценты.
Экстренное кесарево сечение было произведено 13 (56,5%) роженицам: каждой третьей (30,4%) – по поводу развившейся острой внутриутробной гипоксии плода; у каждой пятой (21,7%) показанием для экстренного родоразрешения послужила слабость родовой деятельности, не поддающаяся медикаментозной коррекции и в одном случае – по поводу выпадения петель пуповины при раннем излитии околоплодных вод (табл. 7).

У всех женщин кесарево сечение выполнялось в условиях эпидуральной анестезии с проведением интраоперационной антибактериальной профилактики.
Пациентки из групп сравнения, родоразрешенные путем кесарева сечения, практически не отличались ни по времени оперативного вмешательства, ни по общей интраоперационной кровопотере, ни по продолжительности I периода родов, если проводилось экстренное абдоминальное родоразрешение (табл. 8).
В ходе проведенного сравнительного исследования были выявлены значимые отличия между родильницами основной и контрольной групп по продолжительности безводного промежутка (табл. 8), который у пациенток группы сравнения составил 7,75 ч (0,48) и был меньше, чем у пациенток, которым интраоперационно вводились 500 мкл ЭМВ (р=0,041). Значимые различия были зарегистрированы и по продолжительности послеоперационного койко-дня (4,26 (0,09) в I группе против 5,33 (0,38) во II (р=0,02)). Подобная динамика прослеживалась и по числу лейкоцитов при выписке, которые в группе с интраоперационным введением экзосом составило 11,18 (0,48) ×1099/л, и их количество было значимо меньше, чем в группе сравнения, – 13,04 (0,33) ×109/л (р=0,02). У пациенток основной группы не было послеродовых воспалительных осложнений, тогда как у родильниц без введения экзосом было зафиксировано 2 эндометрита (6,7%) и 1 лохиометра (3,3%).
Заключение
Таким образом, полученные данные указывают на хорошую переносимость и более высокую эффективность интраоперационного введения ЭМВ по сравнению с традиционным ведением послеродового периода.
Первые результаты клинического применения экзосом открывают новые горизонты их использования. Они позволяют надеяться на улучшение репарации миометрия и прогнозировать в перспективе самопроизвольные роды у пациенток с рубцом после кесарева сечения.
- Майбородин И.В., Якимова Н.В., Матвеева В.А., Пекарев О.Г., Майбородина Е.И., Пекарева Е.О. Ангиогенез в рубце матки крыс после введения аутологичных мезенхимальных стволовых клеток костномозгового происхождения. Бюллетень экспериментальной биологии и медицины. 2010; 150(12): 705-11.
- Майбородин И.В., Якимова Н.В., Матвеева В.А., Пекарев О.Г., Майбородина Е.И., Пекарева Е.О., Ткачук О.К. Морфологический анализ результатов введения аутологичных стволовых стромальных клеток костномозгового происхождения в рубец матки крыс. Морфология. 2010; 138(6): 47-55.
- Майбородин И.В., Оноприенко Н.В., Частикин Г.А. Морфологические изменения тканей матки крыс и возможность самопроизвольных родов в результате введения мультипотентных мезенхимных стромальных клеток на фоне гидрометры. Бюллетень экспериментальной биологии и медицины. 2015; 159(4): 511-6.
- Rodrigues M., Yates C.C., Nuschke A., Griffith L., Wells A. The matrikine tenascin-C protects multipotential stromal cells/mesenchymal stem cells from death cytokines such as FasL. Tissue Eng. Part A. 2013; 19(17-18): 1972-83. https://dx.doi.org/10.1089/ten.TEA.2012.0568.
- Майбородин И.В., Матвеева В.А., Маслов Р.В., Оноприенко Н.В., Кузнецова И.В., Частикин Г.А., Аникеев А.А. Некоторые реакции регионарных лимфатических узлов крыс после имплантации в дефект костной ткани мультипотентных стромальных клеток, адсорбированных на полигидроксиалканоате. Морфология. 2016; 149(2): 21-6.
- Майбородин И.В., Морозов В.В., Аникеев А.А., Фигуренко Н.Ф., Маслов Р.В., Частикин Г.А., Матвеева В.А., Майбородина В.И. Макрофагальный ответ у крыс на введение мультипотентных мезенхимальных стромальных клеток в регион хирургической травмы. Новости хирургии. 2017; 25(3): 233-41.
- Yates C.C., Nuschke A., Rodrigues M., Whaley D., Dechant J.J., Taylor D.P., Wells A. Improved transplanted stem cell survival in a polymer gel supplemented with Tenascin C accelerates healing and reduces scarring of murine skin wounds. Cell Transplant. 2017; 26(1): 103-13. https://dx.doi.org/10.3727/096368916X692249.
- Takeda Y.S., Xu Q. Neuronal differentiation of human mesenchymal stem cells using exosomes derived from differentiating neuronal cells. PLoS One. 2015; 10(8): e0135111. https://dx.doi.org/10.1371journal.pone.0135111.
- Furuta T., Miyaki S., Ishitobi H., Ogura T., Kato Y., Kamei N. et al. Mesenchymal stem cell-derived exosomes promote fracture healing in a mouse model. Stem Cells Transl. Med. 2016; 5(12): 1620-30. https://dx.doi.org/10.5966/sctm.2015-0285.
- Narayanan R., Huang C.C., Ravindran S. Hijacking the cellular mail: exosome mediated differentiation of mesenchymal stem cells. Stem Cells Int. 2016; 2016: 3808674. https://dx.doi.org/10.1155/2016/3808674.
- van der Pol E., Böing A.N., Harrison P., Sturk A., Nieuwland R. Classification, functions, and clinical relevance of extracellular vesicles. Pharmacol. Rev. 2012; 64(3): 676-705. https://dx.doi.org/10.1124/pr.112.005983.
- Akers J.C., Gonda D., Kim R., Carter B.S., Chen C.C. Biogenesis of extracellular vesicles (EV): exosomes, microvesicles, retrovirus-like vesicles, and apoptotic bodies. J. Neurooncol. 2013; 113(1): 1-11. https://dx.doi.org/10.1007/s11060-013-1084-8.
- Février B., Raposo G. Exosomes: endosomal-derived vesicles shipping extracellular messages. Curr. Opin. Cell Biol. 2004; 16(4): 415-21. https://dx.doi.org/10.1016/j.ceb.2004.06.003.
- Сухих Г.Т., Пекарев О.Г., Майбородин И.В., Силачев Д.Н., Шевцова Ю.А., Горюнов К.В., Оноприенко Н.В., Майбородина В.И., Галенок Р.В., Новиков А.М., Пекарева Е.О. К вопросу о сохранности экстрацеллюлярных микровезикул мезенхимных стромальных клеток после абдоминального родоразрешения в эксперименте. Клеточные технологии в биологии и медицине. 2020; 1: 3-11.
- Sukhikh G.T., Pekarev О.G., Maiborodin I.V., Silachev D.N., Shevtsova Y.А., Gоrуunоv K.V., Onoprienko N.V., Maiborodina V.I., Galenok R.V., Novikov A.M., Pekareva Е.О. Preservation of mesenchymal stem cell-derived extracellular vesicles after abdominal delivery in the experiment. Bull. Exp. Biol. Med. 2020; 169(1): 122-9. https://dx.doi.org/10.1007/s10517-020-04838-1.
Поступила 22.10.2020
Принята в печать 24.11.2020
Сухих Геннадий Тихонович, д.м.н., профессор, академик РАН, директор ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России. Тел.: +7(495)438-18-00.
Е-mail: g_sukhikh@oparina4.ru. 117997, Москва, ул. Академика Опарина, д. 4.
Пекарев Олег Григорьевич, д.м.н., профессор, заместитель директора института акушерства, ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России.
E-mail: o_pekarev@oparina4.ru. ORCID: 0000-0001-7122-6830.
117997, Москва, ул. Академика Опарина, д. 4.
Пекарева Евгения Олеговна, к.м.н., врач акушер-гинеколог, ГБУЗ НСО «Новосибирский городской клинический перинатальный центр». Тел.: +7(383)267-89-55.
E-mail: pekareva_e@mail.ru. ORCID: 0000-0002-6335-2121. 630090, Россия, Новосибирск, ул. А. Лежена, д. 32.
Майбородин Игорь Валентинович, д.м.н., профессор, главный научный сотрудник Лаборатории стволовых клеток, ФГБУН «Институт химической биологии и фундаментальной медицины» СО РАН. Тел.: +7(383)363-51-50. E-mail:
imai@mail.ru. ORCID: 0000-0002-8182-5084. 630090, Россия, Новосибирск, пр. Ак. Лаврентьева, д. 8.
Силачев Денис Николаевич, д.б.н., руководитель лаборатории клеточных технологий, ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России.
E-mail: silachevdn@genebee.msu.ru. ORCID: 0000-0003-0581-9755.
117997, Москва, ул. Академика Опарина, д. 4.
Баранов Игорь Иванович д.м.н., профессор, заведующий отделом научно-образовательных программ, ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России.
E-mail: i_baranov@oparina4.ru. ORCID: 0000-0002-9813-2823.
117997, Россия, Москва, ул. Академика Опарина, д. 4.
Поздняков Иван Михайлович, д.м.н., профессор, главный врач ГБУЗ НСО «Новосибирский городской клинический перинатальный центр». Тел.: +7(383)267-93-11. ORCID: 0000-0003-0600-3053. 630090, Россия, Новосибирск, ул. А. Лежена, д. 32.
Бушуева Наталья Сергеевна, заведующая родильным отделением, ГБУЗ НСО «Новосибирский городской клинический перинатальный центр».
ORCID: 0000-0002-1036-6925. 630090, Россия, Новосибирск, ул. А. Лежена, д. 32.
Новиков Алексей Михайлович, м.н.с. лаборатории стволовых клеток, ФГБУН «Институт химической биологии и фундаментальной медицины» СО РАН.
ORCID: 0000-0003-1371-7492. 630090, Россия, Новосибирск, пр. Ак. Лаврентьева, д. 8.
Для цитирования: Сухих Г.Т., Пекарев О.Г., Пекарева Е.О., Майбородин И.В., Силачев Д.Н., Баранов И.И., Поздняков И.М., Бушуева Н.С., Новиков А.В. Первые результаты клинического применения экстрацеллюлярных микровезикул мезенхимальных стромальных клеток после абдоминального родоразрешения.
Акушерство и гинекология. 2021; 1: 52-60
https://dx.doi.org/10.18565/aig.2021.1.52-60









